修回日期: 2012-12-12
接受日期: 2012-12-20
在线出版日期: 2012-12-28
目的: 研究胃癌患者外周血CD4+CD25+Foxp3+调节性T细胞(Treg)及Th17细胞表达的临床意义.
方法: 收集胃癌患者(n = 77)与健康志愿者(n = 20)外周血并分离获取PBMC; 流式细胞术分析CD4+CD25+Foxp3+Treg表达; PMA+Ionomycin 联合刺激后, 流式细胞术检测CD4+IL-17+Th17表达; 结合临床资料分析Treg及Th17表达的临床意义.
结果: 胃癌组患者外周血Th17和Treg表达均显著高于正常组(P<0.05). 进一步临床分析发现, 胃癌患者外周血中Treg细胞表达水平与胃癌临床分期、肿瘤浸润深度及淋巴结转移有关; 未见Th17与胃癌临床分期、浸润深度及淋巴结转移相关.
结论: 尽管两群Th细胞在胃癌患者体内显著升高, 但仅Treg与肿瘤进展相关, Th17的作用尚需进一步探讨.
引文著录: 叶妮, 张光波, 高楠, 黄语嫣, 钱夷婷, 李伏超, 朱一凡, 陈卫昌. Th17与Foxp3+Treg在胃癌患者外周血中的表达. 世界华人消化杂志 2012; 20(36): 3689-3694
Revised: December 12, 2012
Accepted: December 20, 2012
Published online: December 28, 2012
AIM: To analyze the clinical significance of the number of Th17 and CD4+CD25+Foxp3+Treg cells in peripheral blood of patients with gastric carcinoma.
METHODS: Peripheral blood samples were collected from patients with gastric cancer (n = 77) and healthy volunteers (n = 20) and used to separate PBMCs. The number of CD4+CD25+Foxp3+Treg was determined by flow cytometry, and the number of CD4+IL-17+Th17 was determined after co-stimulation with PMA and ionomycin. The clinical significance of the number of Treg and Th17 cells in patients with gastric carcinoma was then analyzed.
RESULTS: The numbers of Th17 and Treg cells in peripheral blood of patients with gastric cancer were significantly higher than those in normal controls (both P < 0.05). The number of Treg cells, not Th17 cells, was closely related to degree of tumor infiltration, lymph node metastasis, and tumor clinical stage.
CONCLUSION: Although the numbers of both Th17 and Treg cells are significantly higher in patients with gastric cancer, only the latter is related to tumor infiltration.
- Citation: Ye N, Zhang GB, Gao N, Huang YY, Qian YT, Li FC, Zhu YF, Chen WC. Clinical significance of number of Th17 and Foxp3+Treg cells in peripheral blood of patients with gastric cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3689-3694
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3689.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3689
胃癌是最常见的恶性肿瘤之一, 现有治疗方式如手术联合化疗或放化疗, 在进展期控制胃癌存在巨大困难[1,2]. 越来越多的文献报道肿瘤的发生发展与肿瘤宿主的免疫状态密切相关[3,4], 因而分析胃癌患者的免疫状态, 了解胃癌发生发展机制是寻求新的治疗策略的重要前提. 据报道, CD4+辅助性T细胞可分为4种类型: Th1、Th2、Th17和调节性T细胞. 近年来, Th17及Treg成为研究者们竞相报道的热门对象, 目前已被证明, 在自身免疫性疾病、炎症性肠病及移植物抗宿主病中, 存在着Th17/Treg细胞失衡现象[5,6], 而其在肿瘤发生中的作用的相关报道有限. 本研究采用流式细胞仪分析我院77例胃癌患者及20例健康志愿者外周血Th17及Treg细胞水平, 探讨其与胃癌发生发展的关系.
选取2011-10/2012-06苏州大学附属第一医院就诊胃癌患者77例(均经胃镜活检或手术病理证实), 其中男54例, 女23例, 年龄24-84岁, 平均年龄为62岁. 我院就诊的77胃癌患者中54例患者行手术治疗, 根据UICC/AJCC颁布的胃癌TNM分期标准(2010)将行手术治疗的54例胃癌患者按临床病理分期, 早期胃癌(ⅠA、ⅠB期)10例, 中晚期胃癌(ⅡA、ⅡB、ⅢA、ⅢB、Ⅳ期)44例. 健康志愿者20例, 取自健康体检者(均无心、肝、肺、肾等重要脏器疾病, 肝肾功能正常, 均无肿瘤家族史), 其中男10例, 女10例, 年龄58-79岁, 平均年龄65岁. FITC anti-human CD4、PE anti-human IL-17购自美国Biolegend公司; FITC anti-human CD4、APC anti-human CD25、PE anti-human Foxp3、PE Rat IgG2a、固定破膜剂和破膜缓冲剂购自美国eBioscience公司; FC500型流式细胞仪购自法国Beckman Coulter公司.
1.2.1 淋巴细胞的提取: 所有受试对象于清晨抽取空腹外周血3 mL, EDTA抗凝, 用淋巴细胞分离液(Ficoll液)分离外周血PBMC.
1.2.2 Th17细胞检测: 配制1×106个/100 μL细胞悬液, 用FITC anti-human CD4/PE anti-human IL-17两色抗体对新鲜分离的单个核细胞进行标记检测. 加入PMA(1 μg/mL)0.5 μL, Ionomycin(1 μg/mL)0.5 μL, 置于37 ℃培养箱中刺激1 h, 加入BFA 2 μL, 置于37 ℃培养箱中刺激3 h, 用PBS洗涤弃上清, 加入FITC anti-human CD4抗体30 μL, 4 ℃避光孵育15 min后, 用PBS洗涤弃上清, 加入固定剂100 μL, 4 ℃避光孵育15 min, 加入破膜剂100 μL离心弃上清, 加入PE anti-human IL-17抗体5 μL, 混匀, 4 ℃避光孵育30 min, PBS洗涤弃上清后再加入PBS 300 μL, 充分混匀后用流式细胞仪检测.
1.2.3 CD4+CD25+Foxp3+Treg细胞检测: 配制1×106个/100 μL细胞悬液, 用FITC anti-human CD4/APC anti-human CD25/PE anti-human Foxp3三色抗体对新鲜分离的单个核细胞进行标记检测. 加膜抗体FITC anti-human CD4、APC anti-human CD25各5 μL, 4 ℃避光孵育30 min后, 用PBS洗涤弃上清. 加入固定破膜剂1 mL, 混匀, 常温避光孵育45 min后, 加入破膜缓冲剂2 mL离心弃上清, 加入抗体PE anti-human Foxp3(同型对照PE Rat IgG2a)5 μL, 混匀, 4 ℃避光孵育45 min, 再用破膜缓冲剂2 mL, 离心弃上清, 各管加入PBS 300 μL, 充分混匀后流式细胞仪检测.
1.2.4 计算公式: Th17(%) = (CD4+IL17+/CD4+)×100%; Treg(%) = (CD4+CD25+Foxp3+/CD4+)×100%.
统计学处理 测得数据采用SPSS16.0统计软件进行分析, 数据用mean±SD表示, 比较采用两独立样本t检验; 以P<0.05为差异具有统计学意义.
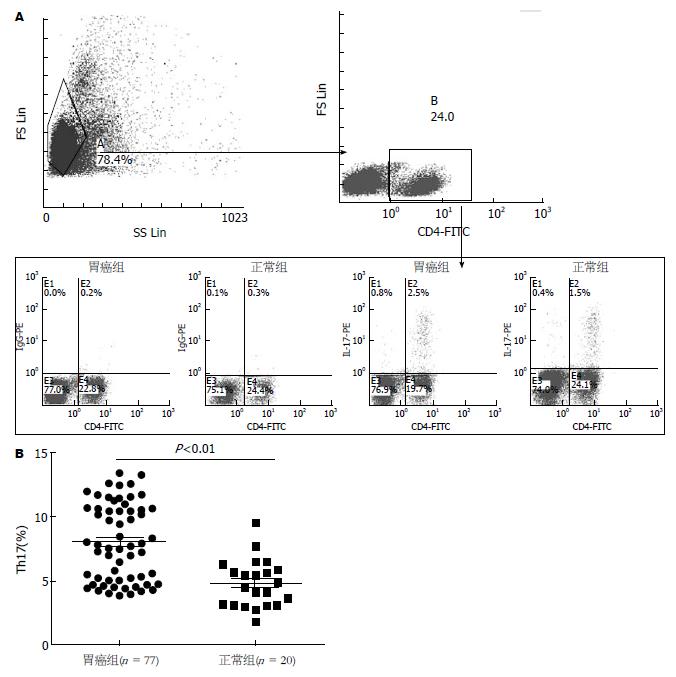
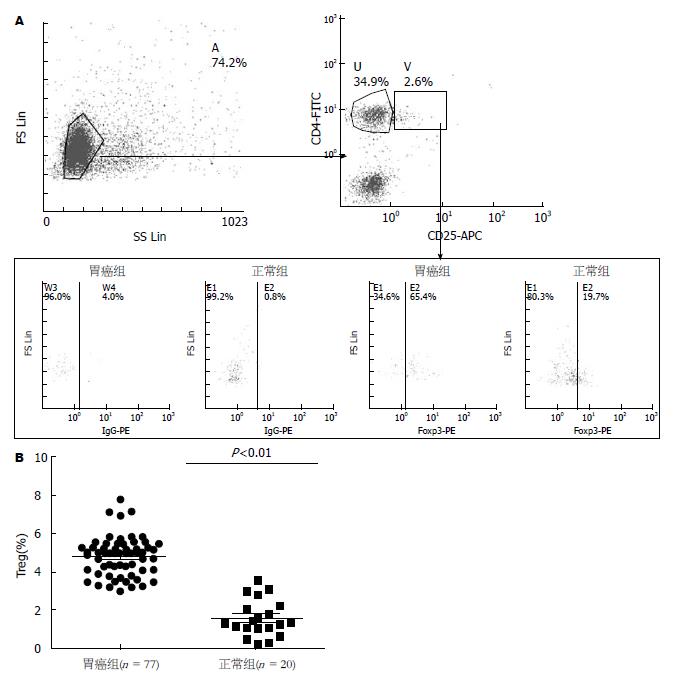
对77例胃癌患者及20例正常对照组外周血进行检测, 结果发现胃癌组外周血Th17(8.16%±3.13%)显著高于正常对照组(4.85%±1.85%)(图1); 同时, 本研究还发现, 胃癌组外周血CD4+CD25+Foxp3+Treg细胞(4.72%±1.01%)显著高于正常对照组(1.57%±0.99%)(图2).
本次实验所收77例胃癌患者中54例于我院行手术治疗(术后病理类型均为胃黏膜腺癌), 根据UICC/AJCC颁布的胃癌TNM分期标准(2010)将胃癌患者按临床病理分期, 其中早期胃癌(Ⅰa、Ⅰb期)10例, 中晚期胃癌(Ⅱ、Ⅲa、Ⅲb、Ⅳ期)44例, 发现胃癌患者外周血中CD4+CD25+Foxp3+Treg细胞占CD4+T细胞比例与胃癌临床分期、肿瘤浸润深度及淋巴结转移有关(P<0.05) , 未发现Th17与胃癌临床分期、浸润深度、淋巴结转移相关(表1).
| 临床特征 | n | Th17 | P值 | CD4+CD25+Foxp3+Treg | P值 |
| 肿瘤分期 | |||||
| 早期( Ia、Ib期) | 10 | 9.32±3.66 | 0.432 | 3.56±0.42 | 0.043 |
| 中晚期( II、IIIa、IIIb、IV期) | 44 | 7.65±2.86 | 5.71±1.05 | ||
| 肿瘤浸润深度 | |||||
| T1+T2 | 13 | 10.05±3.25 | 0.604 | 3.42±0.21 | 0.042 |
| T3+T4 | 41 | 7.20±2.69 | 5.31±0.84 | ||
| 有无淋巴结转移 | |||||
| 无 | 8 | 10.12±3.63 | 0.254 | 3.51±0.28 | 0.048 |
| 有 | 46 | 7.33±2.71 | 5.32±0.85 |
肿瘤是严重威胁人类健康的常见疾病, 在我国每年恶性肿瘤患者超过160万人, 使之成为第1位致死病因. 因此, 越来越多的研究者将研究的重点放于肿瘤早期诊断与治疗中, 而免疫治疗目前已成为继手术、放化疗之后的另一种肿瘤治疗方法, 其目的是激发调动机体免疫系统, 增强肿瘤微环境抗肿瘤免疫力, 控制并杀伤肿瘤细胞. Th17及Treg细胞是当前广被研究的两种具有相反作用的淋巴细胞群, 二者之间存在复杂关系. 目前国内外陆续有相关文献报道肺癌、胃肠道肿瘤等多种肿瘤患者存在外周血CD4+CD25+Foxp3+Treg细胞成分增加[7-9], 提示肿瘤患者可能存在天然免疫反应, 而Th17细胞与Treg细胞在分化与调节过程中密切相关. Kryczek等[10]在动物模型中发现Treg与Th17细胞比例随着肿瘤进展同步增高, 且在进展期肿瘤中达到最高水平. 既往研究表明, Th细胞亚群间具有可塑性, Foxp3+调节性T细胞在IL-6及TGF-β作用下可重新编程分化为Th17样细胞, 诱导初始CD4+T细胞分化为Treg细胞[11-13], Foxp3+调节性T细胞亦可分化为Th17细胞[14]. 目前已证实在前列腺癌、非小细胞肺癌、卵巢癌、结肠癌、胃癌等多种恶性肿瘤患者体内中均存在Th17高水平表达[15-19].
本文研究结果显示, 胃癌患者外周血Th17及Treg细胞水平均较正常组升高, 且胃癌患者Treg/Th17比例显著高于正常对照组, 提示胃癌患者体内存在Th17/Treg细胞失衡(结果未示). 进一步分析发现, 仅胃癌患者外周血中CD4+CD25+Foxp3+Treg细胞与胃癌临床分期、肿瘤浸润深度及淋巴结转移有关, 而Th17与胃癌临床分期、浸润深度、淋巴结转移无相关. 故我们认为相较于Th17, Treg细胞在肿瘤进展中发挥着更为重要的作用.
研究者们发现, 在肿瘤微环境中, 抗原特异性Treg细胞可诱导肿瘤特异性的局部免疫耐受, 促进肿瘤细胞的增长. 通过有效抑制效应细胞的激活或减少效应细胞到达肿瘤组织数量来抑制效应细胞活性. 研究表明, Treg细胞的抑制功能具有细胞接触依赖性[20]. 如小鼠Treg细胞被证实表达穿孔素及颗粒酶B, 一经活化可杀伤效应T细胞[21]或树突样细胞[22], 尤其是在肿瘤微环境中. Treg细胞可高水平表达CTLA-4, 为抗原提呈细胞CD80/86提供消极信号从而下调共刺激分子减少T细胞的活化[23]. 然而目前对于Th17在肿瘤中的作用仍不十分明确, TH17与肿瘤微环境中Th1细胞、CD8+T细胞、NK细胞呈正相关, 而与Treg细胞负相关[24,25]. Su等[26]发现癌症患者中肿瘤浸润淋巴细胞中TH17数量明显高于非肿瘤组织TH17数量. Sfanos等[27]发现在前列腺癌中TH17水平与肿瘤进展呈负相关. 也许在Th17抗癌作用的研究中, IL-17所发挥的作用最让人困惑. Wakita等[28]的一项近期研究表明在肿瘤微环境中, IL-17似乎扮演着二重角色, 一方面其可促进肿瘤相关血管生成, 是肿瘤体内微血管数量和密度显著增加, 更有利于肿瘤生长、转移和浸润[29]; 另一方面, Th17细胞可促进抗肿瘤免疫应答, 抑制肿瘤的生长和转移[30].
调节性T细胞耗竭已成功在Foxp3+转基因小鼠实验模型中试验. Treg细胞在小鼠模型中的损耗, 可诱导生成强力的抗肿瘤物质, 从而诱发肿瘤抑制反应. 然而, 在人体内, 允许选择性耗竭Treg细胞的表面抗原识别尚未实现. 同时科学家们将目光转向人类肿瘤微环境中的Th17细胞, Th17细胞的存在和功能都与减少肿瘤进展和改善病人的生存有关. 在已建立的小鼠模型中, 研究证明Th17具有强有力的抗肿瘤疗效, 而其作用可能因肿瘤不同类型、位置及肿瘤阶段而异. 故积极了解肿瘤微环境中Treg及Th17所发挥的作用, 有利于更好的了解肿瘤发生发展过程, 从而寻找治疗方案.
目前我们对于Th17/Treg细胞的产生、分化发育、病理机制及在肿瘤微环境中的相互关系的认识仍然十分有限, Th17/Treg在机体免疫组织、器官、免疫分子的复杂和功能的多样化等领域中仍有许多悬而未决的问题需要解决[31].
胃癌是最常见的恶性肿瘤之一, 其存在发病率逐年升高、早期症状隐匿、发现晚、预后差等特点. 因此, 胃癌的早期诊断及治疗成为近年研究的热点. 辅助性T细胞17(Th17)和调节性T细胞(Treg)调控关系的失衡在胃癌发生发展中发挥重要作用.
郑鹏远, 教授, 主任医师, 副院长, 郑州大学第二附属医院消化科
Sasada发现肺癌、胃肠道肿瘤等多种肿瘤患者外周血CD4+CD25+Foxp3+Treg细胞成分增加, 而另有相关研究显示Th17细胞与Treg细胞在分化与调节过程中密切相关. 然而目前对于Th17在肿瘤中的作用仍不十分明确, Wakita的一项研究表明在肿瘤微环境中, Th17似乎扮演着双重角色.
本实验对胃癌外周血中Foxp3+Treg及Th17表达进行研究, 尽管两群Th细胞在胃癌患者体内显著升高, 但仅Treg与肿瘤进展相关, Th17的作用尚需进一步探讨. 提示Treg细胞参与胃癌的发生发展过程, 期望为胃癌免疫治疗提供新思路.
本研究从疾病发生发展角度出发, 对不同肿瘤分期患者外周血进行研究, 发现Foxp3+Treg细胞表达随着肿瘤进展而升高, 从而发现Treg的消长与疾病进展有关.
调节性T细胞: 调节性T细胞可分为天然产生的自然调节性T细胞(nTreg)和诱导产生的适应性调节性T细胞(aTreg或iTreg), 如Th3、Tr1, 另外亦有CD8 Treg、NKT细胞等, 与自身免疫性疾病的发生关系密切, 其异常表达可导致自身免疫性疾病.Th17: 辅助性T 细胞17是一种新发现的能够分泌白介素17的T细胞亚群, 在自身免疫性疾病和机体防御反应中具有重要的意义.细胞毒T淋巴细胞相关抗原4: 又名CD152, 是一种白细胞分化抗原, 是T细胞上的一种跨膜受体, 与CD28共同享有B7分子配体, 而CTLA-4与B7分子结合后诱导T细胞无反应性, 参与免疫反应的负调节.
本文对研究胃癌的发生发展具有一定的理论意义.
编辑: 田滢 电编:鲁亚静
| 1. | Arkenau HT. Gastric cancer in the era of molecularly targeted agents: current drug development strategies. J Cancer Res Clin Oncol. 2009;135:855-866. [PubMed] [DOI] |
| 2. | Wu K, Nie Y, Guo C, Chen Y, Ding J, Fan D. Molecular basis of therapeutic approaches to gastric cancer. J Gastroenterol Hepatol. 2009;24:37-41. [PubMed] [DOI] |
| 3. | Lissoni P, Brivio F, Ferrante R, Vigore L, Vaghi M, Fumagalli E, Bucovec R, Malugani F, Fumagalli L. Circulating immature and mature dendritic cells in relation to lymphocyte subsets in patients with gastrointestinal tract cancer. Int J Biol Markers. 2000;15:22-25. [PubMed] |
| 4. | Decensi A, Costa A. Recent advances in cancer chemoprevention, with emphasis on breast and colorectal cancer. Eur J Cancer. 2000;36:694-709. [DOI] |
| 5. | Afzali B, Lombardi G, Lechler RI, Lord GM. The role of T helper 17 (Th17) and regulatory T cells (Treg) in human organ transplantation and autoimmune disease. Clin Exp Immunol. 2007;148:32-46. [PubMed] [DOI] |
| 8. | Li L, Chao QG, Ping LZ, Xue C, Xia ZY, Qian D, Shi-ang H. The prevalence of FOXP3+ regulatory T-cells in peripheral blood of patients with NSCLC. Cancer Biother Radiopharm. 2009;24:357-367. [PubMed] [DOI] |
| 9. | Sasada T, Kimura M, Yoshida Y, Kanai M, Takabayashi A. CD4+CD25+ regulatory T cells in patients with gastrointestinal malignancies: possible involvement of regulatory T cells in disease progression. Cancer. 2003;98:1089-1099. [PubMed] [DOI] |
| 10. | Kryczek I, Wei S, Zou L, Altuwaijri S, Szeliga W, Kolls J, Chang A, Zou W. Cutting edge: Th17 and regulatory T cell dynamics and the regulation by IL-2 in the tumor microenvironment. J Immunol. 2007;178:6730-6733. [PubMed] |
| 11. | Yang XO, Nurieva R, Martinez GJ, Kang HS, Chung Y, Pappu BP, Shah B, Chang SH, Schluns KS, Watowich SS. Molecular antagonism and plasticity of regulatory and inflammatory T cell programs. Immunity. 2008;29:44-56. [PubMed] [DOI] |
| 12. | Xu L, Kitani A, Fuss I, Strober W. Cutting edge: regulatory T cells induce CD4+CD25-Foxp3- T cells or are self-induced to become Th17 cells in the absence of exogenous TGF-beta. J Immunol. 2007;178:6725-6729. [PubMed] |
| 13. | Bettelli E, Carrier Y, Gao W, Korn T, Strom TB, Oukka M, Weiner HL, Kuchroo VK. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 2006;441:235-238. [PubMed] [DOI] |
| 14. | Koenen HJ, Smeets RL, Vink PM, van Rijssen E, Boots AM, Joosten I. Human CD25highFoxp3pos regulatory T cells differentiate into IL-17-producing cells. Blood. 2008;112:2340-2352. [PubMed] [DOI] |
| 15. | Steiner GE, Newman ME, Paikl D, Stix U, Memaran-Dagda N, Lee C, Marberger MJ. Expression and function of pro-inflammatory interleukin IL-17 and IL-17 receptor in normal, benign hyperplastic, and malignant prostate. Prostate. 2003;56:171-182. [PubMed] [DOI] |
| 16. | Numasaki M, Watanabe M, Suzuki T, Takahashi H, Nakamura A, McAllister F, Hishinuma T, Goto J, Lotze MT, Kolls JK. IL-17 enhances the net angiogenic activity and in vivo growth of human non-small cell lung cancer in SCID mice through promoting CXCR-2-dependent angiogenesis. J Immunol. 2005;175:6177-6189. [PubMed] |
| 17. | Kato T, Furumoto H, Ogura T, Onishi Y, Irahara M, Yamano S, Kamada M, Aono T. Expression of IL-17 mRNA in ovarian cancer. Biochem Biophys Res Commun. 2001;282:735-738. [PubMed] [DOI] |
| 18. | Le Gouvello S, Bastuji-Garin S, Aloulou N, Mansour H, Chaumette MT, Berrehar F, Seikour A, Charachon A, Karoui M, Leroy K. High prevalence of Foxp3 and IL17 in MMR-proficient colorectal carcinomas. Gut. 2008;57:772-779. [PubMed] [DOI] |
| 19. | Zhou Y, Toh ML, Zrioual S, Miossec P. IL-17A versus IL-17F induced intracellular signal transduction pathways and modulation by IL-17RA and IL-17RC RNA interference in AGS gastric adenocarcinoma cells. Cytokine. 2007;38:157-164. [PubMed] [DOI] |
| 20. | Shevach EM. Mechanisms of foxp3+ T regulatory cell-mediated suppression. Immunity. 2009;30:636-645. [PubMed] [DOI] |
| 21. | Ji Q, Gondek D, Hurwitz AA. Provision of granulocyte-macrophage colony-stimulating factor converts an autoimmune response to a self-antigen into an antitumor response. J Immunol. 2005;175:1456-1463. [PubMed] |
| 22. | Boissonnas A, Scholer-Dahirel A, Simon-Blancal V, Pace L, Valet F, Kissenpfennig A, Sparwasser T, Malissen B, Fetler L, Amigorena S. Foxp3+ T cells induce perforin-dependent dendritic cell death in tumor-draining lymph nodes. Immunity. 2010;32:266-278. [PubMed] [DOI] |
| 23. | Wing K, Onishi Y, Prieto-Martin P, Yamaguchi T, Miyara M, Fehervari Z, Nomura T, Sakaguchi S. CTLA-4 control over Foxp3+ regulatory T cell function. Science. 2008;322:271-275. [PubMed] [DOI] |
| 24. | Kryczek I, Banerjee M, Cheng P, Vatan L, Szeliga W, Wei S, Huang E, Finlayson E, Simeone D, Welling TH. Phenotype, distribution, generation, and functional and clinical relevance of Th17 cells in the human tumor environments. Blood. 2009;114:1141-1149. [PubMed] [DOI] |
| 25. | Curiel TJ, Coukos G, Zou L, Alvarez X, Cheng P, Mottram P, Evdemon-Hogan M, Conejo-Garcia JR, Zhang L, Burow M. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival. Nat Med. 2004;10:942-949. [PubMed] [DOI] |
| 26. | Su X, Ye J, Hsueh EC, Zhang Y, Hoft DF, Peng G. Tumor microenvironments direct the recruitment and expansion of human Th17 cells. J Immunol. 2010;184:1630-1641. [PubMed] [DOI] |
| 27. | Sfanos KS, Bruno TC, Maris CH, Xu L, Thoburn CJ, DeMarzo AM, Meeker AK, Isaacs WB, Drake CG. Phenotypic analysis of prostate-infiltrating lymphocytes reveals TH17 and Treg skewing. Clin Cancer Res. 2008;14:3254-3261. [PubMed] [DOI] |
| 28. | Wakita D, Sumida K, Iwakura Y, Nishikawa H, Ohkuri T, Chamoto K, Kitamura H, Nishimura T. Tumor-infiltrating IL-17-producing gammadelta T cells support the progression of tumor by promoting angiogenesis. Eur J Immunol. 2010;40:1927-1937. [PubMed] [DOI] |
| 29. | Tartour E, Fossiez F, Joyeux I, Galinha A, Gey A, Claret E, Sastre-Garau X, Couturier J, Mosseri V, Vives V. Interleukin 17, a T-cell-derived cytokine, promotes tumorigenicity of human cervical tumors in nude mice. Cancer Res. 1999;59:3698-3704. [PubMed] |