修回日期: 2012-11-26
接受日期: 2012-12-20
在线出版日期: 2012-12-28
目的: 研究糖基化终末产物(advanced glycation end products, AGE)及其受体(receptor for advanced glycation end products, RAGE)在胃肠道中的分布, 为进一步探索其在慢性糖尿病胃肠功能紊乱中的作用奠定基础.
方法: 分别对成年Wistar大鼠食管、胃、十二指肠、空肠、回肠、结肠及直肠组织进行AGE及RAGE免疫组织化学染色.
结果: (1)食管: AGE及RAGE主要分布在横纹肌的肌细胞及黏膜的鳞状上皮细胞; (2)胃: AGE在壁细胞为强阳性. RAGE在主细胞、肥大细胞、神经细胞为强阳性, 在壁细胞为中等强度阳性, 在表面黏液细胞为弱阳性; (3)小肠: AGE及RAGE在绒毛及固有层上皮细胞为阳性或强阳性. RAGE在肠道的神经细胞亦为强阳性; (4)结肠及直肠: AGE及RAGE在黏膜上皮细胞为弱阳性, RAGE在神经细胞为强阳性.
结论: AGE及RAGE广泛分布于肠道上皮细胞及食管的横纹肌细胞, AGE亦分布于胃的壁细胞, RAGE亦分布于胃的壁细胞、主细胞、表面黏液细胞、肥大细胞及胃肠道的神经细胞.
引文著录: 陈朋民, 赵静波, HansGregersen. 糖基化终末产物及其受体在胃肠道中的分布. 世界华人消化杂志 2012; 20(36): 3638-3643
Revised: November 26, 2012
Accepted: December 20, 2012
Published online: December 28, 2012
AIM: To investigate the distribution of advanced glycation end products (AGEs) and their receptor (RAGE) in the gastrointestinal (GI) tract to provide a basis for further study of the association between AGE/RAGE and diabetic GI dysfunction.
METHODS: The distribution of AGEs [N epsilon-(carboxymethyl) lysine and N epsilon-(carboxyethyl) lysine] and RAGE were detected in the esophageal, gastric, duodenal, jejunal, ileal, colonic and rectal tissues of normal adult Wistar rats using immunohistochemistry.
RESULTS: In the esophagus, AGEs and RAGE were mainly distributed in striated muscle cells and squamous epithelial cells. In the stomach, AGEs were mainly distributed in parietal cells, and RAGE was strongly expressed in chief cells, mast cells and neurons in ganglia, moderately in parietal cells, and mildly in surface mucous cells. In the intestine, colon and rectum, AGEs and RAGE were distributed in mucosal epithelial cells, and RAGE was also distributed in neurons in the myenteric and submucosal plexuses.
CONCLUSION: AGEs and RAGE are widely distributed in epithelial cells of the GI tract as well as striated muscle cells in the esophagus. AGEs are also distributed in parietal cells in the stomach. RAGE is also distributed in chief cells, mast cells, parietal cells and surface mucous cells in the stomach and neurons in the whole GI tract.
- Citation: Chen PM, Zhao JB, Gregersen H. Distribution of advanced glycation end products and their receptor in the gastrointestinal tract. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3638-3643
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3638.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3638
胃肠道功能紊乱是慢性糖尿病常见的合并症之一. 很多研究已经揭示慢性糖尿病胃肠道的功能和结构(包括: 消化、吸收、运动、形态、生物力学特性等)发生了明显改变[1-3]. 然而胃肠道异常的病理发生是一个复杂的受多因素(如: 运动功能紊乱、自主神经异常及心理因素等)影响的过程, 目前公认高血糖启动和促进了合并症的发生发展, 但对其具体发生机制还不十分清楚.
糖基化终末产物(advanced glycation end products, AGE)是一个多分子的蛋白总称, 是通过一系列复杂的非酶催化的反应诱导糖基连接到不同蛋白质的氨基酸上[4], 高血糖能加速AGE在组织中的聚集. 糖基化终末产物受体(receptor for advanced glycation end products, RAGE)是免疫球蛋白超家族的一种跨膜受体[5,6]. 根据现有资料, 对AGE及RAGE在胃肠道中分布的研究还很少见. Ling等[7]采用免疫组织化学的方法检测了正常及1型糖尿病大鼠不同组织器官AGE的分布, 他们发现AGE在胃及小肠的上皮细胞有表达. 但迄今为止, 还未见系统而详细的对AGE及RAGE在胃肠道分布的研究报道.
本研究的目的是探讨AGE及其受体在整个胃肠道的分布, 从而为探讨AGE及RAGE在糖尿病胃肠道合并症中的作用奠定基础.
抗AGE抗体(6D12)为小鼠抗Nε-羧甲基赖氨酸[N(epsilon)-(carboxymethyl)lysine, CML, 一个主要的AGE]和Nε-羧乙基赖氨酸 [N(epsilon)-(carboxyethyl)lysine, CEL]的单克隆抗体购自日本COSMO生物有限公司; 抗RAGE抗体为兔多克隆抗体购自美国细胞应用公司(Cell Applications, INC, USA); 第二抗体LSAB2 System-HRP、蛋白酶K、柠檬酸缓冲液(pH 6.0)、牛血清白蛋白(BSA)和苏木精购自丹麦Dako公司; 乙醇、甲醇、二甲苯为Sigma产品; 载玻片及盖玻片为德国Menzel-Glaser公司产品; 10只32周龄、体质量约330 g Wistar♂大鼠购自丹麦Taconic Europe A/S公司.
1.2.1 取材: 大鼠用Hypnorm 0.5 mg/100 g体质量和Dormicum 0.25 mg/100 g体质量深度麻醉后, 分别取1 cm的食管、十二指肠、空肠、回肠、结肠、直肠及全胃, 胃肠内容物轻轻地用Krebs液清洗干净, 并固定于福尔马林中24 h, 之后通过注射过量麻醉剂处死大鼠. 食管取自下1/3末端, 十二指肠取自距幽门括约肌5 cm处, 空肠取自距Treitz韧带5 cm处, 回肠取自回盲瓣近端5 cm处, 结肠取自回盲瓣远端5 cm处, 直肠取自中段.
1.2.2 免疫组织化学染色: 将固定好的上述组织用系列乙醇脱水后石蜡包埋, 垂直于黏膜表面切片, 并固定于预先处理的免疫组织化学专用载玻片上. 室温下充分干燥后, 将切片置于37 ℃烤箱中过夜以增加组织对切片的黏附力. 二甲苯脱蜡2次, 每次15 min. 分别用1 000、950、900、800、700、600和500 mL/L乙醇逐级水化, 每个浓度2次, 每次3 s. 用水冲洗10 min后浸泡至0.01 mol/L PBS(pH 7.4)中3 min. (1)AGE免疫组织化学染色: 上述组织经蛋白酶K处理后(100 µg/mL, 37 ℃, 20 min)浸泡于3%双氧水-甲醇溶液中(常温下15 min)以抑制内源性过氧化物酶. 在5%BSA-PBS溶液中常温下孵育30 min以阻断非特异性染色. 与第一抗体6D12(1% BSA-PBS 1:100稀释)或经过量CML和CEL处理过的正常小鼠IgG (250 µg/mL, 1% BSA-PBS 1:250稀释, 阴性对照)在4 ℃下孵育过夜. 用PBS(0.01 mol/L)充分洗涤后, 与第二抗体的第一部分LINK(生物素化的抗小鼠和抗兔免疫球蛋白)在室温下孵育10 min. PBS充分洗涤后, 与第二抗体第二部分STREPTAVIDIN PEROXIDASE(辣根过氧化物酶标记的链霉亲和素)室温下孵育10 min. (LINK及STREPTAVIDIN PEROXIDASE为丹麦Dako公司生产的第二抗体LSAB2 System-HRP的两部分). 经PBS充分洗涤后, 与含有过氧化氢及邻苯二氨的底物溶液常温下孵育5 min显色. 经水冲洗10 min后, 用苏木精复染1 min. 再次冲洗10 min后, 用盐酸-乙醇分化3 s. 经水充分冲洗后, 用800、900、950和1 000 mL/L的乙醇逐级脱水, 然后浸泡于二甲苯中2次, 每次15 min. 最后盖玻片封片并在光镜下观察; (2)RAGE免疫组织化学染色: 抗RAGE抗体为兔源性多克隆抗体, 是经人RAGE肽链N末端免疫所得, 其序列与大鼠相应序列仅有两个氨基酸差异. 与AGE免疫组织化学染色相比, RAGE免疫组织化学染色省去蛋白酶K消化步骤, 取而代之的是将组织切片放入10 mmol/L柠檬酸缓冲液(pH 6.0)中煮沸18 min, 用以修复抗原. 除设立阴性对照外, 用正常大鼠肺组织切片做为阳性对照(RAGE在肺组织为高表达[8]). 第一抗体稀释度为1:60. 其余步骤与AGE免疫组织化学染色相同. AGE及RAGE染色阳性区域均为棕黄色. 而在阴性对照中并未出现, 说明染色为特异性染色. 所做10只动物其着色部位及着色强度没有明显差异. 根据棕黄色在组织中的分布, 我们从组织和细胞水平描述其分布状态. 根据染色强度, 我们将其分为5级, 即: - 无明显染色; + 弱染色; ++ 中等强度染色; +++ 强染色; ++++ 极强染色.
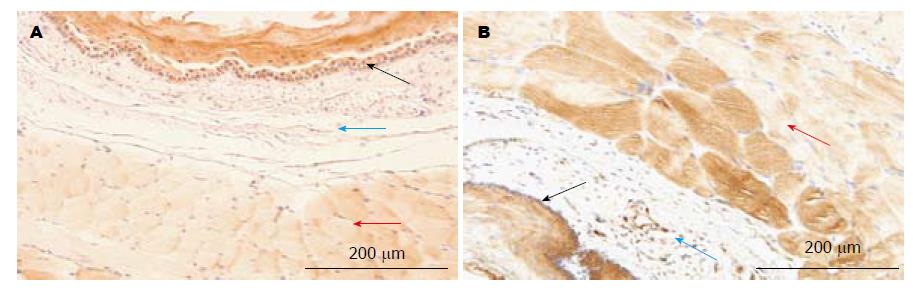
2.1.1 食管: AGE主要分布于食管横纹肌及黏膜层, 其分布为非均一性. 在黏膜层其染色强度从基底层到角化层逐渐减弱. 在细胞水平, AGE主要分布于横纹肌的肌细胞及鳞状上皮细胞, 肌细胞为不规则非均一性染色, 而鳞状上皮细胞为均一性染色. 黏膜下层未见明显着色(图1A).
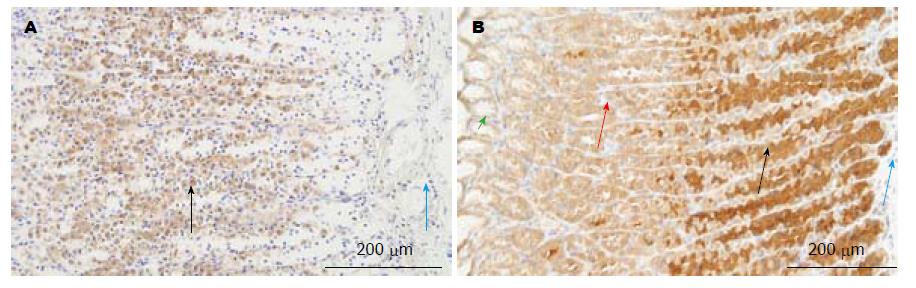
2.1.2 胃: AGE主要分布在黏膜层, 尤其是在黏膜层的中部. 从细胞水平看, 壁细胞为强阳性, 胞膜胞浆均有染色, 但胞膜强于胞浆. 表面黏液细胞、主细胞及间质细胞为阴性. 黏膜下层、平滑肌层及神经节未见明显染色(图2A).
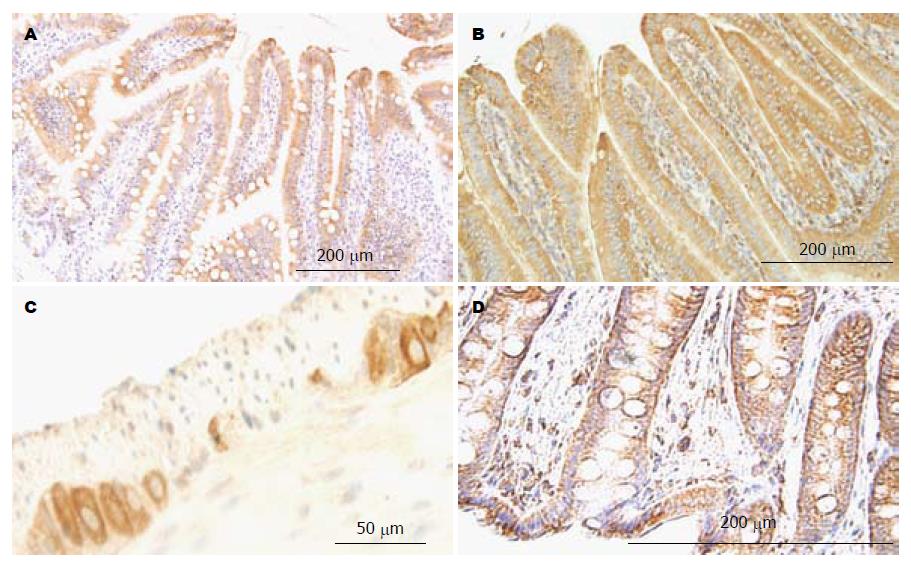
2.1.3 肠道: AGE主要分布在黏膜层(表1), 特别是在小肠的绒毛及腺窝上皮细胞(图3A, 除回肠腺窝上皮细胞外)及结肠黏膜表面上皮细胞分布广泛. 结肠黏膜非表面上皮细胞、黏膜下层、平滑肌层、神经丛未见明显染色. 在上皮细胞为非均一性分布, 绒毛上皮细胞的表面部分比基底部染色强, 腺窝上皮细胞与绒毛上皮正好相反, 其基底部染色更强. 同段相比, 绒毛上皮比腺窝上皮染色更强. 十二指肠和空肠黏膜上皮细胞染色强度相似, 两者比结肠黏膜染色更强, 与前三者相比, 回肠黏膜染色最弱. 在直肠, AGE主要分布在腺窝上皮细胞, 其染色强度与结肠相似.
| 绒毛上皮细胞 | 陷窝上皮细胞 | 黏膜下层 | 平滑肌层 | 肌间神经细胞 | |
| 十二指肠 | +++ | ++ | - | - | - |
| 空肠 | +++ | ++ | - | - | - |
| 回肠 | + | - | - | - | - |
| 结肠 | 肠腔面++, 其余部分- | - | - | - | |
| 直肠 | ++ | - | - | - |
2.2.1 食管: RAGE亦主要分布在横纹肌及黏膜层, 其在横纹肌层为不规则非均一性分布, 在黏膜层, 从基底部到黏膜表面染色强度逐渐降低. 从细胞水平看, RAGE主要分布在横纹肌的肌细胞及鳞状上皮细胞. 黏膜下层未见明显染色(图1B).
2.2.2 胃: RAGE主要分布在黏膜层, 其基底部较上半部染色更强. 从细胞水平看, 主细胞为强染色, 壁细胞中等染色, 表面黏液细胞弱染色, 间质细胞未见明显着色. 黏膜下层未见明显染色. 在平滑肌层, 肥大细胞及神经丛的神经细胞为强染色, 平滑肌细胞未见明显染色(图2B).
2.2.3 肠道: 在小肠RAGE主要分布在绒毛和腺窝上皮细胞以及神经丛的神经细胞, 其在细胞内为均匀性分布(表2), 但不同部位的细胞染色强度有明显差异, 绒毛上皮细胞染色强度明显强于腺窝上皮细胞; 十二指肠上皮细胞染色强度在三段小肠中最强(图3B), 回肠最弱, 空肠居中. 神经细胞在三段小肠中的染色强度无明显差异. 在结肠RAGE主要分布在神经节内的神经细胞, 其染色强度与小肠神经细胞类似(图3C), 另外RAGE在腺窝上皮细胞亦有少量分布, 与小肠相比其分布明显减少. 在直肠黏膜上皮细胞亦有RAGE分布(图3D).
| 绒毛上皮细胞 | 陷窝上皮细胞 | 黏膜下层 | 平滑肌层 | 肌间神经细胞 | |
| 十二指肠 | ++++ | ++ | - | - | ++++ |
| 空肠 | +++ | ++ | - | - | ++++ |
| 回肠 | ++ | + | - | - | ++++ |
| 结肠 | + | - | - | ++++ | |
| 直肠 | ++ | - | - |
Ling等[9]用抗不同种类的糖基化终末产物抗体研究了AGE在正常人不同组织器官的分布. 结果显示: AGE广泛分布于间质细胞、系膜细胞、血细胞、细胞外基质以及心内膜、动静脉和毛细血管的内皮细胞. 细胞水平上, 细胞膜、细胞器、胞浆和胞核均有分布. 后来他们又检测了正常及1型糖尿病大鼠不同组织器官中4种AGE的分布, 在胃肠道, 他们研究了AGE在小肠和胃组织中的分布, 发现AGE主要分布于胃及小肠上皮细胞[7]. 对RAGE的研究多集中在病变组织与正常组织的比较上, 总体来说, RAGE在正常组织中的表达较低, 与其他组织相比, 其在肺组织中的表达最高[10]. 但迄今为止, 未见有关AGE及其受体在正常胃肠道组织中表达情况的系统研究报道. 本研究发现AGE主要分布在胃肠道的黏膜层及食管的横纹肌层, 平滑肌、神经丛及黏膜下层未见明显染色. RAGE主要分布在胃肠道的黏膜层、神经丛及食管的横纹肌层, 黏膜下层及平滑肌层未见明显染色. 本研究所采用的抗体是抗两种不同的AGE, 即CML和CEL, 为了更全面地阐明AGE在正常肠道中的分布, 在未来的研究中我们将采用多种不同的抗AGE特异性抗体. 同时, 我们将采用双染同时在胃肠道组织中定位AGE及其受体, 以进一步明确两者之间的表达关系.
多年的研究表明: AGE可在不同的组织器官中聚集, 其聚集的量随年龄的增长而增加[11], 过量聚集的AGE与多种疾病密切相关. AGE可通过受体非依赖型和依赖型两种通路影响慢性糖尿病合并症[7,8], 前者是通过非酶糖化和蛋白质交叉连接形成改变细胞外基质的结构, 后者是通过与细胞外特异性受体结合改变细胞功能促进合并症的形成. 现阶段的研究表明: AGE及其受体与不同类型糖尿病合并症的发病具有相关性[12], 如: 糖尿病心脏病[13]、糖尿病视网膜病[14]、糖尿病肾病[15]和糖尿病动脉粥样硬化[16]等; AGE与其受体结合, 可介导活性氧(ROS)-血管紧张素转化酶-血管紧张素-JAK2-TGF-beta-Smad级联反应, 从而诱导肾脏间质细胞增生、Ⅰ型胶原合成、肾小球系膜细胞肥厚、纤黏连蛋白合成、腹膜纤维化[17]等; 血浆AGE或亲和AGE的红细胞与血管内皮上的受体相互作用可通过裂隙的形成及肌动蛋白重组引起血管高渗透性炎性反应[18]; AGE和其受体结合还可刺激NADPH氧化酶和活性氧的产生, 活性氧与一氧化氮反应可抑制一氧化氮的扩血管作用[19]. 由于AGE及其受体在胃肠道分布广泛, 因此AGE及其受体在糖尿病胃肠功能紊乱中可能也起非常重要的作用. 然而, 迄今为止探讨AGE及其受体在慢性糖尿病胃肠功能紊乱中作用的报道甚少.
我们前期的研究工作已经表明: 在STZ诱导的糖尿病大鼠, AGE在小肠黏膜上皮细胞的表达明显增高; RAGE在小肠的上皮细胞及神经细胞表达明显增高[20]. 说明在糖尿病状态下, AGE及其受体在胃肠道有过度表达, 其可能与糖尿病性胃肠功能障碍有关. 众所周知, 小肠绒毛上皮细胞富含与消化和吸收有关的酶[21], AGE和RAGE如果在糖尿病状态下过度表达, 其可能影响小肠绒毛刷状缘的理化特性及功能, 从而影响糖尿病患者小肠的消化和吸收功能[22-24]. 另外, 大量研究表明, 糖尿病性自主神经病变与糖尿病胃肠动力障碍密切相关[25]. AGE和RAGE可能在糖尿病性自主神经病变中起到非常重要的作用[26-29]. 体外实验表明: AGE和内源性一氧化氮协同作用可导致神经元凋亡[30], 而Jeyabal等[31]研究表明: AGE抑制剂能抑制糖尿病肠道神经原一氧化氮合成酶的丢失, 提示在糖尿病中产生的AGE可能导致肠道一氧化氮合成酶表达的降低, 这个作用可能是胃肠道动力功能紊乱的原因之一. 因此, 糖尿病胃肠功能紊乱已成为国内外比较热门的研究课题之一. 本研究比较系统地描述了AGE及其受体在胃肠道中的分布, 为进一步探讨AGE及其受体在慢性糖尿病胃肠功能紊乱中的作用奠定了基础.
AGE和RAGE与多种糖尿病合并症密切相关, 如: 糖尿病心脏病、糖尿病视网膜病、糖尿病肾病和糖尿病动脉粥样硬化等. 虽然有少量有关AGE和RAGE与糖尿病胃肠合并症的报道, 但是尚缺乏广泛和深入的研究.
魏继福, 研究员, 江苏省人民医院; 洪天配, 教授, 北京大学第三医院内分泌科
糖尿病胃肠合并症是目前国内外的研究热点之一, 而AGE和RAGE可能与其有密切关系. 为了探讨AGE和RAGE在糖尿病胃肠道合并症中的作用, 了解AGE和RAGE在正常胃肠道中的系统分布是亟待研究和解决的问题, 这正是本研究的重点所在.
本文首次系统性地探讨了AGE及其受体在整个胃肠道的分布.
本研究为进一步探讨AGE及RAGE在糖尿病胃肠道合并症中的作用奠定了基础.
糖基化终末产物: 一类多分子蛋白的总称, 通过一系列复杂的非酶催化反应诱导糖基连接到不同蛋白质的氨基酸上. 糖基化终末产物受体: 免疫球蛋白超家族的一种跨膜受体, 其能与AGE结合从而引发一系列反应. AGE和RAGE与糖尿病合并症密切相关.
本文系统的研究了AGE及其受体(RAGE)在成年Wistar大鼠胃肠道各段组织中的分布. 研究创新性强, 研究结果可靠, 具有一定的科学价值.
编辑: 田滢 电编:鲁亚静
| 1. | Nair M. Diabetes mellitus, part 1: physiology and complications. Br J Nurs. 2007;16:184-188. [PubMed] |
| 2. | Horowitz M, Samsom M. Gastrointestinal function in diabetes mellitus. First edition. UK: John Wiley & Sons, Ltd 2004; 1-339. [DOI] |
| 3. | Zhao J, Frøkjaer JB, Drewes AM, Ejskjaer N. Upper gastrointestinal sensory-motor dysfunction in diabetes mellitus. World J Gastroenterol. 2006;12:2846-2857. [PubMed] |
| 4. | Singh R, Barden A, Mori T, Beilin L. Advanced glycation end-products: a review. Diabetologia. 2001;44:129-146. [PubMed] [DOI] |
| 5. | Bierhaus A, Humpert PM, Morcos M, Wendt T, Chavakis T, Arnold B, Stern DM, Nawroth PP. Understanding RAGE, the receptor for advanced glycation end products. J Mol Med (Berl). 2005;83:876-886. [PubMed] [DOI] |
| 6. | Stern DM, Yan SD, Yan SF, Schmidt AM. Receptor for advanced glycation endproducts (RAGE) and the complications of diabetes. Ageing Res Rev. 2002;1:1-15. [PubMed] [DOI] |
| 7. | Ling X, Nagai R, Sakashita N, Takeya M, Horiuchi S, Takahashi K. Immunohistochemical distribution and quantitative biochemical detection of advanced glycation end products in fetal to adult rats and in rats with streptozotocin-induced diabetes. Lab Invest. 2001;81:845-861. [PubMed] [DOI] |
| 8. | Wada R, Yagihashi S. Role of advanced glycation end products and their receptors in development of diabetic neuropathy. Ann N Y Acad Sci. 2005;1043:598-604. [PubMed] [DOI] |
| 9. | Ling X, Sakashita N, Takeya M, Nagai R, Horiuchi S, Takahashi K. Immunohistochemical distribution and subcellular localization of three distinct specific molecular structures of advanced glycation end products in human tissues. Lab Invest. 1998;78:1591-1606. [PubMed] |
| 10. | Mukherjee TK, Mukhopadhyay S, Hoidal JR. Implication of receptor for advanced glycation end product (RAGE) in pulmonary health and pathophysiology. Respir Physiol Neurobiol. 2008;162:210-215. [PubMed] [DOI] |
| 11. | Semba RD, Nicklett EJ, Ferrucci L. Does accumulation of advanced glycation end products contribute to the aging phenotype? J Gerontol A Biol Sci Med Sci. 2010;65:963-975. [PubMed] [DOI] |
| 12. | Goh SY, Cooper ME. Clinical review: The role of advanced glycation end products in progression and complications of diabetes. J Clin Endocrinol Metab. 2008;93:1143-1152. [PubMed] [DOI] |
| 13. | Kato T, Yamashita T, Sekiguchi A, Tsuneda T, Sagara K, Takamura M, Kaneko S, Aizawa T, Fu LT. AGEs-RAGE system mediates atrial structural remodeling in the diabetic rat. J Cardiovasc Electrophysiol. 2008;19:415-420. [PubMed] [DOI] |
| 14. | Sugiyama T, Okuno T, Fukuhara M, Oku H, Ikeda T, Obayashi H, Ohta M, Fukui M, Hasegawa G, Nakamura N. Angiotensin II receptor blocker inhibits abnormal accumulation of advanced glycation end products and retinal damage in a rat model of type 2 diabetes. Exp Eye Res. 2007;85:406-412. [PubMed] [DOI] |
| 15. | Fukami K, Yamagishi S, Ueda S, Okuda S. Role of AGEs in diabetic nephropathy. Curr Pharm Des. 2008;14:946-952. [PubMed] [DOI] |
| 16. | Tekabe Y, Luma J, Einstein AJ, Sedlar M, Li Q, Schmidt AM, Johnson LL. A novel monoclonal antibody for RAGE-directed imaging identifies accelerated atherosclerosis in diabetes. J Nucl Med. 2010;51:92-97. [PubMed] [DOI] |
| 17. | Lee CI, Guh JY, Chen HC, Hung WC, Yang YL, Chuang LY. Advanced glycation end-product-induced mitogenesis and collagen production are dependent on angiotensin II and connective tissue growth factor in NRK-49F cells. J Cell Biochem. 2005;95:281-292. [PubMed] [DOI] |
| 18. | Hirose A, Tanikawa T, Mori H, Okada Y, Tanaka Y. Advanced glycation end products increase endothelial permeability through the RAGE/Rho signaling pathway. FEBS Lett. 2010;584:61-66. [PubMed] [DOI] |
| 19. | Grossin N, Wautier MP, Wautier JL. Red blood cell adhesion in diabetes mellitus is mediated by advanced glycation end product receptor and is modulated by nitric oxide. Biorheology. 2009;46:63-72. [PubMed] |
| 20. | Chen P, Zhao J, Gregersen H. Up-regulated expression of advanced glycation end-products and their receptor in the small intestine and colon of diabetic rats. Dig Dis Sci. 2012;57:48-57. [PubMed] [DOI] |
| 21. | Guyton AC, Hall JE. Textbook of medical physiology. Tenth edition. USA: W.B. Saunders Company 2000; 754-763. |
| 22. | Bhor VM, Sivakami S. Regional variations in intestinal brush border membrane fluidity and function during diabetes and the role of oxidative stress and non-enzymatic glycation. Mol Cell Biochem. 2003;252:125-132. [PubMed] [DOI] |
| 23. | Brasitus TA, Dudeja PK. Correction of abnormal lipid fluidity and composition of rat ileal microvillus membranes in chronic streptozotocin-induced diabetes by insulin therapy. J Biol Chem. 1985;260:12405-12409. [PubMed] |
| 24. | Keelan M, Walker K, Thomson AB. Intestinal brush border membrane marker enzymes, lipid composition and villus morphology: effect of fasting and diabetes mellitus in rats. Comp Biochem Physiol A Comp Physiol. 1985;82:83-89. [PubMed] |
| 25. | Phillips LK, Rayner CK, Jones KL, Horowitz M. An update on autonomic neuropathy affecting the gastrointestinal tract. Curr Diab Rep. 2006;6:417-423. [PubMed] [DOI] |
| 26. | King RH. The role of glycation in the pathogenesis of diabetic polyneuropathy. Mol Pathol. 2001;54:400-408. [PubMed] |
| 27. | Sourris KC, Forbes JM. Interactions between advanced glycation end-products (AGE) and their receptors in the development and progression of diabetic nephropathy - are these receptors valid therapeutic targets. Curr Drug Targets. 2009;10:42-50. [PubMed] [DOI] |
| 28. | Toth C, Martinez J, Zochodne DW. RAGE, diabetes, and the nervous system. Curr Mol Med. 2007;7:766-776. [PubMed] [DOI] |
| 29. | Russo A, Fraser R, Adachi K, Horowitz M, Boeckxstaens G. Evidence that nitric oxide mechanisms regulate small intestinal motility in humans. Gut. 1999;44:72-76. [PubMed] [DOI] |
| 30. | Cellek S, Qu W, Schmidt AM, Moncada S. Synergistic action of advanced glycation end products and endogenous nitric oxide leads to neuronal apoptosis in vitro: a new insight into selective nitrergic neuropathy in diabetes. Diabetologia. 2004;47:331-339. [PubMed] [DOI] |
| 31. | Jeyabal PV, Kumar R, Gangula PR, Micci MA, Pasricha PJ. Inhibitors of advanced glycation end-products prevent loss of enteric neuronal nitric oxide synthase in diabetic rats. Neurogastroenterol Motil. 2008;20:253-261. [PubMed] [DOI] |