修回日期: 2012-11-09
接受日期: 2012-11-15
在线出版日期: 2012-12-18
目的: 探讨wwox基因启动子甲基化及蛋白表达与肝细胞性肝癌的关系.
方法: 通过甲基化特异性PCR(methylation specific polymerase chain reaction, MSP)方法及免疫组织化学(immunohistochemestry, IHC)法分别检测60例肝细胞性肝癌组织和癌旁组织中wwox基因启动子甲基化状态和蛋白表达水平.
结果: 癌组织及癌旁组织中wwox基因启动子甲基化阳性率分别为41.67%(25/60)和8.33%(5/60)(P = 0.000). WWOX蛋白在癌和癌旁组织中的表达具有显著性差异[35.00%(21/60) vs 70.00%(42/60), P = 0.001]. wwox基因启动子甲基化和蛋白表达与肝外转移、肿瘤直径、肿瘤细胞分化密切相关(P = 0.007, 0.014, 0.011); WWOX蛋白表达与临床分期、肿瘤直径、肿瘤细胞分化密切相关(P = 0.018、0.023、0.001). wwox基因启动子甲基化与蛋白表达显著负相关(γ = -0.408, P = 0.001).
结论: 启动子区甲基化是wwox基因失活的重要机制. wwox启动子区异常甲基化可能参与了肝癌的发生发展, 在肝癌的进展发挥重要作用.
引文著录: 陈军, 吴飞翔, 杨春, 覃思繁. 肝细胞癌中wwox基因启动子甲基化与蛋白表达的关系. 世界华人消化杂志 2012; 20(35): 3588-3593
Revised: November 9, 2012
Accepted: November 15, 2012
Published online: December 18, 2012
AIM: To investigate the promoter methylation status and protein expression of the wwox gene in hepatocellular carcinoma (HCC).
METHODS: Promoter methylation status and protein expression of the wwox gene were analyzed in 60 cases of HCC tissues and matched tumor-adjacent liver tissues by methylation specific polymerase chain reaction (MSP) and immunohistochemistry (IHC), respectively.
RESULTS: The positive rate of wwox gene promoter methylation in tumor tissues was significantly higher than that in matched tumor-adjacent liver tissues (41.67% vs 8.33%, P = 0.000), while the positive rate of WWOX protein in tumor tissues was significantly lower than that in matched tumor-adjacent liver tissues (35.00% vs 70.00%, P = 0.001). Promoter methylation of the wwox gene was correlated with extrahepatic metastasis, tumor diameter, and tumor differentiation. WWOX protein expression was significantly correlated with clinical stage, tumor diameter, and tumor differentiation. Promoter methylation and protein expression of the wwox gene showed a significantly negative correlation (γ = -0.408, P = 0.001).
CONCLUSION: Promoter methylation is a crucial mechanism of inactivation of the wwox gene. Promoter methylation of the wwox gene might be involved in carcinogenesis, development, and progression of HCC.
- Citation: Chen J, Wu FX, Yang C, Qin SF. Relationship between promoter methylation status and protein expression of the wwox gene in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(35): 3588-3593
- URL: https://www.wjgnet.com/1009-3079/full/v20/i35/3588.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i35.3588
原发性肝癌(hepatocellular carcinoma, HCC)的发生是一个涉及多基因、多步骤的复杂过程, 相关癌基因的激活和抑癌基因的失活的致癌模式逐渐为人们所认识. 真核生物基因组DNA甲基化模式的异常改变可以导致细胞癌变, 如抑癌基因或错配修复基因启动区的甲基化会使基因发生沉默或失活, 从而诱发肿瘤的形成[1]. DNA甲基化状态的改变是肝癌相关基因调控的一种方式, 属于肝癌发生的早期事件. 因此, 揭示其规律对肝癌的发生机制、早期诊断、评价预后以及指导临床治疗有重要意义. wwox(WW domain-containing oxidoreductases), 也称为wox1或称forⅡ, 是2000年由Bednarek等[2]鉴定出的一个候选抑癌基因, 已被发现在多种肿瘤中低表达或缺失, 可能与肿瘤的发生进展有密切关系. 我们检测肝细胞癌组织中wwox启动子区甲基化状态和蛋白的表达情况, 并对他们的临床病理特征进行分析, 探讨wwox启动子区甲基化状态与肝癌发生、发展的关系.
60例肝癌组织, 取自广西医科大学附属肿瘤医院2008-08/2009-08肝癌患者手术切除的标本, 经术后病理诊断为肝细胞癌. 其中男42例, 女18例, 年龄22-65岁, 平均年龄42.3岁±12.1岁, 中位年龄46岁. 所有患者术前均未行任何治疗. 按UICC 2002年TNM分期, 根据按Edmondeon病理分级标准进行组织学分级. 每例均取癌及对应癌旁肝组织(距肿瘤边缘至少2 cm). 手术切下后一部分迅速放入液氮速冻, 之后移至-80 ℃冰箱冻存用于DNA的提取, 备甲基化特异性PCR(methylation specific polymerase chain reaction, MSP)检测; 另一部分立即放入40 g/L甲酫内固定后石腊包埋, 用于HE染色及免疫组织化学染色. WWOX浓缩型鼠抗人单克隆抗体购自美国Santa Cruz公司; 即用型快速免疫组织化学MaxVisionTM检测试剂盒及DAB染色试剂盒均购自福州迈新生物技术有限公司; 平衡酚、氯仿、蛋白酶K、无水乙醇、乙酸钠、对苯二酚购自上海试剂厂; 引物购自上海生物工程公司; EZDNA Methylation Kit购自Zymo公司; TaqDNA聚合酶及甲基化特异性PCR引物购自上海捷瑞生物技术有限公司.
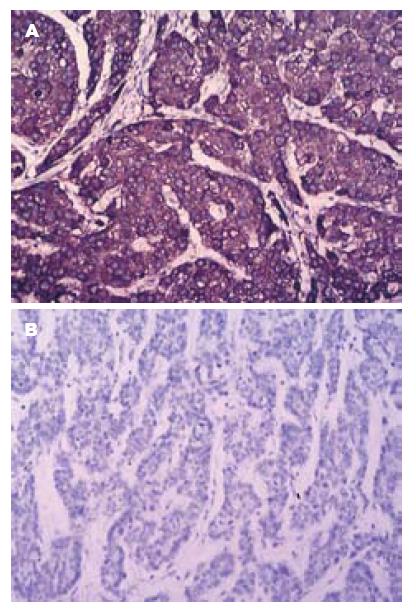
1.2.1 免疫组织化学: 免疫组织化学(immunohistochemistry, IHC)检查采用酶标聚合物法(labelled dextran polymer, LDP). 操作步骤按照说明书进行, WWOX抗体稀释浓度为1:100. 每批染色均设已知阳性切片作阳性对照, 用磷酸盐缓冲液(phosphatic buffered saline, PBS)代替一抗作阴性对照.
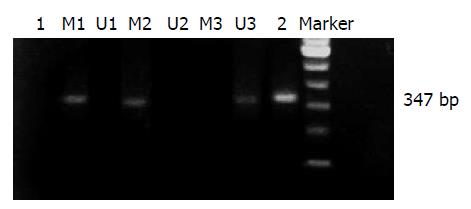
1.2.2 wwox基因启动子甲基化检测: 所选标本按常规进行蛋白酶K消化、酚/氯仿抽提DNA, 紫外分光光度计定量, A260/280值均为1.7-1.8. 抽提后DNA保存在-20 ℃冰箱备用. 基因组DNA的亚硫酸氢盐修饰用Zymo公司EZDNA Methylation Kit, 按说明书操作. 分别设计针对启动子区非甲基化和甲基化DNA引物, 非甲基化特异性引物: 上游5'-TATGGGTGTTGTTTTTTTAHTT-3', 下游5'-CAATCTCCACAATATCACAACA-3', 扩增产物347 bp; 甲基化特异性引物: 上游5'-TATGGGCGTCGTTTTTTTAGTT-3', 下游5'-CAATCTCCGCAAT ATCGCGACA-3', 扩增产物347 bp. PCR反应体系(12.5 μL): 10×Buffer 2.50 μL, 25 mmol/L MgCl2 1.50 μL, 10 μmol/L Dntp 0.50 μL, 5 U/μL TaqE 0.40 μL, 灭菌水13.1 μL, 甲基化或非甲基化特异性上下游引物10 μmol/L各1.0 μL, 模板DNA 5 μL. PCR反应条件: 95 ℃预变性5 min; 95 ℃ 40 s, 55 ℃ 45 s, 72 ℃ 45 s, 共40个循环; 72 ℃延伸10 min. 以已做出甲基化阳性组织作为阳性对照, 未经甲基化酶处理的正常人外周血DNA做非甲基化阳性对照, 阴性对照用灭菌双蒸水代替DNA模板进行PCR. 取5 μL PCR反应产物, 2 μL 6×Loading buffer, 于2%琼脂糖凝胶上电泳, 自动电泳凝胶成像分析系统扫描分析.
1.2.3 结果判定: (1)免疫组织化学检测: WWOX表达产物定位于胞质, 以胞质出现棕黄色颗粒为阳性细胞. 由两位医师采用双盲法观察每张切片. 判断阳性反应根据以下两个方面: A按切片中显色癌细胞数比例计分: 0分无癌细胞显色; 1分显色癌细胞占癌细胞总数<25%; 2分显色细胞超过切片中癌细胞总数的25%但<50%; 3分显色细胞超过切片中细胞总数的50%. B按切片中癌细胞显色强度计分: 0分细胞无显色; 1分呈浅黄色(弱染色); 2分呈棕黄色(中等染色); 3分呈棕褐色(强染色). A+B>3分记为阳性, ≤3分记为阴性; (2)甲基化特异性产物扩增产物存在为甲基化阳性. 反之, 其不存在且特异性扩增产物非甲基化为阴性则判定为甲基化阴性.
统计学处理 采用SPSS11.0统计学χ2检验, 相关性分析采用Spearman法, P<0.05为有统计学意义.
肝癌组织及癌旁组织中wwox基因启动子甲基化检测阳性率分别为41.67%(25/60)和8.33%(5/60)(图1), 两组间差异有统计学意义(P = 0.000). 癌组织中wwox甲基化阳性率在肝外转移、肿瘤大小、肿瘤分化程度等分组中比较有显著性差异(P<0.05), 在临床分期、脉管癌栓、术后复发、肿瘤个数、HBsAg、血清AFP等组间差异无统计学意义(P>0.05, 表1).
| 临床参数 | n | wwox启动子区甲基化 | χ2值 | P值 | WWOX蛋白表达阳性 | χ2值 | P值 |
| 临床分期 | |||||||
| Ⅰ-Ⅱ期 | 43 | 15 | 2.873 | 0.09 | 19 | 5.629 | 0.018 |
| Ⅲ期 | 17 | 10 | 2 | ||||
| 血管癌栓 | |||||||
| 有 | 24 | 13 | 2.571 | 0.109 | 5 | 3.529 | 0.06 |
| 无 | 36 | 12 | 16 | ||||
| 术后复发 | |||||||
| 有 | 25 | 14 | 3.623 | 0.057 | 7 | 0.923 | 0.337 |
| 无 | 35 | 11 | 14 | ||||
| 肝外转移 | |||||||
| 有 | 10 | 8 | 7.255 | 0.007 | 1 | 3.296 | 0.069 |
| 无 | 50 | 17 | 20 | ||||
| 肿瘤直径 (cm) | |||||||
| ≥5 | 32 | 18 | 6.000 | 0.014 | 7 | 5.192 | 0.023 |
| <5 | 28 | 7 | 14 | ||||
| 肿瘤个数 | |||||||
| 1 | 41 | 16 | 0.372 | 0.542 | 13 | 0.617 | 0.432 |
| ≥2 | 19 | 9 | 8 | ||||
| 血清AFP (µg/L) | |||||||
| ≥400 | 37 | 17 | 0.727 | 0.394 | 11 | 1.178 | 0.278 |
| <400 | 23 | 8 | 10 | ||||
| HBsAg | |||||||
| 阳性 | 39 | 18 | 0.923 | 0.337 | 11 | 2.261 | 0.133 |
| 阴性 | 21 | 7 | 10 | ||||
| 肿瘤细胞分化 | |||||||
| Ⅰ-Ⅱ级 | 26 | 6 | 6.524 | 0.011 | 15 | 10.385 | 0.001 |
| Ⅲ-Ⅳ级 | 34 | 19 | 6 |
wwox基因是2000年由Bednarek等[2]应用鸟枪基因测序技术结合对感兴趣区域对应的转录子进行分离并分析的方法鉴定出的一个新基因. wwox基因位于染色体16q23.3-24.1区域并跨越了整个常见染色体脆性部位FRA16D. WWOX的氨基末端有两个WW结构域, WW功能域主要与蛋白之间相互作用有关, 与WWOX作用有关的蛋白如P53[3]、P73[4]、ERBB4[5]、C-Jun[6]等均为信号转导途径的关键点, 说明WWOX在抑制转录、细胞生长和诱导凋亡等信号转导途径中有重要作用. 研究显示, wwox和fhit基因在许多肿瘤中表达量减低或缺失, 提示在肿瘤形成中, wwox与fhit基因的作用相似, 参与了肿瘤的发生与进展[7].
CpG岛的高甲基化是肿瘤中普遍现象, 是除突变和缺失外肿瘤中抑癌基因失活的第3种机制[8]. Iliopoulos等[9]通过MSP检测肺鳞癌组织、侵袭性乳腺癌、膀胱癌组织及对应的癌旁组织, 发现WWOX在肿瘤中表达减少和DNA甲基化有关. Wang等[10]研究结果显示在20例乳腺癌组织中WWOX甲基化率为55%, 而对应的癌旁组织未检测出甲基化, 而且WWOX发生CpG岛甲基化的mRNA及蛋白表达显著低于非甲基化的mRNA及蛋白表达. Gao等[11]研究食管鳞状细胞癌发现wwox启动子及外显子1(exon1)超甲基化在发育不良的上皮中表达, 且在食管鳞状细胞癌中WWOX的甲基化频率显著高于相应的癌旁组织, 并且与具有上消化道癌家族史密切相关. 在我们的研究中, 用MSP法检测出肝癌组织wwox启动子区甲基化阳性率为41.67%(25/60), 与国外的研究结果类似, 同时我们检测癌组织及癌旁组织中甲基化阳性率存在显著性差异, 提示其甲基化可能参与了肝癌的发生过程. Yan等[12]用MSP法检测wwox基因启动子区域的甲基化状态显示50例胃癌手术标本中35例存在启动子区域甲基化, 并进一步通过对幽门螺杆菌(Helicobacter pylori, H. pylori)感染的胃癌细胞系的研究发现H. pylori感染与wwox基因甲基化有密切关系. 而HBsAg是引起肝细胞癌的重要危险因素之一, 其引发的炎症反应与癌变之间的关系一直是研究的热点. 我们对HBsAg阳性及阴性的肝癌组织进行了对比分析, 但未发现HBsAg感染与wwox基因甲基化有密切关系.
Donati等[13]检测到85%非小细胞性肺癌(non-small cell lung cancer, NSCLC)中WWOX蛋白表达减少或缺失, 并且WWOX表达缺失与肺癌的侵袭性、病理分级密切相关, 证实WWOX对NSCLC的肿瘤形成过程及肿瘤预后有重要意义. Kuroki等[14]使用免疫组织化学方法检测81例原发性胃腺癌, 证实65%的腺癌组织中WWOX表达减少, 并发现其表达与肿瘤的组织学分级密切相关. Lan等[15]用免疫组织化学法检测112例卵巢癌组织中WWOX表达情况, 有32例表达缺失, WWOX的表达缺失与ER、PR阴性、FIGO分期和淋巴结转移密切相关. 而我们的研究显示wwox启动子区甲基化与肝外转移、肿瘤直径、肿瘤细胞分化有显著相关, 其蛋白表达显示亦与临床分期、肿瘤直径、肿瘤细胞分化有显著相关, 提示其可能在肝癌的进展中也有重要作用. wwox启动子区甲基化是否在不同肿瘤中作用的机制重点不同, 是在肿瘤的发生或在肿瘤的发展或在两者都起着重要作用有待试验研究进一步证明.
此外, 我们的研究发现, wwox启动子区甲基化与其蛋白表达呈显著负相关, 说明在肝癌中启动子区甲基化是wwox基因失活的重要机制之一. 值得一提的是我们发现部分甲基化阳性的病例中也检测到了非甲基化特异性产物的扩增, 这可能是癌组织中混杂了非甲基化的肝细胞或炎症细胞; 另一种可能是2个等位基因的半甲基化状态(hemimethylation). 此外, 部分甲基化阳性病例免疫组织化学结果也呈阳性, 可能是因为基因转录的表达抑制依赖CpG岛甲基化的积累剂量. 有报道指出CpG岛甲基化只有达到一定比例(>60%)时才足以完全抑制基因表达, 而低比例的甲基化只能降低基因的转录表达[16].
总之, 肝癌发病机制的是一个复杂的过程, DNA甲基化是其中一个重要的环节. wwox基因在抑制肿瘤形成中起着重要作用, 肝癌中启动子区甲基化是wwox基因失活的重要机制, 针对性的检测其甲基化状态, 采取相应的基因靶向治疗, 将为肝癌的检测和治疗提供新的途径.
wwox也称为wox1或forⅡ, 是一个候选抑癌基因, 已发现其在多种肿瘤中低表达或缺失. DNA甲基化状态的改变是肝癌相关基因调控的一种方式, 属于肝癌发生的早期事件, wwox的低表达和失活可能与其启动子区甲基化有关, 检测其启动子区甲基化状态可能对肝癌的发生机制、早期诊断、评价预后以及指导临床治疗有重要意义.
王阁, 教授, 中国人民解放军第三军医大学第三附属医院
目前国内外对各种肿瘤中WWOX的表达情况的研究成为热点, 而其启动子区甲基化可能是WWOX失活的重要方式之一, 值得进一步研究.
目前wwox基因启动子区甲基化在食管癌、乳腺癌、胃癌等肿瘤中的陆续报道说明其与这些肿瘤的发生与进展密切相关.
国内外关于肝细胞癌组织中wwox启动子区甲基化状态及蛋白表达情况的报道较少. 本文通过甲基化特异性PCR(MSP)方法及免疫组织化学(IHC)法分别检测60例肝细胞性肝癌组织和癌旁组织中wwox基因启动子甲基化状态和蛋白表达水平, 分析探讨wwox基因启动子甲基化及蛋白表达与肝细胞性肝癌的临床病理参数关系.
研究发现肝细胞癌组织及癌旁组织中wwox基因启动子甲基化状态及WWOX蛋白表达在癌和癌旁组织中有显著差异; wwox基因启动子甲基化与肝外转移、肿瘤直径、肿瘤细胞分化密切相关; WWOX蛋白表达与临床分期、肿瘤直径、肿瘤细胞分化密切相关. wwox基因启动子甲基化与蛋白表达呈显著负相关, 说明肝癌中启动子区甲基化是wwox基因失活的重要机制, 针对性的检测其甲基化状态, 采取相应的基因靶向治疗, 将为肝癌的检测和治疗提供新的途径.
本文具有一定的创新性, 为肝癌的发生、进展及治疗提供了可靠理论依据.
编辑: 田滢 电编:闫晋利
| 1. | Robertson KD, Wolffe AP. DNA methylation in health and disease. Nat Rev Genet. 2000;1:11-19. [PubMed] [DOI] |
| 2. | Bednarek AK, Laflin KJ, Daniel RL, Liao Q, Hawkins KA, Aldaz CM. WWOX, a novel WW domain-containing protein mapping to human chromosome 16q23.3-24.1, a region frequently affected in breast cancer. Cancer Res. 2000;60:2140-2145. [PubMed] |
| 3. | Chang NS, Hsu LJ, Lin YS, Lai FJ, Sheu HM. WW domain-containing oxidoreductase: a candidate tumor suppressor. Trends Mol Med. 2007;13:12-22. [PubMed] [DOI] |
| 4. | Aqeilan RI, Pekarsky Y, Herrero JJ, Palamarchuk A, Letofsky J, Druck T, Trapasso F, Han SY, Melino G, Huebner K. Functional association between Wwox tumor suppressor protein and p73, a p53 homolog. Proc Natl Acad Sci U S A. 2004;101:4401-4406. [PubMed] [DOI] |
| 5. | Määttä JA, Sundvall M, Junttila TT, Peri L, Laine VJ, Isola J, Egeblad M, Elenius K. Proteolytic cleavage and phosphorylation of a tumor-associated ErbB4 isoform promote ligand-independent survival and cancer cell growth. Mol Biol Cell. 2006;17:67-79. [PubMed] [DOI] |
| 6. | Gaudio E, Palamarchuk A, Palumbo T, Trapasso F, Pekarsky Y, Croce CM, Aqeilan RI. Physical association with WWOX suppresses c-Jun transcriptional activity. Cancer Res. 2006;66:11585-11589. [PubMed] [DOI] |
| 7. | O'Keefe LV, Richards RI. Common chromosomal fragile sites and cancer: focus on FRA16D. Cancer Lett. 2006;232:37-47. [PubMed] [DOI] |
| 8. | Olatunji BO, Sawchuk CN, Lee TC, Lohr JM, Tolin DF. Information processing biases in spider phobia: application of the Stroop and "White Noise" Paradigm. J Behav Ther Exp Psychiatry. 2008;39:187-200. [PubMed] [DOI] |
| 9. | Iliopoulos D, Guler G, Han SY, Johnston D, Druck T, McCorkell KA, Palazzo J, McCue PA, Baffa R, Huebner K. Fragile genes as biomarkers: epigenetic control of WWOX and FHIT in lung, breast and bladder cancer. Oncogene. 2005;24:1625-1633. [PubMed] [DOI] |
| 10. | Wang X, Chao L, Jin G, Ma G, Zang Y, Sun J. Association between CpG island methylation of the WWOX gene and its expression in breast cancers. Tumour Biol. 2009;30:8-14. [PubMed] [DOI] |
| 11. | Guo W, Wang G, Dong Y, Guo Y, Kuang G, Dong Z. Decreased expression of WWOX in the development of esophageal squamous cell carcinoma. Mol Carcinog. 2011; Dec 27. [Epub ahead of print]. [PubMed] [DOI] |
| 12. | Yan J, Zhang M, Zhang J, Chen X, Zhang X. Helicobacter pylori infection promotes methylation of WWOX gene in human gastric cancer. Biochem Biophys Res Commun. 2011;408:99-102. [PubMed] [DOI] |
| 13. | Donati V, Fontanini G, Dell'Omodarme M, Prati MC, Nuti S, Lucchi M, Mussi A, Fabbri M, Basolo F, Croce CM. WWOX expression in different histologic types and subtypes of non-small cell lung cancer. Clin Cancer Res. 2007;13:884-891. [PubMed] [DOI] |
| 14. | Kuroki T, Tajima Y, Furui J, Kanematsu T. Common fragile genes and digestive tract cancers. Surg Today. 2006;36:1-5. [PubMed] [DOI] |
| 15. | Lan C, Chenggang W, Yulan B, Xiaohui D, Junhui Z, Xiao W. Aberrant expression of WWOX protein in epithelial ovarian cancer: a clinicopathologic and immunohistochemical study. Int J Gynecol Pathol. 2012;31:125-132. [PubMed] [DOI] |
| 16. | Belinsky SA, Nikula KJ, Palmisano WA, Michels R, Saccomanno G, Gabrielson E, Baylin SB, Herman JG. Aberrant methylation of p16(INK4a) is an early event in lung cancer and a potential biomarker for early diagnosis. Proc Natl Acad Sci USA. 1998;95:11891-11896. [PubMed] [DOI] |