修回日期: 2012-09-20
接受日期: 2012-11-07
在线出版日期: 2012-12-18
目的: 探讨慢性梗阻性黄疸大鼠中瑞舒伐他汀钙对氧化低密度脂蛋白(Ox-LDL)表达的调节及肝脏纤维化影响.
方法: 90只SD大鼠随机分成对照组(A组)、慢性梗阻性黄疸组(B组)和慢性梗阻性黄疸+瑞舒伐他汀钙组(C组), 每组每时段6只. 分别于造模后第1、2、3、4和5周抽取大鼠静脉血检查肝功能, 免疫荧光法检测Ox-LDL在肝脏的表达, 放射免疫法检测肝纤维3项, 光学显微镜观察肝组织的病理改变. 第4周行胆总管十二指肠吻合再通.
结果: B组大鼠术后总胆红素明显升高, 组织病理学检查显示肝细胞变性, 并有纤维增生性改变. 与A组比较, 慢性梗阻性黄疸组肝组织Ox-LDL的表达增强, 肝纤维3项术后第3周起明显升高. C组大鼠术后胆红素升高, 组织病理学检查显示肝脏有纤维增生改变. 与B组比较, 肝脏Ox-LDL的表达与肝纤维3项减弱. 术后Ox-LDL的表达及肝纤维化3项差异有统计学意义(P<0.05).
结论: 慢性梗阻性黄疸大鼠中瑞舒伐他汀钙能调节Ox-LDL的表达, 延缓肝纤维化的发生.
引文著录: 余水平, 周雪玲. 瑞舒伐他汀钙对慢性梗阻性黄疸大鼠肝脏纤维化的影响. 世界华人消化杂志 2012; 20(35): 3564-3569
Revised: September 20, 2012
Accepted: November 7, 2012
Published online: December 18, 2012
AIM: To investigate the effect of treatment with rosuvastatin calcium on expression of Ox-LDL and liver fibrosis in a rat model of chronic obstructive jaundice.
METHODS: Ninety Sprague-Dawley rats were randomly and equally divided into three groups: control group, and chronic obstructive jaundice group, and rosuvastatin calcium group. Each group was further divided into five subgroups for testing at different time points. Liver function was determined. Expression of Ox-LDL was tested by immunofluorescence, and liver fibrosis was assessed by radioimmunoassay. Pathological changes in liver tissue were observed by optical microscopy at weeks 1, 2, 3, 4, and 5 after model induction. Choledochoduodenostomy was performed at week 4.
RESULTS: Rats with chronic obstructive jaundice showed remarkable jaundice and obvious degeneration and hyperplasia of liver cells. There were also significant changes in expression of Ox-LDL and three liver fibrosis indicators. Jaundice slowly subsided after choledochoduodenostomy. Total bilirubin, expression of Ox-LDL and three liver fibrosis indicators differed significantly at different time points between the chronic obstructive jaundice group and rosuvastatin calcium group (all P < 0.05).
CONCLUSION: There was a significant relation between expression of Ox-LDL and liver fibrosis in rats with chronic obstructive jaundice. Treatment with rosuvastatin calcium could regulate the expression of Ox-LDL and improve liver fibrosis in rats with chronic obstructive jaundice.
- Citation: Yu SP, Zhou XL. Treatment with rosuvastatin calcium improves liver fibrosis in a rat model of chronic obstructive jaundice. Shijie Huaren Xiaohua Zazhi 2012; 20(35): 3564-3569
- URL: https://www.wjgnet.com/1009-3079/full/v20/i35/3564.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i35.3564
慢性梗阻性黄疸是普外科常见的临床症状群, 可引起诸多组织、器官的损害, 其中最主要的是肝脏损伤, 随着胆梗阻时间的延长可由肝细胞坏死发展到纤维组织增生甚至胆性肝硬化, 严重危害机体健康甚至危及生命. 氧化低密度脂蛋白(Ox-LDL)通常被认为是致动脉粥样硬化的关键作用物, 近年来研究发现肝脏的内皮细胞中存在Ox-LDL特定的受体, 在梗阻性黄疸和肝脏的纤维化中发挥重要的作用[1,2]. 瑞舒伐他汀钙是一种选择性HMG-CoA还原酶抑制剂, 可以通过抑制循环血中单核巨噬细胞对血管内皮的黏附聚集, 抑制单核巨噬细胞对LDL的氧化修饰, 减少泡沫细胞的形成. Fellström等[3]的研究发现瑞舒伐他汀钙可以降低终末期肾病的血液透析患者血浆中Ox-LDL的水平. 本研究在建立慢性梗阻性黄疸大鼠模型的基础上, 探讨瑞舒伐他汀钙对梗阻性黄疸大鼠中Ox-LDL表达的调节, 从而改善肝脏纤维化的发生, 为临床治疗梗阻性黄疸并发肝纤维化提供一种新的途径.
♀SD大鼠90只, 体质量180 g±20 g, 随机被分成对照组(A组)、慢性梗阻性黄疸组(B组)和慢性梗阻性黄疸+瑞舒伐他汀钙组(C组), 每组每时段6只, 平均分5个时段, 每时段6只. 大鼠均由中山大学北校区实验动物中心提供.
1.2.1 慢性大鼠梗阻性黄疸模型的建立: 6-0 VICRYL可吸收线经碘仿纱布术前处理备用, 实验大鼠术前12 h禁食、禁水. 乙醚吸入麻醉. 剑突下正中切口进腹, SXP-1C显微镜下显露胆总管, 距十二指肠上缘1 cm处纵行缝过胆总管, 将碘仿纱布处理的6-0 VICRYL可吸收线贯通置于胆总管内, 长度0.5 cm, 固定. 随后关腹, 结束手术.
1.2.2 胆总管十二指肠端侧吻合: 模型建立后第4周. 术前12 h禁食、禁水. 乙醚吸入麻醉. 剑突下正中切口进腹, 显露胆总管及十二指肠降部, SXP-1C显微镜下用8-0 PROLENE线将胆总管与十二指肠降部端侧吻合. 随后关腹结束手术. 对照组仅行开、关腹手术.
1.2.3 大鼠药物灌胃: 瑞舒伐他汀钙+慢性梗阻性黄疸组大鼠予以瑞舒伐他汀钙0.5 mg+NS 1 mL, 灌胃, 2次/d. 慢性梗阻性黄疸组及对照组大鼠予以NS 1 mL灌胃, 2次/d.
1.2.4 标本采集: 分别于造模后第1、2、3、4和5周乙醚麻醉下处理各组大鼠, 心脏采血行肝功能及肝纤3项检查. 肝脏冰冻组织切片行Ox-LDL检测. 取出部分肝脏左叶组织行光镜检查.
1.2.5 免疫荧光检测肝组织氧化低密度脂蛋白: Ox-LDL抗体购自广州英韦创津试剂公司. 冰冻切片冷丙酮固定10 min, 滴加0.01 mol/L, pH 7.4的PBS于未知抗原标本片, 10 min后弃去, 使标本片保持一定湿度. 用含0.05%血清的PBS封闭60 min. 滴加以0.01 mol/L, pH 7.4的PBS 1:100稀释的一抗, 覆盖未知抗原标本片. 将玻片置于有盖搪瓷盒内, 4 ℃过夜. 取出玻片, 置于玻片架上, 先用0.01 mol/L, pH 7.4的PBS冲洗1-2次, 然后按顺序过0.01 mol/L, pH 7.4的PBS 3缸浸泡, 每缸5 min, 不时振荡. 取出玻片, 用滤纸吸去多余水分, 但不使标本干燥, 滴加一滴一定稀释度的荧光标记二抗. 将玻片平放在有盖搪瓷盒内, 37 ℃保温30 min. 0.01 mol/L, pH 7.4的PBS冲洗1-2次, 然后按顺序过0.01 mol/L, pH 7.4的PBS 3缸浸泡, 每缸5 min, 不时振荡. 用滤纸吸去多余水分, 滴加一滴DAPI, 再覆以盖玻片. 荧光显微镜高倍视野下观察, 结果判定同直接法.
1.2.6 结果判定: 通过荧光显微镜下观察肝组织的荧光阳性比率与强度进行评分. (1)阳性细胞比率评分为: 阳性细胞数占总细胞数<10%为0分; 阳性细胞数占总细胞数11%-25%为1分; 阳性细胞数占总细胞数26%-50%为2分; 阳性细胞数占总细胞数51%-75%为3分; 阳性细胞数占总细胞数>75%为4分; (2)强度评分为: (-)为0分; (±)高倍镜下隐约可见为1分; +低倍镜下隐约可见为2分; (++)为高倍镜下清晰可见为3分; (+++)为低倍镜下清晰可见为4分; (++++)为低倍镜耀眼, 高倍镜下刺眼为5分; (3)总评分 = 阳性细胞比率评分+强度评分.
统计学处理 数据采用SPSS13.0统计软件处理. 实验数据以mean±SD表示. 均数用方差分析中的多个样本均数的两两检验. P<0.05被视为差异有统计学意义.
慢性梗阻性黄疸大鼠术后精神萎靡, 活动及纳食减少, 术后第3天出现尿液及尾巴黄染, 1 wk后尿液黄染消失, 至第2周尿液再次出现黄染, 呈波动性, 且黄染逐渐加深. 标本采集时发现肝脏黄染肿胀, 部分质地变硬. 第4周胆总管十二指肠吻合再通后尿液黄染逐渐消失. 慢性梗阻性黄疸+瑞舒伐他汀钙组大鼠术后黄疸呈现波动性, 黄疸缓慢加重.
慢性梗阻性黄疸大鼠与慢性梗阻性黄疸+瑞舒伐他汀钙组大鼠谷氨酸转氨酶(glutamate transaminase, AST)、总胆红素(total bilirubin, TB)、直接胆红素(direct bilirubin, DB)呈波动性增高. 与对照组比较, 慢性梗阻性黄疸大鼠除第2周组外,其余各组AST、TB、DB明显升高, 差异均有统计学意义(P<0.05). 与慢性梗阻性黄疸+瑞舒伐他汀钙组大鼠比较, AST、TB、DB升高不明显, 术后差异无统计学意义(P<0.05). 肝功能检查结果见表1.
| 分组 | 谷氨酸转氨酶 | 直接胆红素 | 总胆红素 |
| 第1周 | |||
| A组 | 28.17±4.02a | 9.54±2.39b | 13.74±1.78b |
| B组 | 72.67±43.67 | 33.93±17.36 | 42.43±23.56 |
| C组 | 65.52±34.26 | 30.25±16.38 | 38.54±25.25 |
| 第2周 | |||
| A组 | 30.17±3.98 | 12.65±2.69 | 14.72±2.07 |
| B组 | 28.33±9.58 | 19.29±9.41 | 24.87±6.78 |
| C组 | 25.52±4.25 | 15.25±6.30 | 28.54±5.28 |
| 第3周 | |||
| A组 | 31.67±3.93a | 15.30±3.24a | 19.09±2.24a |
| B组 | 90.67±43.14 | 34.38±38.99 | 48.53±37.78 |
| C组 | 82.39±33.76 | 24.36±18.66 | 42.25±38.42 |
| 第4周 | |||
| A组 | 28.34±6.05a | 10.56±2.88a | 15.74±3.76a |
| B组 | 65.62±42.68 | 32.91±17.56 | 36.52±16.28 |
| C组 | 58.62±36.36 | 28.63±19.53 | 32.25±17.14 |
| 第5周 | |||
| A组 | 30.62±3.65a | 16.50±4.25a | 19.65±3.25a |
| B组 | 60.63±41.25 | 24.42±18.15 | 32.15±13.20 |
| C组 | 45.26±27.53 | 18.16±16.24 | 30.27±11.25 |
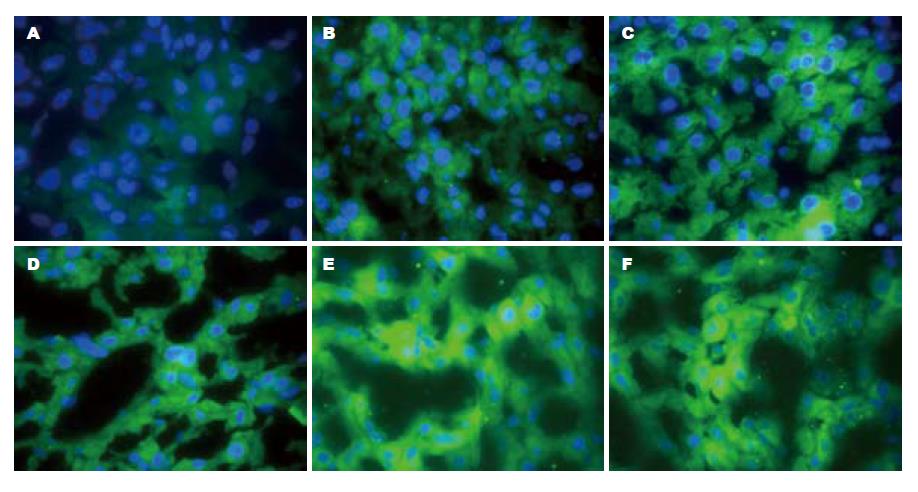
慢性梗阻性黄疸大鼠肝细胞胞膜及胞浆中可见Ox-LDL的荧光颗粒表达, 随着梗阻时间的延长, 表达强度呈现波动性增强. 慢性梗阻性黄疸+瑞舒伐他汀钙组可见Ox-LDL在肝细胞膜及胞浆中的荧光表达. 对照组中未见明显的Ox-LDL荧光颗粒表达. 肝脏Ox-LDL免疫荧光表达见图1, 表2.
放射免疫法检测大鼠血清透明质酸(hyaluronic acid, HA)、层黏蛋白(laminin, LN)和Ⅲ型前胶原(procollagen Ⅲ, PC Ⅲ). 慢性梗阻性黄疸大鼠术后第3周明显升高,与对照组相比差异均有统计学意义(P<0.05). 慢性梗阻性黄疸+瑞舒伐他汀钙组大鼠术后第3周升高, 与慢性梗阻性黄疸组大鼠相比差异有统计学意义(P<0.05). 血清肝纤维化3项的检测检测结果见表3.
| 分组 | 血清透明质酸 | 层黏蛋白 | Ⅲ型前胶原 |
| 第1周 | |||
| A组 | 46.50±24.26 | 63.05±36.25 | 29.40±12.36 |
| B组 | 62.67±33.68 | 52.56±25.20 | 23.93±17.45 |
| C组 | 52.67±35.66 | 42.36±28.15 | 22.39±15.58 |
| 第2周 | |||
| A组 | 38.65±13.24 | 51.86±31.35 | 12.56±12.20 |
| B组 | 58.33±19.05 | 39.35±25.32 | 18.20±9.46 |
| C组 | 48.36±15.28 | 32.65±21.28 | 16.15±8.50 |
| 第3周 | |||
| A组 | 35.60±23.36b | 59.35±21.65a | 25.32±13.26 |
| B组 | 90.64±43.16 | 88.65±35.86 | 53.35±26.15 |
| C组 | 70.18±33.24a | 68.36±31.52a | 43.35±18.64a |
| 第4周 | |||
| A组 | 48.06±15.25b | 31.65±13.42a | 30.63±22.47a |
| B组 | 365.35±132.35 | 80.46±64.34 | 62.91±17.56 |
| C组 | 258.25±128.66b | 65.24±36.35a | 45.17±21.36a |
| 第5周 | |||
| A组 | 50.62±23.45b | 58.65±32.46b | 56.25±14.20b |
| B组 | 630.25±342.65 | 118.35±25.52 | 124.20±68.35 |
| C组 | 435.26±245.54b | 78.45±35.68a | 94.33±48.62a |
慢性梗阻性黄疸大鼠术后1 wk肝细胞出现水样变性, 随后可见恢复, 第3周后肝细胞可见点状坏死, 肝小叶中央出现淤胆, 小胆管增生明显, 汇管区纤维化明显, 肝组织部分出现纤维增生. 第5周胆总管再通后仍见肝组织部分纤维化. 慢性梗阻性黄疸+瑞舒伐他汀钙组大鼠术后第3周可见肝细胞点状坏死, 小胆管增生, 淤胆, 肝组织部分出现纤维组织增生.
瑞舒伐他汀钙作为一种强效的新型他汀类药物, 属于3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂, 是目前常规治疗剂量下降低LDL作用最强的他汀类降脂药, 具有丰富的降脂外抗动脉粥样硬化作用[4,5]. Tan等[6]研究发现在冠心病合并糖尿病患者中使用瑞舒伐他汀钙可降低炎症因子γ-干扰素(γ-interferon, IFN-γ)、肿瘤坏死因子(tumor necrosis factor, TNF)、白细胞介素-6(interleukin-6, IL-6)及C反应蛋白(C-Reactive protein, CRP). 穆伟[7]用瑞舒伐他汀10 mg/d治疗不稳定型心绞痛患者4 wk后, 瑞舒伐他汀钙组高敏C反应蛋白(high-sensitivity C-reactive proteinhs, CRP)浓度较治疗前有明显下降(P<0.05)均表明瑞舒伐他汀钙在冠心病的防治中占有重要地位, 他不仅强效降脂、还具有逆转斑块、抗炎、抗氧化、免疫调节. 近年来研究还发现他汀类药物可以降低终末期肾病的血液透析患者血浆中Ox-LDL的水平, 虽然在大样本的临床试验中还未发现可以明显改善预后[8]. Resch等[9]在研究瑞舒伐他汀钙抗氧化及对Ox-LDL自身抗体调节的研究中发现, 治疗24 wk, 血浆内源性的过氧化物浓度及过氧化物酶活性明显下降, 血浆中Ox-LDL复合物浓度显著下降, 证实瑞舒伐他汀钙对Ox-LDL有明显的调节作用. 在我们的实验中也发现造模后3 wk, 在慢性梗阻性黄疸+瑞舒伐他汀钙组中Ox-LDL在肝脏中的表达比慢性梗阻性黄疸组的表达减弱(3.33±1.03 vs 1.17±0.75), 差异有统计学意义(P<0.05). 随着梗阻时间的延长, 差异越来越明显(P<0.01), 表明在大鼠慢性梗阻性黄疸模型中瑞舒伐他汀钙能减低Ox-LDL在肝脏中的表达.
Ox-LDL是LDL在过量自由基及其他致氧因素作用下发生脂质过氧化, 产生丙二醛(malondialdehyde, MDA), MDA与LDL载脂蛋白B(ApoB)中的赖氨酸残基结合发生化学修饰而形成. Ox-LDL近年来被认为是动脉粥样硬化发生发展的关键步骤[10]. 现在研究发现他在多种疾病过程中都有异常, 肖华等[11]研究发现Ox-LDL不仅能减少胶原的合成, 同时也能增加胶原的降解, 使细胞外基质发生紊乱, 从而可能参与心室的重构. Lee与Hong等[12,13]研究发现Ox-LDL在系膜细胞内可通过血管紧张素Ⅱ(angiotensins Ⅱ, Ang Ⅱ)、转化生长因子β(transforming growth factor-β, TGF-β)和Ras依赖的NADPH氧化酶增加胞内活性氧自由基的生成, 从而激活细胞外信号调节激酶(extracellular signal regulated kinase, ERK)信号转导途径, 导致Smad最大程度的活化和TGF-β1靶基因表达, 增加细胞外基质(extracellular matrix, ECM)的生成和结缔组织生长因子的表达, 如纤维连接蛋白, Ⅰ、Ⅲ和Ⅳ型胶原和纤维蛋白溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1, PAI-1)等来促进肾小球硬化及间质纤维化. Karadeniz等[2]研究发现Ox-LDL在梗阻性黄疸大鼠中肝脏纤维化、甚至肝硬化中起着重要的作用.
我们前期的研究发现慢性大鼠梗阻性模型黄疸症状及肝功能变化表现呈现慢性、波动性发展的特征表现, 更加接近于临床梗阻性黄疸病例表现[14]. 梗阻性黄疸最主要的病理表现是肝脏的纤维化, 近来研究发现Ox-LDL的表达与肝脏纤维化的发生并逐渐加重存在一定的联系[1]. 我们的实验也发现, 造模后3 wk Ox-LDL在肝脏的表达明显增强, 差异有显著性意义(P<0.01), 随着时间的延长及梗阻恢复再通, 差异仍有显著性意义. 慢性梗阻性黄疸模型组肝纤维化3项与对照组相比也均有统计学意义, 表明慢性梗阻性黄疸模型自3 wk后, Ox-LDL的表达与肝脏纤维化的发生并逐渐加重存在一定的联系. 慢性梗阻性黄疸+瑞舒伐他汀钙组中Ox-LDL在肝脏的表达较慢性梗阻性黄疸组减弱, 差异有统计学意义(P<0.05), 肝纤维化3项相比也均有统计学意义(P<0.05).
肝纤维化是梗阻性黄疸的常见表现, 也是肝硬化的必经阶段, 其发病机制仍不清楚, 尽早明确肝纤维化的发病机制能有效逆转肝纤维化的发展. 本研究发现瑞舒伐他汀钙能下调Ox-LDL在肝脏的表达和肝脏的纤维化也存在一定的联系, 为临床能合理提供一个新的防治慢性梗阻性黄疸引发的肝脏纤维化途径.
氧化低密度脂蛋白(Ox-LDL)通常被认为是致动脉粥样硬化的关键作用物, 近年来研究发现Ox-LDL在梗阻性黄疸和肝脏的纤维化中发挥重要的作用.
党双锁, 教授, 西安交通大学医学院第二附属医院感染科
Fellstrom等研究发现瑞舒伐他汀钙可以降低终末期肾病的血液透析患者血浆中Ox-LDL的水平.
本研究发现瑞舒伐他汀钙能下调Ox-LDL在肝脏的表达, 和肝脏的纤维化也存在一定的联系.
本本实验设计合理, 紧密结合临床, 方法正确, 结果分析恰当, 对临床使用瑞舒伐他汀钙治疗慢性梗阻性黄疸大鼠肝脏纤维化提供了一定的实验依据.
编辑: 田滢 电编:闫晋利
| 1. | Cömert M, Tekin IO, Acikgöz S, Ustündağ Y, Uçan BH, Acun Z, Barut F, Sümbüloğlu V. Experimental bile-duct ligation resulted in accumulation of oxidized low-density lipoproteins in BALB/c mice liver. J Gastroenterol Hepatol. 2004;19:1052-1057. [PubMed] [DOI] |
| 2. | Karadeniz G, Acikgoz S, Tekin IO, Tascýlar O, Gun BD, Cömert M. Oxidized low-density-lipoprotein accumulation is associated with liver fibrosis in experimental cholestasis. Clinics (Sao Paulo). 2008;63:531-540. [PubMed] [DOI] |
| 3. | Fellström BC, Jardine AG, Schmieder RE, Holdaas H, Bannister K, Beutler J, Chae DW, Chevaile A, Cobbe SM, Grönhagen-Riska C. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med. 2009;360:1395-1407. [PubMed] [DOI] |
| 4. | Verreth W, De Keyzer D, Davey PC, Geeraert B, Mertens A, Herregods MC, Smith G, Desjardins F, Balligand JL, Holvoet P. Rosuvastatin restores superoxide dismutase expression and inhibits accumulation of oxidized LDL in the aortic arch of obese dyslipidemic mice. Br J Pharmacol. 2007;151:347-355. [PubMed] [DOI] |
| 5. | Naito Y, Katada K, Takagi T, Tsuboi H, Isozaki Y, Handa O, Kokura S, Yoshida N, Ichikawa H, Yoshikawa T. Rosuvastatin, a new HMG-CoA reductase inhibitor, reduces the colonic inflammatory response in dextran sulfate sodium-induced colitis in mice. Int J Mol Med. 2006;17:997-1004. [PubMed] |
| 6. | Tan LG, Berk LS, Tan SA. Combined effects of rosuvastatin and pioglitazone in attenuating interferon gamma, tumor necrosis factor alpha, interleukin-6, Creactive protein, and increasing interleukin-4 may provide cardioprotection for patients with diabetes. Chest. 2006;130:191S. |
| 8. | Tsimihodimos V, Dounousi E, Siamopoulos KC. Dyslipidemia in chronic kidney disease: an approach to pathogenesis and treatment. Am J Nephrol. 2008;28:958-973. [DOI] |
| 9. | Resch U, Tatzber F, Budinsky A, Sinzinger H. Reduction of oxidative stress and modulation of autoantibodies against modified low-density lipoprotein after rosuvastatin therapy. Br J Clin Pharmacol. 2006;61:262-274. [PubMed] [DOI] |
| 10. | Matsuura E, Hughes GR, Khamashta MA. Oxidation of LDL and its clinical implication. Autoimmun Rev. 2008;7:558-566. [PubMed] [DOI] |
| 12. | Lee HS, Song CY. Oxidized low-density lipoprotein and oxidative stress in the development of glomerulosclerosis. Am J Nephrol. 2009;29:62-70. [PubMed] [DOI] |
| 13. | Hong HK, Song CY, Kim BC, Lee HS. ERK contributes to the effects of Smad signaling on oxidized LDL-induced PAI-1 expression in human mesangial cells. Transl Res. 2006;148:171-179. [PubMed] [DOI] |