修回日期: 2012-11-11
接受日期: 2012-11-23
在线出版日期: 2012-12-08
目的: 构建靶向PRL-3基因的miRNA495和miRNA551a真核表达载体, 观察其转染胃癌SGC7901细胞后对胃癌细胞PRL-3基因表达的影响.
方法: 设计并合成两条针对PRL-3基因的特异性miRNA495和miRNA551a干扰序列, 分别与pcDNA6.2-GW/EmGFP-miR载体连接, 转化大肠杆菌, 纯化并鉴定后利用LipofectamineTM2000转染胃癌SGC7901细胞, 实时定量PCR及Western blot技术鉴定重组体对PRL-3基因表达的干扰效果.
结果: 针对PRL-3基因的miRNA495和miRNA551a干扰质粒构建成功, 胃癌SGC7901细胞分别转染两种质粒后miRNA495及miRNA551a的表达明显升高, 并且明显抑制了PRL-3基因 mRNA及蛋白的表达.
结论: 靶向PRL-3基因的miRNA495和miRNA551a真核表达载体构建成功, 其可有效提高胃癌SGC7901细胞miRNA495和miRNA551a的表达, 并抑制PRL-3 mRNA及PRL-3蛋白的表达.
引文著录: 蒋蒙蒙, 曹毅, 李正荣, 揭志刚. miR495、miR551a靶向干扰SGC7901细胞PRL-3基因的表达. 世界华人消化杂志 2012; 20(34): 3361-3365
Revised: November 11, 2012
Accepted: November 23, 2012
Published online: December 8, 2012
AIM: To construct miRNA495 and miRNA551a expression vectors targeting the PRL-3 gene, and to observe the effect of vector transfection on the expression of PRL-3 in gastric cancer SGC7901 cells.
METHODS: Specific pre-miRNA495 and pre-miRNA551a sequences targeting the PRL-3 gene were designed, synthesized, and ligated with the pcDNA6.2-GW/EmGFP-miR vector. After sequencing to confirm correct insertion, the recombinant vectors were transfected into SGC7901 cells with Lipofectamine™ 2000. The expression of PRL-3 in transfected cells was detected by real-time PCR and Western blot.
RESULTS: The PRL-3 pre-miRNA495 and pre-miRNA551a recombinant plasmids were successfully constructed, and they could effectively promote the expression of miRNA495 and miRNA551a and inhibit PRL-3 mRNA and protein expression in SGC7901 cells.
CONCLUSION: The miRNA495 and miRNA551a expression vectors for silencing the PRL-3 gene have been constructed successfully, which could effectively promote the expression of miRNA495 and miRNA551a and inhibit PRL-3 mRNA and protein expression in SGC7901 cells.
- Citation: Jiang MM, Cao Y, Li ZR, Jie ZG. Suppressive effect of miR495 and miR551a on PRL-3 expression in gastric cancer SGC7901 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(34): 3361-3365
- URL: https://www.wjgnet.com/1009-3079/full/v20/i34/3361.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i34.3361
MicroRNA(miRNA)是在真核生物中发现的一类内源性的具有调控功能的非编码单链RNA分子, 其大小长约20-25个核苷酸. 成熟的miRNA是由较长的初级转录物经过一系列核酸酶的剪切加工而产生的, 随后组装进RNA诱导的沉默复合体, 通过碱基互补配对的方式识别靶mRNA, 并根据互补程度的不同指导沉默复合体降解靶mRNA或者阻遏靶mRNA的翻译, 达到调控基因表达的目的. 近几年来的研究表明, miRNA 参与各种各样的调节途径, 包括发育、病毒防御、造血过程、器官形成、细胞增殖和凋亡、脂肪代谢等. miRNA既可作为促癌基因参与恶性肿瘤的发生和发育过程[1,2], 又可作为抑癌基因控制恶性肿瘤的形成[3,4], 在肿瘤的发生和发展中起着重要的作用. 肝再生磷酸酶(phosphatase of regenerating liver-3, PRL-3)属于蛋白酪氨酸磷酸酶家族, PRL-3在胃癌组织中高表达[5], miRNA495(miR495)和miRNA551a(miR551a)这两条miRNA分子在胃癌组织及胃癌细胞中呈明显低表达[6]. 我们构建了miR495和miR551a的真核表达载体, 稳定转染胃癌SGC7901细胞后, 观察了其对胃癌SGC7901细胞PRL-3基因表达的抑制作用.
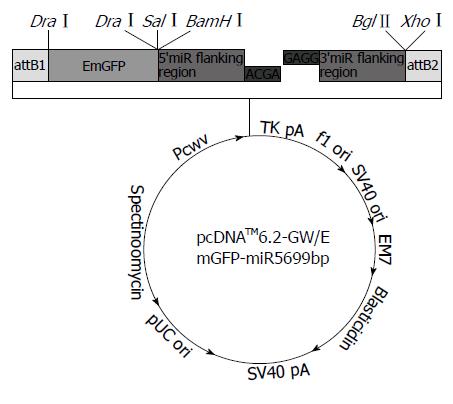
pcDNA6.2-GW/EmGFP-miR载体、大肠杆菌菌株DH5α、LipofectamineTM2000购自Invitrogen公司; 兔抗人一抗购自美国Sigma公司;鼠抗兔二抗购自美国Santa Cruz公司; BLOCK-iTTM Pol Ⅱ miR RNAi Expression Vector Kit with EmGFP(invitrogen, Catalog No. K4936-00)购自Invitrogen公司; Pure Midi Plasmid Kit、λDNA/Hind Ⅲ购自TIANGEN BIOTECH公司; 普通质粒小抽试剂盒, pcDNATM6.2-GW/EmGFPmiR的反向测序引物5'-CTCTAGATCAACCACTTTGT -3'购自Invitrogen公司; U6 SnRNA由上海闪晶分子生物科技有限公司合成, β-actin PCR引物由广州锐博生物公司合成.
1.2.1 miR495和miR551a表达载体的构建: (1)目的基因: >hsa-miR-495: AAACAAACAUGGUGCACUUCUU, >hsa-miR-551a: GCGACCCACUCUUGGUUUCCA; (2)寡聚单链DNA的合成: 以miR495和miR551a基因为目的基因合成2对miRNA寡聚单链DNA, 序列见表1; (3)双链DNA的退火和装载: 将2对寡聚单链DNA退火成双链, 然后用载体构建试剂盒BLOCK-iTTM Pol Ⅱ miR RNAi Expression Vector Kit with EmGFP(invitrogen, Catalog no. K4936-00)进行重组克隆, 将2对双链的miRNA oligo分别插入到miRNA表达载体pcDNATM6.2-GW/EmGFPmiR中(invitrogen, Catalog No. K4936-00, 载体图谱见图1), 构建2个miRNA表达质粒, 并转化至感受态细胞DH5α. 退火和连接的具体方法如下: 将2对合成好的寡聚单链DNA用ddH2O溶解成100 μmol/L, 互补单链各取5 μL两两混合, 按20 μL体系进行退火. 然后将2份oligo混合物在95 ℃加热5 min, 然后放置室温自然冷却20 min, 形成双链DNA. 将退火的双链DNA继续稀释成10 nmol/L浓度, 取5×ligation buffer 4 μL, pcDNA6.2-GW/EmGFP 2 μL, ds oligo(10 nmol/L) 4 μL, T4 DNA ligase(1 U/µL)1 μL, ddH2O 9 μL, 配成20 μL酶连接体系在室温连接30 min.
| oligo名称 | 寡聚单链DNA序列5'-3' |
| miR495-F | TGCTGAAACAAACAtGGtGCACttCttGTTTTGGCCACTGACTGACaaGaaGTGCCaTGTTTGTTT |
| miR495-R | CCTGAAACAAACAtGGCACttCttGTCAGTCAGTGGCCAAAACaaGaaGTGCaCCaTGTTTGTTTC |
| miR551a-F | TGCTGGCGACCCACtCttGGtttCCAGTTTTGGCCACTGACTGACTGGaaaCCGaGTGGGTCGC |
| miR551a-R | CCTGGCGACCCACtCGGtttCCAGTCAGTCAGTGGCCAAAACTGGaaaCCaaGaGTGGGTCGCC |
| Negative control | |
| Negative-F | tgctgAAATGTACTGCGCGTGGAGACGTTTTGGCCACTGACTGACGTCTCCACGCAGTACATTT |
| Negative-R | cctgAAATGTACTGCGTGGAGACGTCAGTCAGTGGCCAAAACGTCTCCACGCGCAGTACATTTc |
1.2.2 质粒抽提与测序: 将连接产物转化DH5α, 将含有重组体的菌液涂在含壮观霉素LB平板上, 每个转化平板分别挑取4个克隆, 用普通质粒小抽试剂盒摇菌抽提质粒后送上海英俊生物工程技术服务有限公司进行插入片段测序.
1.2.3 细胞培养及转染: 人胃癌SGC7901细胞于含10%胎牛血清、37 ℃、50 mL/L CO2环境下培养、传代, 获得稳定转染细胞系, 历时58 d. 选择生长状态良好的细胞接种于6孔培养板, 加入不含双抗培养基, 待细胞生长密度达到70%左右时随机分为4组: 空白对照组不加任何处理, 阴性对照组加入转染无关序列的质粒, miR495组加入miR495质粒, miR551a组加入miR551a质粒.
1.2.4 实时定量PCR检测miR495、miR551a及PRL-3 mRNA的表达: 采用qRT-PCR法转染24 h后抽提各组细胞总RNA, 然后反转录合成cDNA. 将PCR产物从60 ℃缓慢均匀提升到97 ℃, 进行DNA扩增, 共35个循环. 利用样本miR495、miR551a与U6 snRNA含量的比值以及PRL-3 mRNA与β-actin含量的比值, 来评价miR495、miR551a及PRL-3 mRNA相对表达水平. 以2-△△CT法来分析荧光实时定量PCR检测结果.
1.2.5 Western blot技术鉴定重组体对PRL-3蛋白表达的干扰: 转染48 h后提取各组细胞总蛋白, 用10%SDS-PAGE进行凝胶电泳, 样品分离后电转至PVDF膜, TBS冲洗后室温封闭2 h, 漂洗后加入l:100兔抗人一抗, 4 ℃过夜, 洗膜后加入1:5 000鼠抗兔二抗, 37 ℃孵育2 h, 洗膜30 min 后行ECL显影并压片, 将图片用凝胶图像处理系统分析目标条带的分子量和净光密度值.
统计学处理 实验检测结果均采用SPSS15.0软件分析, 各组实验各设3个复孔, 每组实验重复3次. 最终数据以3组数据mean±SD表示, 检测的结果对照组与实验组间比较采用方差分析. 以P<0.05认为具有统计学意义.
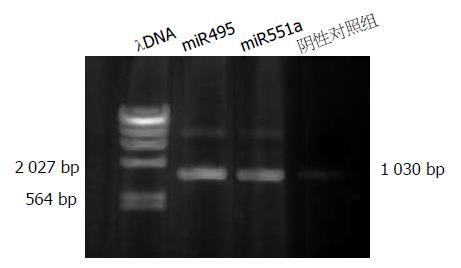
通过上海英骏生物公司结果表明, 所获得的重组干扰质粒目的片段与预期完全相符. 表明退火形成的干扰寡核苷酸成功连接入pcDNATM6.2-GW/EmGFPmiR载体.
重组体PCR扩增miR495、miR551a前体片段大小为1 032 bp和1 035 bp, 所显示的条带约为1 030 bp, 符合目的条带大小(图2), 初步证明pre-miRNA片段已正确定向插入到载体中. 同时测序结果显示所插入的序列完全正确, 表明已成功构建了针对人PRL-3基因的miR495、miR551a表达质粒.
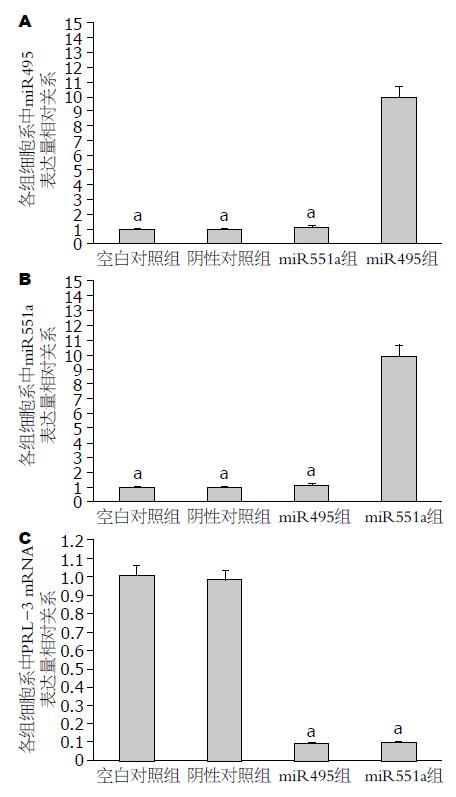
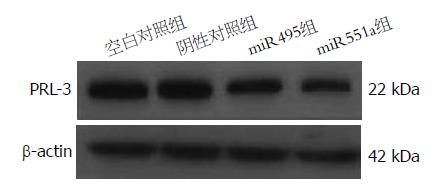
转染miR495组SGC7901细胞中, miR495表达量显著高于空白对照组、阴性对照组及miR551a组(图3A); 转染miR551a组SGC7901细胞中, miR551a表达量显著高于其余各组(图3B); miR495组和miR551a组中PRL-3 mRNA及PRL-3蛋白表达量显著低于空白对照组和阴性对照组(图3C, 图4).
胃癌是一种常见的严重威胁人类生命健康的恶性肿瘤, 占胃恶性肿瘤的95%[7], 居男性癌症死亡的第2位, 女性癌症死亡的第3位[8]. 在中国, 胃癌发病率很高, 每年有40万新病例, 30万人死亡[9]. 近年来的研究表明, miRNA的异常表达与肿瘤发生、发展和侵袭转移密切相关, 成为近几年的研究热点. 已有学者证明很多miRNA与胃癌的发病有关[10-12], 有部分miRNA与胃癌SGC7901细胞的凋亡密切相关[13,14], PRL-3的低表达能抑制胃癌细胞的增殖和转移[15-19], 我们的前期研究已证明miR495和miR551a在胃癌SGC7901细胞中低表达[6].
为了探索能抑制胃癌SGC7901细胞增殖和迁移的miRNA与PRL-3之间的关系, 我们选择miR495和miR551a为研究对象, 构建miR495和miR551a的真核表达载体, 载体构建成功后稳定转染胃癌SGC7901细胞, 通过荧光定量PCR法分别计算各组中miR495和miR551a的相对表达量,提取总蛋白, 利用Western blot方法进行PRL-3蛋白表达分析, 结果显示, 实验组细胞miR495和miR551a显著高于空白对照组细胞和阴性对照组细胞, PRL-3 mRNA及蛋白的表达显著低于空白对照组细胞和阴性对照组细胞.
综上所述, 靶向PRL-3基因的miR495和miR551a干扰质粒可显著抑制人胃癌SGC7901细胞中PRL-3 mRNA及蛋白的表达, 由于PRL-3在人胃癌的发生、发展过程中发挥着重要作用. 因此, 利用miR495及miR551a对PRL-3基因的表达调控作用, 可能抑制胃癌的侵袭转移. 下一步我们将研究PRL-3在胃癌细胞侵袭转移中的作用机制, 并探讨应用基因干扰技术抑制胃癌转移的可行性, 为寻求新的胃癌治疗方案提供理论基础.
成熟的miRNA是由较长的初级转录物经过一系列核酸酶的剪切加工而产生的, 随后组装进RNA诱导的沉默复合体, 通过碱基互补配对的方式识别靶mRNA, 并根据互补程度的不同指导沉默复合体降解靶mRNA或者阻遏靶mRNA的翻译, 达到调控基因表达的目的.
刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科
近几年来的研究表明, miRNA参与各种各样的调节途径, 包括发育、病毒防御、造血过程、器官形成、细胞增殖和凋亡、脂肪代谢等.
肝再生磷酸酶(PRL-3)属于蛋白酪氨酸磷酸酶家族, PRL-3在胃癌组织中高表达, miRNA495(miR495)和miRNA551 (miR551a)这两条miRNA分子在胃癌组织及胃癌细胞中呈明显低表达.
靶向PRL-3基因的miR495和miR551a干扰质粒可显著抑制人胃癌SGC7901细胞中PRL-3 mRNA及蛋白的表达, 由于PRL-3在人胃癌的发生、发展过程中发挥着重要作用.
本文以miR495和miR551a为研究对象, 构建miR495和miR551a的真核表达载体, 稳定转染胃癌SGC7901细胞后, 显著抑制PRL-3 mRNA及蛋白的表达, 实验设计合理, 具有一定的科学意义.
编辑: 翟欢欢 电编:闫晋利
| 1. | Zhang BG, Li JF, Yu BQ, Zhu ZG, Liu BY, Yan M. microRNA-21 promotes tumor proliferation and invasion in gastric cancer by targeting PTEN. Oncol Rep. 2012;27:1019-1026. [PubMed] |
| 2. | Li X, Zhang Y, Shi Y, Dong G, Liang J, Han Y, Wang X, Zhao Q, Ding J, Wu K. MicroRNA-107, an oncogene microRNA that regulates tumour invasion and metastasis by targeting DICER1 in gastric cancer. J Cell Mol Med. 2011;15:1887-1895. [PubMed] [DOI] |
| 3. | Xu Y, Zhao F, Wang Z, Song Y, Luo Y, Zhang X, Jiang L, Sun Z, Miao Z, Xu H. MicroRNA-335 acts as a metastasis suppressor in gastric cancer by targeting Bcl-w and specificity protein 1. Oncogene. 2012;31:1398-1407. [PubMed] [DOI] |
| 4. | Tsukamoto Y, Nakada C, Noguchi T, Tanigawa M, Nguyen LT, Uchida T, Hijiya N, Matsuura K, Fujioka T, Seto M. MicroRNA-375 is downregulated in gastric carcinomas and regulates cell survival by targeting PDK1 and 14-3-3zeta. Cancer Res. 2010;70:2339-2349. [PubMed] [DOI] |
| 5. | 蔡 世荣, 陈 创奇, 王 昭, 何 裕隆, 崔 冀, 吴 文辉, 吴 晖, 詹 文华. 促肝再生磷酸酶-3在胃癌患者组织中的表达及其对胃癌细胞生长的影响. 中华医学杂志. 2008;88:2326-2330. |
| 6. | Li Z, Cao Y, Jie Z, Liu Y, Li Y, Li J, Zhu G, Liu Z, Tu Y, Peng G. miR-495 and miR-551a inhibit the migration and invasion of human gastric cancer cells by directly interacting with PRL-3. Cancer Lett. 2012;323:41-47. [PubMed] [DOI] |
| 7. | 苏 娟, 张 庆瑜, 康 春生, 张 安玲, 王 涛, 张 洁. miR-200a通过β-catenin/TCF-4信号通路抑制胃癌细胞系生长侵袭能力的体外研究. 中国肿瘤临床. 2012;39:65-69. |
| 8. | Forman D, Burley VJ. Gastric cancer: global pattern of the disease and an overview of environmental risk factors. Best Pract Res Clin Gastroenterol. 2006;20:633-649. [PubMed] [DOI] |
| 9. | Yang L. Incidence and mortality of gastric cancer in China. World J Gastroenterol. 2006;12:17-20. [PubMed] |
| 10. | Yu BQ, Su LP, Li JF, Cai Q, Yan M, Chen XH, Yu YY, Gu QL, Zhu ZG, Liu BY. microrna expression signature of gastric cancer cells relative to normal gastric mucosa. Mol Med Report. 2012;6:821-826. [PubMed] |
| 11. | Li BS, Zhao YL, Guo G, Li W, Zhu ED, Luo X, Mao XH, Zou QM, Yu PW, Zuo QF. Plasma microRNAs, miR-223, miR-21 and miR-218, as novel potential biomarkers for gastric cancer detection. PLoS One. 2012;7:e41629. [PubMed] [DOI] |
| 12. | Guo JX, Tao QS, Lou PR, Chen XC, Chen J, Yuan GB. miR-181b as a potential molecular target for anticancer therapy of gastric neoplasms. Asian Pac J Cancer Prev. 2012;13:2263-2267. [PubMed] [DOI] |
| 13. | Li Z, Zhan W, Wang Z, Zhu B, He Y, Peng J, Cai S, Ma J. Inhibition of PRL-3 gene expression in gastric cancer cell line SGC7901 via microRNA suppressed reduces peritoneal metastasis. Biochem Biophys Res Commun. 2006;348:229-237. [PubMed] [DOI] |
| 14. | Chen Y, Zuo J, Liu Y, Gao H, Liu W. Inhibitory effects of miRNA-200c on chemotherapy-resistance and cell proliferation of gastric cancer SGC7901/DDP cells. Chin J Cancer. 2010;29:1006-1011. [PubMed] [DOI] |
| 15. | Wang Z, He YL, Cai SR, Zhan WH, Li ZR, Zhu BH, Chen CQ, Ma JP, Chen ZX, Li W. Expression and prognostic impact of PRL-3 in lymph node metastasis of gastric cancer: its molecular mechanism was investigated using artificial microRNA interference. Int J Cancer. 2008;123:1439-1447. [PubMed] [DOI] |
| 16. | Cai SR, Wang Z, Chen CQ, Cui J, Zhang CH, He YL, Zhan WH. [Role of silencing PRL-3 expression by miRNA interference in the growth of gastric cancer]. Zhonghua Waike Zazhi. 2008;46:618-621. [PubMed] |
| 17. | Wang Z, Cai SR, He YL, Zhan WH, Chen CQ, Cui J, Wu WH, Wu H, Song W, Zhang CH. High expression of PRL-3 can promote growth of gastric cancer and exhibits a poor prognostic impact on patients. Ann Surg Oncol. 2009;16:208-219. [PubMed] [DOI] |
| 18. | Matsukawa Y, Semba S, Kato H, Koma Y, Yanagihara K, Yokozaki H. Constitutive suppression of PRL-3 inhibits invasion and proliferation of gastric cancer cell in vitro and in vivo. Pathobiology. 2010;77:155-162. [PubMed] [DOI] |
| 19. | Pryczynicz A, Guzińska-Ustymowicz K, Chang XJ, Kiśluk J, Kemona A. PTP4A3 (PRL-3) expression correlate with lymphatic metastases in gastric cancer. Folia Histochem Cytobiol. 2010;48:632-636. [PubMed] |