修回日期: 2012-11-05
接受日期: 2012-11-15
在线出版日期: 2012-12-08
目的: 探讨染色体质域解螺旋酶DNA结合蛋白5(chromodomain helicase DNA-binding protein 5, CHD5)mRNA和蛋白的表达与胃癌发生、发展的关系.
方法: 采用RT-PCR和免疫组织化学方法(链霉菌抗生物素蛋白-过氧化物酶连结法, streptavidin-perosidase法), 检测63例胃癌组织及相应癌旁组织(距癌5 cm)中CHD5 mRNA和蛋白的表达情况, 并分析胃癌组织中CHD5 mRNA和蛋白的表达与临床病理特征之间的关系.
结果: CHD5 mRNA在63例胃癌组织中的表达量相对值明显低于在癌旁组织中的表达相对值(0.06±0.04 vs 0.34±0.06, t = 59.204, P<0.01). 在胃癌组织中, CHD5 mRNA的表达与肿瘤的分化程度、TNM分期、淋巴结转移有关(均P<0.05). CHD5基因的蛋白在胃癌组织和相应癌旁组织中的表达阳性率分别为36.5%和71.4%. 在胃癌组织中CHD5蛋白的表达与肿瘤的分化程度、TNM分期、淋巴结转移有关(均P<0.05).
结论: CHD5基因的低表达与胃癌的恶性程度及侵袭性关系密切, 提示其可能是胃癌发生、发展过程中的一个重要的抑癌基因.
引文著录: 游焜, 张谢夫, 赵春临, 刘涛, 郭大鹏. 抑癌基因CHD5在胃癌中的表达及临床意义. 世界华人消化杂志 2012; 20(34): 3317-3322
Revised: November 5, 2012
Accepted: November 15, 2012
Published online: December 8, 2012
AIM: To investigate the expression of chromodomain helicase DNA-binding protein 5 (CHD5) mRNA and protein in gastric cancer, and to investigate the correlation between CHD5 expression and the development and progression of gastric cancer.
METHODS: Reverse transcription-polymerase chain reaction and immunohistochemistry were used to detect the expression of CHD5 mRNA and protein in 63 cases of gastric cancer tissues and 63 matched tumor-adjacent gastric tissues. The relationship between CHD5 expression and clinico-pathologic characteristics of gastric cancer was analyzed.
RESULTS: The expression level of CHD5 mRNA in gastric cancer tissues was significantly lower than that in matched tumor-adjacent gastric tissues (0.06 ± 0.04 vs 0.34 ± 0.06, t = 59.204, P < 0.01). The expression of CHD5 mRNA was significantly associated with histologic differentiation, TNM stage, and lymph node metastasis (all P < 0.05). The positive rate of CHD5 expression in gastric cancer tissues was significantly lower than that in matched tumor-adjacent gastric tissues (36.5% vs 71.4%, P < 0.01). The expression of CHD5 protein was correlated with histologic differentiation, TNM stage, and lymph node metastasis (all P < 0.05).
CONCLUSION: Low expression of CHD5 mRNA and protein in gastric carcinoma is related with tumor malignancy and invasiveness, suggesting that the tumor suppressor gene CHD5 may play an important role in the tumorigenesis and progression of gastric cancer.
- Citation: You K, Zhang XF, Zhao CL, Liu T, Guo DP. Clinical significance of expression of CHD5 in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(34): 3317-3322
- URL: https://www.wjgnet.com/1009-3079/full/v20/i34/3317.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i34.3317
胃癌是最常见的消化系恶性肿瘤之一, 在我国乃至世界范围内都有很高的发病率和死亡率, 全国肿瘤登记地区统计的前10位恶性肿瘤中, 胃癌的发病率位于第2位(32.23/10万), 死亡率位于第3位(23.90/10万)[1]. 近年来, 虽然国内外学者对胃癌做了大量细致深入的研究, 但至今其发病机制仍未阐明. 在对肿瘤的研究中, 人们逐渐接受这样一个观点: 原癌基因的激活和抑癌基因的失活对其发生作用巨大. 2007年Bagchi等[2]运用染色体基因工程技术证明染色体质域解螺旋酶DNA结合蛋白5(chromodomain helicase DNA-binding protein 5, CHD5)是一种抑癌基因. 最近国外学者在对人类神经母细胞瘤、乳腺癌、肝癌、结肠癌等的研究中均证实了CHD5在肿瘤组织中出现了低表达或不表达, 揭示其具有肿瘤抑制作用. 然而国内外鲜有关于CHD5基因与胃癌发生相关性的报道. 本研究应用RT-PCR和免疫组织化学SP法分别检测63例胃癌组织及相应癌旁组织中CHD5 mRNA和蛋白的表达情况, 并探讨其与胃癌临床病理学参数之间的关系, 以期本研究结果能对胃癌的临床诊断和治疗提供参考.
收集2010-12/2012-02郑州大学第一附属医院胃肠外科手术切除的胃癌标本63例, 每例标本均采集癌组织和距肿瘤5 cm的癌旁胃组织. 所有检测标本均经病理学诊断证实. 患者知情同意且术前均未行放射治疗、化学治疗、生物治疗及中西医结合治疗. 标本离体后迅速置入-70 ℃冰箱保存备用. 63例患者中男34例、女29例; 年龄26-85岁, 中位年龄62岁. 肿瘤癌灶<5 cm 30例, ≥5 cm 33例. 胃癌组织按分化程度分为3组: 高分化组13例, 中分化组20例, 低分化组30例. 按美国癌症联合委员会(AJCC)胃癌TNM分期(2010年第7版)标准[3,4]: Ⅰ期7例, Ⅱ期16例, Ⅲ期27例, Ⅳ期13例. 淋巴结转移阳性37例, 阴性26例. 有远处转移20例, 无远处转移43例. PCR mix购自北京百泰克生物技术有限公司bioteke; TRIzol试剂购自美国Invitrogen公司; 琼脂糖购自西班牙Biowest公司; CHD5引物购自大连宝生物技术有限公司; β-actin引物购自大连宝生物技术有限公司; 逆转录试剂盒购自富酶泰斯生物技术有限公司Fermentas; 一抗购自Santa Cruz公司; 二抗试剂盒购自北京中杉金桥公司.
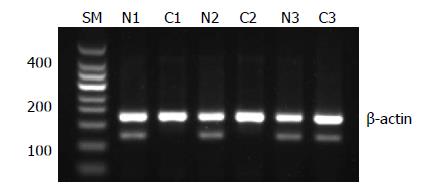
1.2.1 引物序列: 参考文献[8]设计β-actin扩增片段长度185 bp; CHD5上游引物: 5'-AGTTCCGTGTGAGGATGAAC-3', 下游引物: 5'-TCAAGGCTGACGTGTTCAAG-3', 扩增片段长度108 bp.
1.2.2 逆转录聚合酶链反应: 分别研磨组织, TRIzol提取总RNA. 以2 μL总RNA作为模板, 按逆转录试剂盒说明书进行反转录合成cDNA. 然后进行PCR扩增, 反应体系: cDNA 1 μL, PCR mix 9.5 μL, 上下游引物各1 μL, 双蒸水补足25 μL. CHD5引物序列: 上游引物: 5'-AGTTCCGTGTGAGGATGAAC-3', 下游引物: 5'-TCAAGGCTGACGTGTTCAAG-3', 产物长度108 bp; β-actin: 185 bp. 反应条件为: 首先95 ℃变性5 min后, 94 ℃变性30 s, 48 ℃退火30 s, 72 ℃延伸30 s, 共29次循环. 最后72 ℃延伸5 min, 至4 ℃完成反应. 2%琼脂糖凝胶电泳, 凝胶成像分析, 然后用Gelworkal D Intermediate软件分析各条带的光密度(A)值, 以β-actin为内参照, 以CHD5与β-actin A值之比为相互间进行比较的参数, 以正常组织参数的平均值作为标准, 低于此值为基因表达下调, 大于此值为过表达, 在此值范围内为正常表达, 未出现相应条带为表达缺失或表达极低. 用去离子水作阴性对照. 使用Quantity-one软件, 计算各个样本CHD5表达水平, 表达量的相对值(relative expression value) = CHD5扩增条带的灰度值/GAPDH基因扩增条带的灰度值.
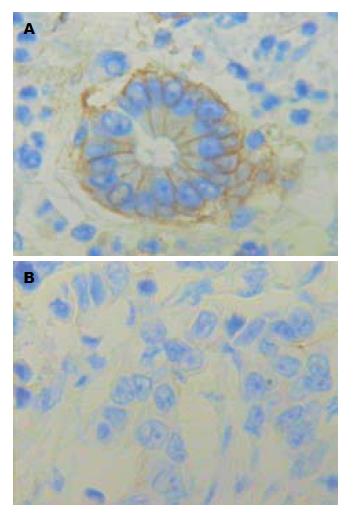
1.2.3 CHD5基因的蛋白表达: 所有标本均经中性福尔马林固定、常规脱水、包埋, 连续4 μm切片. 3%H2O2-甲醇阻断内源性过氧化物酶, 微波(750 W, 95 ℃, 5 min×2次)抗原修复, DAB显色, 苏木素复染. 每批染色均设阳性对照和阴性对照, 严格按SP试剂盒的说明进行染色. 染色判断标准[6]: 在显微镜下按显色程度肉眼评分: 弱染色为1分; 中等染色为2分; 强染色为3分. 在高倍镜下按阳性细胞所占百分比率计算评分: 阳性细胞数占10%-50%为2分; 50%-80%为3分; ≥80%为4分. 最后将肉眼一般评分与高倍镜下百分比率计算评分之和进行最终判断, 无论染色强度如何, 细胞阳性率<10%或<2分者为阴性(-); 2-3分为弱阳性(+); 4-7分为强阳性(++).
统计学处理 采用SPSS17.0统计软件包进行统计学处理, 对胃癌组织和癌旁组织中的CHD5 mRNA灰度值进行配对t检验. 相关性分析采用配对四格表的关联性分析, 对临床病理因素间的关系进行χ2检验, 以P<0.05作为差异有统计学意义的检验标准.
CHD5 mRNA在63例胃癌组织中的表达量相对值为0.06±0.04, 明显低于在癌旁组织中的表达相对值0.34±0.06, 经统计学分析发现, 差异有统计学意义(t = 59.204, P<0.01, 图1). 经统计学分析发现, CHD5 mRNA的表达与患者肿瘤分化程度、淋巴结转移与否及肿瘤TNM分期有关(均P<0.05), 而与患者性别、年龄、肿瘤大小、远处转移无关. 高、中、低分化的胃癌组织中CHD5 mRNA表达阳性率分别为: 84.6%、30.0%、26.7%, 差异有统计学意义(χ2 = 8.724, P = 0.003); 随着TNM分期的增加, 胃癌组织中的CHD5 mRNA表达阳性率呈下降趋势, Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期表达阳性率分别为: 71.4%、50.0%、37.0%、15.4%, 差异有统计学意义(χ2 = 6.524, P = 0.011); 淋巴结转移阴性的胃癌组织中的CHD5 mRNA表达阳性率(51.4%)明显高于淋巴结转移阳性者(23.1%), 差异有统计学意义(χ2 = 5.100, P = 0.024, 表1).
| 临床资料 | n | CHD5 mRNA表达数 | 表达阳性率(%) | χ2值 | P值 | |
| 表达 | 缺失 | |||||
| 男 | 34 | 11 | 23 | 32.4 | 1.618 | 0.198 |
| 女 | 29 | 14 | 15 | 48.3 | ||
| 年龄(岁) | ||||||
| <55 | 24 | 13 | 11 | 54.2 | 3.398 | 0.065 |
| ≥55 | 39 | 12 | 27 | 30.8 | ||
| 肿瘤大小(cm) | ||||||
| <5 | 30 | 10 | 20 | 33.3 | 0.965 | 0.326 |
| ≥5 | 33 | 15 | 18 | 45.5 | ||
| TNM分期 | ||||||
| Ⅰ期 | 7 | 5 | 2 | 71.4 | 6.524 | 0.011 |
| Ⅱ期 | 16 | 8 | 8 | 50.0 | ||
| Ⅲ期 | 27 | 10 | 17 | 37.0 | ||
| Ⅳ期 | 13 | 2 | 11 | 15.4 | ||
| 病理分级 | ||||||
| 高分化 | 13 | 11 | 2 | 84.6 | 8.724 | 0.003 |
| 中分化 | 20 | 6 | 14 | 30.0 | ||
| 低分化 | 30 | 8 | 22 | 26.7 | ||
| 淋巴结转移 | ||||||
| 阴性 | 37 | 19 | 18 | 51.4 | 5.100 | 0.024 |
| 阳性 | 26 | 6 | 20 | 23.1 | ||
| 远处转移 | ||||||
| 有 | 20 | 9 | 11 | 45.0 | 0.346 | 0.556 |
| 无 | 43 | 16 | 27 | 37.2 | ||
在胃癌相应的癌旁组织中CHD5基因的蛋白出现阳性表达, 其阳性表达率为71.4%; 而在胃癌组织中其阳性表达率为36.5%, 并且多为弱阳性表达(图2). 经统计学分析发现, CHD5蛋白的表达与患者肿瘤分化程度、淋巴结转移与否及肿瘤TNM分期有关(均P<0.05), 而与患者性别、年龄、肿瘤大小、远处转移无关. 肿瘤细胞异型性越高, 其胃癌组织中CHD5蛋白表达阳性率越低, 高、中、低分化胃癌组织中的CHD5蛋白表达阳性率分别为: 76.9%、30.0%、23.3%, 差异有统计学意义(χ2 = 8.236, P = 0.004); 结果显示随着TNM分期的增加, 胃癌组织中CHD5蛋白的表达阳性率也呈现下降趋势, Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期表达阳性率分别为: 85.7%、37.5%、37.0%、23.1%, 差异有统计学意义(χ2 = 4.447, P = 0.035); 淋巴结转移阴性的胃癌组织中的CHD5蛋白表达阳性率(48.6%)明显高于淋巴结转移阳性者(19.2%), 差异有统计学意义(χ2 = 5.701, P = 0.017, 表2).
| 临床资料 | n | CHD5蛋白表达数 | 阳性率(%) | χ2值 | P值 | |
| + | - | |||||
| 性别 | ||||||
| 男 | 34 | 14 | 20 | 41.2 | 0.695 | 0.405 |
| 女 | 29 | 9 | 20 | 31.0 | ||
| 年龄(岁) | ||||||
| <55 | 24 | 10 | 14 | 41.7 | 0.445 | 0.505 |
| ≥55 | 39 | 13 | 26 | 33.3 | ||
| 肿瘤大小(cm) | ||||||
| <5 | 30 | 8 | 22 | 26.7 | 2.393 | 0.122 |
| ≥5 | 33 | 15 | 18 | 45.5 | ||
| TNM分期 | ||||||
| Ⅰ期 | 7 | 6 | 1 | 85.7 | 4.447 | 0.035 |
| Ⅱ期 | 16 | 6 | 10 | 37.5 | ||
| Ⅲ期 | 27 | 10 | 17 | 37.0 | ||
| Ⅳ期 | 13 | 3 | 10 | 23.1 | ||
| 病理分级 | ||||||
| 高分化 | 13 | 10 | 3 | 76.9 | 8.236 | 0.004 |
| 中分化 | 20 | 6 | 14 | 30.0 | ||
| 低分化 | 30 | 7 | 23 | 23.3 | ||
| 淋巴结转移 | ||||||
| 阴性 | 37 | 18 | 19 | 48.6 | 5.701 | 0.017 |
| 阳性 | 26 | 5 | 21 | 19.2 | ||
| 远处转移 | ||||||
| 有 | 20 | 7 | 13 | 35.0 | 0.029 | 0.865 |
| 无 | 43 | 16 | 27 | 37.2 | ||
胃癌是全球范围内最常见的恶性肿瘤之一, 为东南亚国家中最常见的癌症类型[7,8]. 近年来, 在对胃癌表观遗传学机制的研究中, 证实了多个抑癌基因的失活与胃癌发生发展存在密切关系, 这说明抑癌基因的表达沉默是一种主要的分子生物学改变[9-12]. 先前已有研究发现: 抑癌基因的大型基因组片段内出现了点突变或缺失, 大约30%的胃癌患者具有胃癌个体遗传倾向[13,14]. 然而, 大多数胃癌患者的发病机制仍不清楚.
众所周知, 传统上将DNA和染色质结合的蛋白分为2类: 染色体非组蛋白和组蛋白. 在DNA复制、转录和修复过程中, 染色体非组蛋白和染色体组蛋白都起到了很重要的作用. 组蛋白是一组高度保守的DNA结合蛋白, 其经过翻译、修饰后又形成组蛋白码, 在组蛋白码的介导下完成DNA的修饰和染色体的重塑[15-18]. 而多数组蛋白码是由染色体非组蛋白参与形成、维持和翻译的. 研究证实, 在组蛋白码的翻译过程中, 染色体非组蛋白通过重塑染色体复合物发挥重要作用; 不论染色体组蛋白还是非组蛋白在基因表达的调控上都发挥着重要作用, 所以2者表达的异常将导致人类多种疾病(例如癌症)的进展[19-23].
1977年Brodeur等[24]在对神经母细胞瘤的研究中首次报道了人类1号染色体短臂基因的表达缺失. 随后, 引起了大量针对人类1号染色体短臂基因的研究, 并发现很多人类恶性肿瘤组织中经常发生1号染色体短臂3区6带(1p36)的表达缺失. Bagchi等[2]构建了1p36增益和缺失小鼠模型, 证实CHD5基因位于1p36, 是肿瘤抑制途径中的一个重要抑癌基因. CHD5蛋白是一组主要的染色体非组蛋白, 其属于SWI2/SNF2相关的ATP酶超家族, 该家族蛋白因蛋白质从氨基端开始依次含有染色质结构域(chromodomains)、类SWI2/SNF2 ATP酶/解螺旋酶域(SWI2/SNF2-like ATPase/helicase)和DNA结合域(DNA binding domain)而得名[25]. 通过调节染色体结构, CHD5可以促进p19arf基因的表达, 后者可以维持P53的表达稳定性, 有超过50%的人类癌症与P53的表达缺失有关, 提示CHD5基因可能是通过P19arf/P53通路调控肿瘤的发生发展[2].
近年来, 大量的实验研究证实CHD5在神经母细胞瘤、卵巢癌、结肠癌和喉鳞状细胞癌中出现了低表达或者表达缺失, 提示CHD5在肿瘤发生的过程中起到了重要的作用[26-29]. 唐莹莹等[30]在研究CHD5 mRNA的表达与肝细胞癌的关系时发现, 在肝癌组织及相应癌旁组织中CHD5 mRNA的表达缺失率分别为53.3%(16/30)和13.3%(4/30). 陈香宇等[31]研究了CHD5基因的表观遗传学改变与食管癌发生的关系, 结果发现在其研究的食管癌组织及相应癌旁组织中CHD5基因启动子区甲基化的发生率分别为69%(50/72)和32%(23/72), 并提出CHD5基因甲基化有可能作为食管癌诊断的一个标志物. Wang等[5]发现在其研究的所有7种胃癌细胞株(AGS, Kato Ⅲ, MKN28, MKN45, SNU1, SNU16和NCI-N87)中都出现了CHD5的表达下调, 并提出在胃癌细胞中, CHD5基因常因为启动子区的高度甲基化而出现表达下调. CHD5可以导致体外培养的胃癌细胞出现生长抑制, 说明CHD5是胃癌肿瘤发生和生长过程中的抑癌基因.
本研究结果表明, 胃癌组织中CHD5基因mRNA和蛋白的表达较癌旁胃组织均明显下降, 经统计学分析, 差异有统计学意义. 我们比较CHD5 mRNA与蛋白表达的相关性发现, 63例胃癌组织中, CHD5基因mRNA的表达缺失大多伴随CHD5蛋白的表达缺失, 2者具有相关性. 统计分析证实CHD5 mRNA表达与胃癌组织的分化程度、TNM分期和淋巴结转移有关, 在胃癌组织中CHD5基因的表达与肿瘤的分化程度、TNM分期和淋巴结转移有关, 提示其可能与胃癌的肿瘤学进展关系密切. CHD5基因检测及蛋白测定有可能作为胃癌诊断、治疗和临床预后评价的参考指标. 值得一提的是, 在部分胃癌组织中, CHD5 mRNA也有表达, 考虑其与CHD5的表观遗传学机制、肿瘤组织表达特异性或肿瘤取材部位有关, 本课题组将在以后的研究中继续探究.
本研究发现, 与相应癌旁组织相比, CHD5 mRNA和蛋白在胃癌组织中出现了明显低表达. CHD5出现的低表达与胃癌的恶性程度及侵袭性关系密切, 提示其可能是胃癌发生、发展过程中的一个重要抑癌基因.
胃癌是最常见的消化系恶性肿瘤之一, 在全国肿瘤登记地区统计的前10位恶性肿瘤中, 胃癌的发病率位于第2位, 死亡率位于第3位. 因此探讨胃癌发生发展的分子机制, 为临床胃癌的诊治提供分子依据就尤为重要.
刘炳亚, 研究员, 上海交通大学医学院附属瑞金医院上海消化外科研究所
目前针对染色体质域解螺旋酶DNA结合蛋白5(CHD5)基因与胃癌的肿瘤学机制的相关研究在国内外鲜有报道.
近年来, 大量的实验研究证实CHD5在神经母细胞瘤、卵巢癌、结肠癌和喉鳞状细胞癌中出现了低表达或者表达缺失, 提示CHD5在肿瘤发生的过程中起重要的作用.
从CHD5的基因水平和蛋白水平检测其在胃癌组织及相应癌旁组织中的表达情况, 尝试证明CHD5基因与胃癌发生发展的关系, 为胃癌的早期诊断、早期治疗以及预后预测提供新的参考指标.
本研究采用RT-PCR和免疫组织化学检测63例胃癌组织及其对应癌旁组织中CDH5的表达, 并分析其与胃癌患者临床病理参数之间的关系.
染色体质域解螺旋酶DNA结合蛋白5(CHD5): 一组主要的染色体非组蛋白, 其属于SWI2/SNF2相关的ATP酶超家族, 是近年来现的一个重要的抑癌基因.
本文采用免疫组织化学和RT-PCR检测63例胃癌组织及其对应癌旁组织中CDH5的表达情况, 并分析其表达与胃癌患者临床病理参数的关系, 具有一定的参考价值.
编辑: 翟欢欢 电编:闫晋利
| 2. | Bagchi A, Papazoglu C, Wu Y, Capurso D, Brodt M, Francis D, Bredel M, Vogel H, Mills AA. CHD5 is a tumor suppressor at human 1p36. Cell. 2007;128:459-475. [PubMed] [DOI] |
| 3. | Washington K. 7th edition of the AJCC cancer staging manual: stomach. Ann Surg Oncol. 2010;17:3077-3079. [PubMed] |
| 4. | Santiago JM, Sasako M, Osorio J. [TNM-7th edition 2009 (UICC/AJCC) and Japanese Classification 2010 in Gastric Cancer. Towards simplicity and standardisation in the management of gastric cancer]. Cir Esp. 2011;89:275-281. [PubMed] [DOI] |
| 5. | Wang X, Lau KK, So LK, Lam YW. CHD5 is down-regulated through promoter hypermethylation in gastric cancer. J Biomed Sci. 2009;16:95. [PubMed] [DOI] |
| 6. | 罗 登, 赵 公芳, 路 明亮, 黄 华, 常 江, 郑 梦瑶. CHD5与KLF5蛋白在胃癌组织中的表达及其与预后的关系. 世界华人消化杂志. 2011;19:3603-3609. [DOI] |
| 7. | Wu PY, Zhang Z, Wang JM, Guo WW, Xiao N, He Q, Wang YP, Fan YM. Germline promoter hypermethylation of tumor suppressor genes in gastric cancer. World J Gastroenterol. 2012;18:70-78. [PubMed] [DOI] |
| 9. | Cheng YY, Jin H, Liu X, Siu JM, Wong YP, Ng EK, Yu J, Leung WK, Sung JJ, Chan FK. Fibulin 1 is downregulated through promoter hypermethylation in gastric cancer. Br J Cancer. 2008;99:2083-2087. [PubMed] [DOI] |
| 10. | Vogiatzi P, Vindigni C, Roviello F, Renieri A, Giordano A. Deciphering the underlying genetic and epigenetic events leading to gastric carcinogenesis. J Cell Physiol. 2007;211:287-295. [PubMed] [DOI] |
| 11. | Yu J, Tao Q, Cheung KF, Jin H, Poon FF, Wang X, Li H, Cheng YY, Röcken C, Ebert MP. Epigenetic identification of ubiquitin carboxyl-terminal hydrolase L1 as a functional tumor suppressor and biomarker for hepatocellular carcinoma and other digestive tumors. Hepatology. 2008;48:508-518. [PubMed] [DOI] |
| 12. | Tamura G. Promoter methylation status of tumor suppressor and tumor-related genes in neoplastic and non-neoplastic gastric epithelia. Histol Histopathol. 2004;19:221-228. [PubMed] |
| 13. | Fan Y, Liu X, Zhang H, Dai J, Zhang X, Zhu M, Gao X, Wang Y. Variations in exon 7 of the MSH2 gene and susceptibility to gastrointestinal cancer in a Chinese population. Cancer Genet Cytogenet. 2006;170:121-128. [PubMed] [DOI] |
| 14. | Zhang Y, Liu X, Fan Y, Ding J, Xu A, Zhou X, Hu X, Zhu M, Zhang X, Li S. Germline mutations and polymorphic variants in MMR, E-cadherin and MYH genes associated with familial gastric cancer in Jiangsu of China. Int J Cancer. 2006;119:2592-2596. [PubMed] [DOI] |
| 15. | Escargueil AE, Soares DG, Salvador M, Larsen AK, Henriques JA. What histone code for DNA repair? Mutat Res. 2008;658:259-270. [PubMed] [DOI] |
| 16. | Razin SV, Iarovaia OV, Sjakste N, Sjakste T, Bagdoniene L, Rynditch AV, Eivazova ER, Lipinski M, Vassetzky YS. Chromatin domains and regulation of transcription. J Mol Biol. 2007;369:597-607. [PubMed] [DOI] |
| 17. | Sasaki K, Yoshida M. [Histone modification enzymes]. Tanpakushitsu Kakusan Koso. 2006;51:2069-2075. [PubMed] |
| 18. | van Attikum H, Gasser SM. The histone code at DNA breaks: a guide to repair? Nat Rev Mol Cell Biol. 2005;6:757-765. [PubMed] [DOI] |
| 19. | Pallos J, Bodai L, Lukacsovich T, Purcell JM, Steffan JS, Thompson LM, Marsh JL. Inhibition of specific HDACs and sirtuins suppresses pathogenesis in a Drosophila model of Huntington's disease. Hum Mol Genet. 2008;17:3767-3775. [PubMed] [DOI] |
| 20. | Wegener D, Deubzer HE, Oehme I, Milde T, Hildmann C, Schwienhorst A, Witt O. HKI 46F08, a novel potent histone deacetylase inhibitor, exhibits antitumoral activity against embryonic childhood cancer cells. Anticancer Drugs. 2008;19:849-857. [PubMed] [DOI] |
| 21. | Zhou Q, Shaw PG, Davidson NE. Inhibition of histone deacetylase suppresses EGF signaling pathways by destabilizing EGFR mRNA in ER-negative human breast cancer cells. Breast Cancer Res Treat. 2009;117:443-451. [PubMed] [DOI] |
| 22. | Glaros S, Cirrincione GM, Palanca A, Metzger D, Reisman D. Targeted knockout of BRG1 potentiates lung cancer development. Cancer Res. 2008;68:3689-3696. [PubMed] [DOI] |
| 23. | Medina PP, Sanchez-Cespedes M. Involvement of the chromatin-remodeling factor BRG1/SMARCA4 in human cancer. Epigenetics. 2008;3:64-68. [PubMed] [DOI] |
| 24. | Brodeur GM, Sekhon G, Goldstein MN. Chromosomal aberrations in human neuroblastomas. Cancer. 1977;40:2256-2263. [PubMed] [DOI] |
| 25. | Thompson PM, Gotoh T, Kok M, White PS, Brodeur GM. CHD5, a new member of the chromodomain gene family, is preferentially expressed in the nervous system. Oncogene. 2003;22:1002-1011. [PubMed] [DOI] |
| 26. | Fujita T, Igarashi J, Okawa ER, Gotoh T, Manne J, Kolla V, Kim J, Zhao H, Pawel BR, London WB. CHD5, a tumor suppressor gene deleted from 1p36.31 in neuroblastomas. J Natl Cancer Inst. 2008;100:940-949. [PubMed] [DOI] |
| 27. | Wong RR, Chan LK, Tsang TP, Lee CW, Cheung TH, Yim SF, Siu NS, Lee SN, Yu MY, Chim SS. CHD5 Downregulation Associated with Poor Prognosis in Epithelial Ovarian Cancer. Gynecol Obstet Invest. 2011;72:203-207. [PubMed] [DOI] |
| 28. | Cai C, Ashktorab H, Pang X, Zhao Y, Sha W, Liu Y, Gu X. MicroRNA-211 expression promotes colorectal cancer cell growth in vitro and in vivo by targeting tumor suppressor CHD5. PLoS One. 2012;7:e29750. [PubMed] [DOI] |
| 29. | Wang J, Chen H, Fu S, Xu ZM, Sun KL, Fu WN. The involvement of CHD5 hypermethylation in laryngeal squamous cell carcinoma. Oral Oncol. 2011;47:601-608. [PubMed] [DOI] |
| 30. | 唐 莹莹, 田 德安, 晏 维, 夏 丽敏, 张 全乐, 王 伟. 一种潜在的抑癌基因-CHD5参与肝癌的发生和发展. 胃肠病学和肝病学杂志. 2008;12:994-996. |