修回日期: 2012-11-16
接受日期: 2012-12-02
在线出版日期: 2012-12-08
目的: 观察红花注射液(safflower solution, SS)对2, 4, 6-三硝基苯磺酸(2, 4, 6-trinitrobenzene sulfonic acid, TNBS)诱导的大鼠溃疡性结肠炎(ulcerative colitis, UC)的疗效及其对大鼠结肠组织血管内皮生长因子(vascular endothelial growth factor, VEGF)和碱性成纤维细胞生长因子(basal fibroblast growth factor, bFGF)表达的影响.
方法: 将30只Wistar大鼠随机分为正常对照组、模型组、红花组, 每组10只. 用TNBS灌肠法复制大鼠UC模型, 红花组同时给予腹腔注射SS 2 mL/(kg·d)干预治疗, 模型组与对照组给予等量生理盐水. 造模10 d后, 收集标本. 对大鼠行疾病活动指数(disease activity index, DAI)、结肠大体形态评分及组织学损伤评分, 分别用免疫组织化学法及实时荧光定量PCR(real time-polymerase chain reaction, RT-PCR)技术检测大鼠结肠黏膜中VEGF、bFGF的表达.
结果: 与正常对照组相比, 红花组、模型组DAI评分, 结肠大体形态损伤评分和组织学损伤评分均显著增高(P<0.01); 而与模型组相比, 红花组能显著改善UC症状(P<0.05). 模型组大鼠VEGF、bFGF表达水平明显高于正常组(P<0.01); 与模型组相比, 红花组VEGF表达显著降低(P<0.05).
结论: SS能够显著改善UC大鼠结肠损伤及炎症反应, 这可能与其有效下调VEGF的表达, 抑制病理性血管生成有关.
引文著录: 原皓, 李学兴, 王鹤鸣, 原子英, 赵雪曼, 韩雪, 董文华. 红花注射液对溃疡性结肠炎大鼠VEGF和bFGF表达的影响. 世界华人消化杂志 2012; 20(34): 3299-3304
Revised: November 16, 2012
Accepted: December 2, 2012
Published online: December 8, 2012
AIM: To evaluate the therapeutic effect of safflower solution on 2,4,6-trinitrobenzene sulfonic acid (TNBS)-induced ulcerative colitis in rats and to explore the underlying mechanisms by observing the expression of vascular endothelial growth factor (VEGF) and basal fibroblast growth factor (bFGF).
METHODS: Thirty Wistar rats were randomly divided into normal control group, model group and safflower group. Ulcerative colitis was induced in the safflower group and model group with TNBS by enema. Rats of the safflower group were intraperitoneally injected with safflower solution. After ten days, all rats were killed. Disease activity index (DAI), colon macroscopic damage score (CMDS) and histological damage score were evaluated. Pathological changes in the colonic mucosa were examined by HE staining. The expression of VEGF and bFGF in the colonic mucosa was detected by real time-polymerase chain reaction (RT-PCR) and immunohistochemistry (IHC).
RESULTS: Compared to normal controls, the DAI, CMDS and histological damage scores in model rats were significantly increased (all P < 0.01). Compared to the model group, the above parameters were significantly improved in the safflower group (all P < 0.05). Compared to normal controls, the expression levels of VEGF and bFGF in model rats were increased significantly (all P < 0.01). Treatment with safflower solution significantly decreased the expression levels of VEGF mRNA and protein in ulcerative colitis (both P < 0.05).
CONCLUSION: Treatment with safflower solution could reduce inflammatory injury in a rat model of ulcerative colitis possibly by reducing the expression of VEGF and inhibiting pathologic angiogenesis in the colonic mucosa.
- Citation: Yuan H, Li XX, Wang HM, Yuan ZY, Zhao XM, Han X, Dong WH. Effect of treatment with safflower solution on expression of VEGF and bFGF in ulcerative colitis in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(34): 3299-3304
- URL: https://www.wjgnet.com/1009-3079/full/v20/i34/3299.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i34.3299
溃疡性结肠炎(ulcerative colitis, UC)的病因及发病机制尚未完全阐明, 目前认为与遗传、环境及免疫等多因素有关[1,2]. 近年来, 有文献研究报道血管生成在其病理机制及黏膜修复中起重要作用[3-5]. 血管内皮生长因子(vascular endothelial growth factor, VEGF)是目前认为作用最强、特异度最高的促血管生成因子, 能够促进组织修复、诱导毛细血管再生[6]. 碱性成纤维细胞生长因子(basal fibroblast growth factor, bFGF)是由内皮细胞及平滑肌细胞合成, 有强烈的促组织修复及血管生成作用[7], 国外已有研究证明, VEGF在UC病理机制中起重要作用, 而bFGF可以促进UC黏膜修复及愈合[8]. 中药红花有活血化瘀, 消肿止痛的功效, 目前主要用于心脑血管疾病的治疗, 疗效好, 不良反应较少[9,10], 尚无应用于UC研究的报道. 本实验旨在观察红花注射液(safflower solution, SS)对UC大鼠的疗效, 并通过其对大鼠结肠VEGF及bFGF表达的影响, 从影响血管生成方面研究其可能的作用机制.
SS主要成分为红花黄色素、红花甙、红花红色素等, 由亚宝药业集团股份有限公司提供; 2, 4, 6-三硝基苯磺酸(TNBS, 美国Sigma公司); 兔抗大鼠VEGF、bFGF单克隆抗体(北京博奥森生物技术公司); 浓缩型DAB显色剂、免疫组织化学PV超敏试剂盒(PV-6001)购自北京中杉金桥生物有限公司; TRIzol试剂盒(上海生工生物工程技术服务有限公司); cDNA第一链合成试剂盒、SYBR GreenⅠ嵌合荧光PCR试剂盒(Takara公司). 健康♂Wistar大鼠30只, 体质量为200 g±10 g, 由山东中医药大学动物中心提供, 随机分为正常对照组、模型组和红花治疗组, 每组各10只.
1.2.1 造模与干预: 参照文献所述[11], 采用TNBS灌肠法制作UC大鼠模型. 大鼠禁食24 h后, 用10%水合氯醛4.5 mL/kg腹腔注射麻醉, TNBS与无水乙醇以1:1比例混匀, 根据大鼠禁食后体质量, 按照50 mg/kg计算出红花组和模型组每只大鼠所需的混合药液用量, 用聚乙烯导管经肛门缓慢插入结肠约8 cm, 将药液注入肠腔, 正常对照组灌注等量生理盐水. 红花组自造模当天起, 以400 mg/(kg·d)为标准, 计算出每只大鼠所需干预药量, 并用生理盐水稀释至2 mL, 每天腹腔注射; 模型组及正常对照组每天腹腔注射2 mL生理盐水, 总共10 d.
1.2.2 标本采集: 造模10 d后, 观察各组大鼠的一般情况, 用10%水合氯醛麻醉动物, 称取质量后处死, 迅速剖取距肛门约7-8 cm结肠, 沿肠系膜纵轴切开, 在冷生理盐水中洗净, 取一部分用4%多聚甲醛固定, 用于HE染色及免疫组织化学检测, 另一部分在RNa-Free0.9%NS中洗净后, 先保存于液氮罐中, 再尽快转存于-80 ℃冰箱中, 用于实时荧光定量PCR检测.
1.2.3 结肠炎症评价: 采用疾病活动指数(disease activity index, DAI)、结肠大体形态损伤评分及组织学损伤评分来评价结肠炎症. (1)DAI评分: 造模10 d后, 综合大鼠体质量下降百分率(体质量不变为0, 1-5%为1分, 6%-10%为2分, 11%-20%为3分, >20%为4分), 大便形状(正常为0, 大便松散为2分, 腹泻为4分)与大便带血情况(正常为0分, 隐血阳性为2分, 显性出血为4分)进行积分[12]; (2)大体形态损伤评分: 0分, 黏膜无损伤; 1分, 局部充血水肿, 但无溃疡; 2分, 局部溃疡但无明显水肿或肠壁增厚; 3分, 溃疡伴1个部位炎症; 4分, 2个或更多部位溃疡及炎症, 但溃疡大小<1 cm; 5分, 沿结肠纵轴超过1 cm的病损; 6-10分, 沿结肠纵轴超过2 cm的病损, 每增多1 cm积分增加1分[13]; (3)组织学损伤评分: 选10个视野(×100)平均评分. 评分标准: 0分, 正常结肠黏膜; 1分, 隐窝缺损1/3时; 2分, 隐窝缺损2/3; 3分, 固有层覆盖单层上皮伴轻度炎性细胞浸润; 4分, 黏膜糜烂、溃疡伴显著炎性细胞浸润.
1.2.4 免疫组织化学法检测VEGF、bFGF蛋白的表达: 按照试剂说明进行操作, 结果判断: VEGF阳性表达为细胞质呈棕黄色, bFGF阳性表达为细胞质或/和细胞核呈棕黄色. 阳性表达细胞计数标准: 每张切片随机选取5个高倍视野(×400), 分别计数1 000个细胞, 计算阳性细胞百分比.
1.2.5 RT-PCR检测VEGF、bFGF mRNA的表达: 按照TRIzol试剂盒说明书提取总RNA后, 立即进行电泳, 鉴定RNA的完整性, 并于紫外分光光度计分析RNA纯度. 按照cDNA第一链合成试剂盒说明书得到cDNA. 按SYBR GreenⅠ嵌合荧光PCR试剂盒说明书将cDNA进行扩增. 以GAPDH为内参照, 其上游引物为GGCACAGTCAAGGCTGAGAATG, 下游引物为ATGGTGGTGAAGACGCCAGTA. VEGF上游引物为TCACCCTGTTCTGCTTTCTCAT, 下游引物为GAGTCCCTTTTTCTGTGACCTG; bFGF上游引物为TCCAAGCAGAAGAGAGAGGAGT, 下游引物为AGGCGTTCAAAGAAGAAACACT. 根据荧光定量PCR仪显示的CT值通过2-△△Ct方法分析各组相对基因表达差异.
统计学处理 数据用mean±SD表示, 用SPSS17.0软件进行统计分析, 对数据行单因素方差分析(one-way analysis of variance, one-way ANOVA), 再用SNK-q检验进行组间比较. P<0.05为差异有统计学意义.
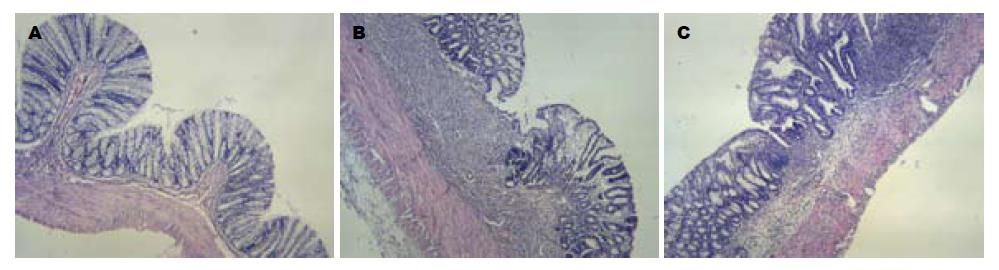
模型组与红花组UC大鼠体质量减轻, 轻者出现稀便, 重者可见黏液脓血便, 肉眼观察肠壁明显增厚, 黏膜充血、水肿, 有节段性环周溃疡形成, 溃疡表面附有黑褐色膜状坏死物, 光镜下见黏膜层大片缺失、脱落, 腺体破坏, 杯状细胞减少, 大量炎性细胞浸润, 主要为中性粒细胞和少量淋巴细胞, 局部见肉芽组织形成. 与正常对照组相比, 大鼠DAI评分、结肠大体形态损伤评分及组织学损伤评分显著升高(P<0.01). 而与模型组相比, 红花组体质量增加, 大便性状明显改善, 肠壁黏膜见不同程度的点片状或节段性充血、水肿, 糜烂或溃疡形成的严重程度明显减轻, 光镜下见上皮及溃疡得到不同程度修复, 间质水肿减轻, 上述观察指标显著降低(P<0.05, 表1, 图1).
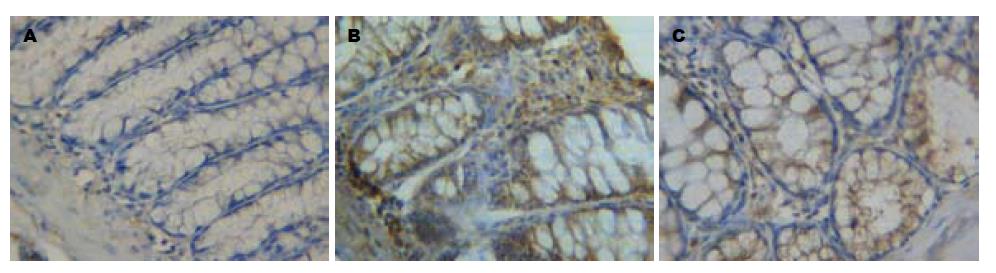
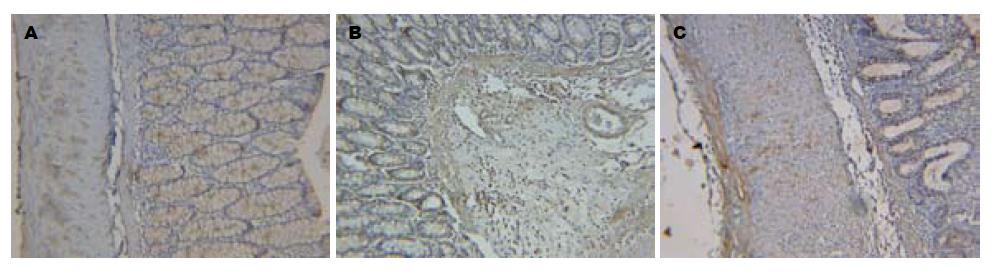
模型组与红花组大鼠结肠黏膜上皮及固有层中均可见VEGF阳性表达, 较正常组明显升高, 而红花组较模型组相比, VEGF蛋白表达显著降低(P<0.05, 表2, 图2). 各组大鼠结肠黏膜固有层的内皮细胞和平滑肌细胞及胞外基质中、黏膜下层的血管内皮细胞中均可见bFGF阳性表达, 其中模型组与红花组较对照组明显升高, 红花组在肉芽组织的血管内皮细胞、成纤维细胞及胞外基质中可见bFGF阳性颗粒, 但与模型组无显著差异(P>0.05, 表2, 图3).
提取RNA电泳示RNA完整性好. 根据紫外分光光度计显示的吸光度值, 求得A260/280比值在1.82-1.98之间, 说明RNA纯度较高. VEGF mRNA、bFGF mRNA相对表达结果见表2.
VEGF早期亦称作血管通透因子, 是血管内皮细胞特异性的肝素结合生长因子, 可在体内诱导血管新生, 能直接作用于血管内皮细胞促进血管内皮细胞增殖, 增加血管通透性[14,15]. 近年来, 国外许多研究发现VEGF在UC中可诱发病理性血管生成, 增加微血管密度, 导致血管收缩、微血栓形成, 同时提高血管通透性, 加重炎症细胞浸润, 在UC发病机制中起重要作用[16-19]. Tolstanova等[20]在大鼠动物模型中肌肉注射抗VEGF抗体治疗后, 可以明显减轻结肠黏膜损伤, 降低血管渗透性, 减轻炎症细胞浸润, 直接证明了VEGF在UC发病中的致病作用.
bFGF具有强烈的血管生成作用[21]. 在体外能刺激细胞增殖、迁移, 诱导纤溶酶原激活物及胶原酶活性, 是与肝素有高亲和力的细胞促分裂原[22,23]. 目前已有大量研究发现b-FGF可以促进UC黏膜修复, 减轻炎症反应, 并已有一些研究将bFGF应用于亚临床实验性治疗, 取得了一定的效果[24,25]. 因此调节血管生成及抗血管生成成为近几年研究UC的一个热点, Tolstanova等[26]在动物模型中通过抗血管生成治疗UC取得了较好的成果.
红花是传统活血化瘀中药, 可以抑制血栓形成, 对抗凝血, 对缺血再灌注有保护作用[27-29], 而且能够显著改善血液循环, 临床上还用于治疗血栓性疾病[30], 也用于妇科绝经后的治疗[31]. 红花还具有抑制血管内皮细胞过度增殖, 稳定血管内膜的功效. 在本实验中, 模型组大鼠结肠炎症损伤明显, VEGF与bFGF表达较正常组明显升高, 反映为免疫组织化学染色(immunohistochemistry, IHC)升高和相对mRNA表达增加. 用SS对UC大鼠进行干预后, 实验组大鼠症状好转, 病理结果示炎性损伤明显减轻, VEGF蛋白及mRNA表达较模型组明显下降, 但与模型组相比, bFGF表达差异并无统计学意义. 因此, 我们认为, SS通过下调VEGF的表达, 保护血管内皮细胞, 降低血管通透性, 进而抑制病理性血管生成, 减轻UC的炎性损伤, 促进黏膜修复.
目前调节血管生成在UC的病理机制及治疗方面提供了新的思路, 本实验通过观察SS对实验性UC大鼠VEGF及FGF表达的影响, 探讨其对UC中血管生成的影响, 并为其应用于UC的治疗提供了理论依据.
红花注射液(SS)具有改善血液循环、抗凝、抗炎等药理作用, 目前临床上主要用于心血管疾病的治疗, 探讨其作用于溃疡性结肠炎(UC)方面的报道较少.
李瑜元, 教授, 广州市第一人民医院内科
UC的发病机制尚不明确, 病理表现为慢性非特异性炎症反应. 近年来, 有研究发现病理性血管生成在UC的病理机制中起重要作用, 调节UC血管生成逐渐成为研究的热点.
将活血化瘀的SS用于UC的治疗并观察其对血管内皮生长因子(VEGF)及bFGF表达的影响, 从调节血管生成方面初步探讨其治疗机制.
研究发现, SS对大鼠UC有显著的疗效, 能明显降低VEGF的表达, 改善炎症反应, 将其用于治疗UC值得进一步研究.
血管生成: 从已有的毛细血管或毛细血管后静脉发展而形成新的血管,主要包括: 激活期血管基底膜降解; 血管内皮细胞的激活、增殖、迁移; 重建形成新的血管和血管网, 是一个涉及多种细胞的多种分子的复杂过程. 血管形成是促血管形成因子和抑制因子协调作用的复杂过程, 正常情况下2者处于平衡状态, 一旦此平衡打破就会激活血管系统, 使血管生成过度或抑制血管系统使血管退化.
文章设计合理, 方法较好, 显示中药红花干预疗效显著, 结果新, 为其治疗UC提供了一定的理论依据.
编辑: 田滢 电编:闫晋利
| 1. | Suzuki A, Sugimura K, Ohtsuka K, Hasegawa K, Suzuki K, Ishizuka K, Mochizuki T, Honma T, Narisawa R, Asakura H. Fas/Fas ligand expression and characteristics of primed CD45RO+ T cells in the inflamed mucosa of ulcerative colitis. Scand J Gastroenterol. 2000;35:1278-1283. [PubMed] [DOI] |
| 2. | Hisamatsu T, Kanai T, Mikami Y, Yoneno K, Matsuoka K, Hibi T. Immune aspects of the pathogenesis of inflammatory bowel disease. Pharmacol Ther. 2012; Oct 26. [Epub ahead of print]. [PubMed] [DOI] |
| 3. | Szabo S, Deng X, Tolstanova G, Khomenko T, Paunovic B, Chen L, Jadus M, Sandor Z. Angiogenic and anti-angiogenic therapy for gastrointestinal ulcers: new challenges for rational therapeutic predictions and drug design. Curr Pharm Des. 2011;17:1633-1642. [PubMed] [DOI] |
| 4. | Rutella S, Fiorino G, Vetrano S, Correale C, Spinelli A, Pagano N, Arena V, Maggiano N, Repici A, Malesci A. Infliximab therapy inhibits inflammation-induced angiogenesis in the mucosa of patients with Crohn's disease. Am J Gastroenterol. 2011;106:762-770. [PubMed] [DOI] |
| 5. | Deng X, Tolstanova G, Khomenko T, Chen L, Tarnawski A, Szabo S, Sandor Z. Mesalamine restores angiogenic balance in experimental ulcerative colitis by reducing expression of endostatin and angiostatin: novel molecular mechanism for therapeutic action of mesalamine. J Pharmacol Exp Ther. 2009;331:1071-1078. [PubMed] [DOI] |
| 6. | Bianchi E, Scarinci F, Grande C, Plateroti R, Plateroti P, Plateroti AM, Fumagalli L, Capozzi P, Feher J, Artico M. Immunohistochemical profile of VEGF, TGF-β and PGE2 in human pterygium and normal conjunctiva: experimental study and review of the literature. Int J Immunopathol Pharmacol. 2012;25:607-615. [PubMed] |
| 7. | Sun D, Liu Y, Yu Q, Zhou Y, Zhang R, Chen X, Hong A, Liu J. The effects of luminescent ruthenium(II) polypyridyl functionalized selenium nanoparticles on bFGF-induced angiogenesis and AKT/ERK signaling. Biomaterials. 2013;34:171-180. [PubMed] [DOI] |
| 8. | Deng X, Szabo S, Khomenko T, Tolstanova G, Paunovic B, French SW, Sandor Z. Novel pharmacologic approaches to the prevention and treatment of ulcerative colitis. Curr Pharm Des. 2012; Aug 23. [Epub ahead of print]. [PubMed] [DOI] |
| 9. | Wan LH, Chen J, Li L, Xiong WB, Zhou LM. Protective effects of Carthamus tinctorius injection on isoprenaline-induced myocardial injury in rats. Pharm Biol. 2011;49:1204-1209. [PubMed] [DOI] |
| 10. | Tien YC, Lin JY, Lai CH, Kuo CH, Lin WY, Tsai CH, Tsai FJ, Cheng YC, Peng WH, Huang CY. Carthamus tinctorius L. prevents LPS-induced TNFalpha signaling activation and cell apoptosis through JNK1/2-NFkappaB pathway inhibition in H9c2 cardiomyoblast cells. J Ethnopharmacol. 2010;130:505-513. [PubMed] [DOI] |
| 11. | Li XL, Cai YQ, Qin H, Wu YJ. Therapeutic effect and mechanism of proanthocyanidins from grape seeds in rats with TNBS-induced ulcerative colitis. Can J Physiol Pharmacol. 2008;86:841-849. [PubMed] [DOI] |
| 12. | Porter SN, Howarth GS, Butler RN. An orally administered growth factor extract derived from bovine whey suppresses breath ethane in colitic rats. Scand J Gastroenterol. 1998;33:967-974. [PubMed] [DOI] |
| 13. | Dieleman LA, Palmen MJ, Akol H, Bloemena E, Peña AS, Meuwissen SG, Van Rees EP. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clin Exp Immunol. 1998;114:385-391. [PubMed] [DOI] |
| 14. | Zhao X, You J. [Advances in study of vascular endothelial growth factor and thyroid disease]. Shengwu Yixue Gongchengxue Zazhi. 2012;29:784-787. [PubMed] |
| 15. | Reis-Filho JS, Tutt AN. Triple negative tumours: a critical review. Histopathology. 2008;52:108-118. [PubMed] [DOI] |
| 16. | Tolstanova G, Khomenko T, Deng X, Szabo S, Sandor Z. New molecular mechanisms of the unexpectedly complex role of VEGF in ulcerative colitis. Biochem Biophys Res Commun. 2010;399:613-616. [PubMed] [DOI] |
| 17. | Scaldaferri F, Vetrano S, Sans M, Arena V, Straface G, Stigliano E, Repici A, Sturm A, Malesci A, Panes J. VEGF-A links angiogenesis and inflammation in inflammatory bowel disease pathogenesis. Gastroenterology. 2009;136:585-595. e5. [PubMed] |
| 18. | Chidlow JH, Langston W, Greer JJ, Ostanin D, Abdelbaqi M, Houghton J, Senthilkumar A, Shukla D, Mazar AP, Grisham MB. Differential angiogenic regulation of experimental colitis. Am J Pathol. 2006;169:2014-2030. [PubMed] [DOI] |
| 19. | Danese S, Sans M, de la Motte C, Graziani C, West G, Phillips MH, Pola R, Rutella S, Willis J, Gasbarrini A. Angiogenesis as a novel component of inflammatory bowel disease pathogenesis. Gastroenterology. 2006;130:2060-2073. [PubMed] [DOI] |
| 20. | Tolstanova G, Khomenko T, Deng X, Chen L, Tarnawski A, Ahluwalia A, Szabo S, Sandor Z. Neutralizing anti-vascular endothelial growth factor (VEGF) antibody reduces severity of experimental ulcerative colitis in rats: direct evidence for the pathogenic role of VEGF. J Pharmacol Exp Ther. 2009;328:749-757. [PubMed] [DOI] |
| 21. | Zhang B, Cao H, Rao GN. Fibroblast growth factor-2 is a downstream mediator of phosphatidylinositol 3-kinase-Akt signaling in 14,15-epoxyeicosatrienoic acid-induced angiogenesis. J Biol Chem. 2006;281:905-914. [PubMed] [DOI] |
| 22. | Wang P, Zhen H, Zhang J, Zhang W, Zhang R, Cheng X, Guo G, Mao X, Wang J, Zhang X. Survivin promotes glioma angiogenesis through vascular endothelial growth factor and basic fibroblast growth factor in vitro and in vivo. Mol Carcinog. 2012;51:586-595. [PubMed] [DOI] |
| 23. | Skaletz-Rorowski A, Eschert H, Leng J, Stallmeyer B, Sindermann JR, Pulawski E, Breithardt G. PKC delta-induced activation of MAPK pathway is required for bFGF-stimulated proliferation of coronary smooth muscle cells. Cardiovasc Res. 2005;67:142-150. [PubMed] [DOI] |
| 24. | Linares PM, Gisbert JP. Role of growth factors in the development of lymphangiogenesis driven by inflammatory bowel disease: a review. Inflamm Bowel Dis. 2011;17:1814-1821. [PubMed] [DOI] |
| 25. | Krishnan K, Arnone B, Buchman A. Intestinal growth factors: potential use in the treatment of inflammatory bowel disease and their role in mucosal healing. Inflamm Bowel Dis. 2011;17:410-422. [PubMed] [DOI] |
| 26. | Tolstanova G, Deng X, Khomenko T, Garg P, Paunovic B, Chen L, Sitaraman SV, Shiloach J, Szabo S, Sandor Z. Role of anti-angiogenic factor endostatin in the pathogenesis of experimental ulcerative colitis. Life Sci. 2011;88:74-81. [PubMed] [DOI] |
| 27. | Zhu YF, Luo HM, Deng ZL, Fu DY, Yao W, Dai J. [Effects of the Chinese patent medicine, Honghua Injection, on platelet glycoprotein IIb/III a receptors in patients with acute coronary syndrome: a randomized controlled trial]. Zhongxiyi Jiehe Xuebao. 2012;10:318-323. [PubMed] |
| 28. | Liu J, Zhang D, Li J, Feng J, Yang X, Shi D, Liang X. [Effects of Salvia miltiorrhiza and Carthamus tinctorius aqueous extracts and compatibility on rat myocardial ischemic reperfusion injury]. Zhongguo Zhongyao Zazhi. 2011;36:189-194. [PubMed] |
| 29. | Han SY, Li HX, Ma X, Zhang K, Ma ZZ, Tu PF. Protective effects of purified safflower extract on myocardial ischemia in vivo and in vitro. Phytomedicine. 2009;16:694-702. [PubMed] [DOI] |
| 30. | Li Y, Wang N. Antithrombotic effects of Danggui, Honghua and potential drug interaction with clopidogrel. J Ethnopharmacol. 2010;128:623-628. [PubMed] [DOI] |
| 31. | Choi EM, Kim GH, Lee YS. Carthamus tinctorius flower extract prevents H2O2-induced dysfunction and oxidative damage in osteoblastic MC3T3-E1 cells. Phytother Res. 2010;24:1037-1041. [PubMed] |