修回日期: 2012-11-07
接受日期: 2012-11-07
在线出版日期: 2012-11-28
目的: 探讨错配修复基因hMLH-1和hMSH-2蛋白在新疆汉族散发性大肠癌(sporadic colorectal carcinoma, SCC)中的表达情况及其与SCC病理参数的关系.
方法: 采用免疫组织化学方法检测95例汉族SCC组织和65例正常结直肠组织(normal colorectal mucosa, NCM)中hMLH-1和hMSH-2蛋白的表达情况.
结果: hMLH-1和hMSH-2在NCM中均表达. hMLH-1蛋白在SCC组织中缺失率为(31.6%)与NCM比较有显著差异(P<0.05); hMSH-2蛋白在SCC组织中缺失率(18.9%)与NCM比较有显著差异(P<0.05). hMLH-1在右半结肠癌中缺失率高于左半结肠癌和直肠癌(P = 0.006), 在低分化腺癌和黏液腺癌中缺失率明显高于高-中分化腺癌(P = 0.014); hMSH-2蛋白在右半结肠癌中缺失率高于左半结肠癌和直肠癌(P = 0.002), 低分化腺癌和黏液腺癌中缺失率显著高于高-中分化腺癌(P = 0.008). 在SCC组织中, hMLH-1和hMSH-2蛋白表达呈正相关性(r = 0.224, P<0.05).
结论: hMLH-1和hMSH-2蛋白在新疆地区汉族散发性大肠癌中有一定比例的缺失, 且与肿瘤分化程度和发生部位密切相关, hMLH-1和hMSH-2蛋白联合检测可能为判断散发性直肠癌恶性程度和临床预测提供重要参考.
引文著录: 于静, 赵峰, 梁丽萍, 石雪迎. hMLH-1和hMSH-2蛋白在新疆汉族散发性大肠癌中的表达及意义. 世界华人消化杂志 2012; 20(33): 3218-3224
Revised: November 7, 2012
Accepted: November 7, 2012
Published online: November 28, 2012
AIM: To investigate the clinical significance of expression of hMLH-1 and hMSH-2 in sporadic colorectal carcinoma (SCC) in Chinese Han patients in Xinjiang.
METHODS: Expression of hMLH-1 and hMSH-2 was detected by immunohistochemistry in 95 cases of SCC specimens collected from Chinese Han patients in Xinjiang and 65 cases of normal colorectal mucosa (NCM) specimens.
RESULTS: The positive rates of hMLH-1 and hMSH-2 expression in NCM were both 100%. The negative rates of hMLH-1 (31.6%) and hMSH-2 (18.9%) expression were significantly higher in SCC than in NCM (both P < 0.05). The negative rates of hMLH-1 and hMSH-2 protein expression were significantly higher in right-sided tumors than in left-sided and rectal tumors (P = 0.006, 0.002), and in poorly differentiated tumors than in well differentiated tumors (P = 0.014, 0.008). There was a positive correlation between the expression of hMLH-1 and hMSH-2 proteins in SCC.
CONCLUSION: Loss of expression of hMLH-1 and hMSH-2 proteins in SCC was observed in some Chinese Han patients in Xinjiang. Loss of expression of hMLH-1 and hMSH-2 proteins correlates with tumor differentiation and location. Combined detection of hMLH-1 and hMSH-2 expression may be used for evaluating the severity and prognosis of colorectal cancer.
- Citation: Yu J, Zhao F, Liang LP, Shi XY. Clinical significance of expression of hMLH-1 and hMSH-2 in sporadic colorectal carcinoma in Chinese Han patients in Xinjiang. Shijie Huaren Xiaohua Zazhi 2012; 20(33): 3218-3224
- URL: https://www.wjgnet.com/1009-3079/full/v20/i33/3218.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i33.3218
结直肠癌是消化系常见肿瘤之一, 其发病率逐年升高. 结直肠肿瘤的发生发展是一个复杂的动态过程, 其中涉及许多肿瘤相关因子参与和调控. 除了与癌基因激活和抑癌基因失活密切相关外, 与错配修复基因(mismatch repair gene, MMR)亦有密切关系. hMLH-1和hMSH-2蛋白是MMR家族中的主要成员, 在结直肠癌发生演变中起重要作用. 本文用免疫组织化学法检测新疆汉族散发性结直肠癌(sporadic colorectal carcinoma, SCC)组织中hMLH-1和hMSH-2蛋白的表达, 进行统计分析, 探讨hMLH-1和hMSH-2蛋白在新疆汉族SCC组织中的表达情况及其与临床病理参数的关系及意义.
收集2010-01/2012-01新疆医科大学附属肿瘤医院病理科经手术切除SCC标本汉族95例, 结肠癌41例, 直肠癌54例; 男49例, 女46例; 年龄37-81岁, 平均年龄62.38岁; 高分化腺癌18例, 中分化腺癌28例, 低分化腺癌26例, 黏液腺癌23例; 右半结肠癌(回盲部癌、升结肠癌、结肠肝曲癌及横结肠癌)22例, 左半结肠癌(结肠脾曲癌、降结肠癌、乙状结肠癌)27例, 直肠癌46例; 淋巴结有转移者36例, 无转移者59例; Dukes分期A期15例, B期34例, C期38例, D期8例. 65例正常结直肠组织作为对照. 所有患者术前均未行放化疗, 无任何肿瘤家族史.
将40 g/L中性甲醛固定, 石蜡包埋的标本4 µm连续切片, 采用PV-9000二步法, 一抗分别为MLH1、MSH2鼠抗人单克隆抗体购自北京中杉金桥生物有限公司, 工作浓度均为1:150; 通用型两步法(HRP)检测试剂盒购自福建迈新生物制品有限公司. 用PBS替代一抗做阴性对照, 以正常结直肠黏膜上皮和/或浸润的淋巴细胞为阳性对照. hMLH-1和hMSH-2阳性表达均在细胞核, 结果判断标准参考许良中等[1]的免疫组织化学反应结果的判断标准, 镜下肿瘤细胞显示核染色为阳性, 结合染色强度和阳性细胞百分比判定阳性表达程度. 光镜下每张切片中选取癌细胞较多的5个高倍镜视野, 每个视野计数100个细胞, 按染色强度分级: 无着色为0分, 淡黄色1分, 黄色2分, 棕黄色3分; 按阳性细胞百分比分级: 无阳性细胞为0分, 阳性细胞数≤10%为1分, 11%-50%为2分, 51%-75%为3分, >75%为4分. 两项得分相乘结果≥2分为阳性表达病例, <2分为阴性表达病例. 阳性对照为正常结直肠黏膜上皮和/或浸润的淋巴细胞阳性核染色. 阳性对照核表达阳性而肿瘤细胞核缺乏染色则判为阴性.
统计学处理 采用SPSS19.0统计软件, 计数资料率的比较采用χ2检验、Fisher确切概率法、Spear-man等级相关检验. P<0.05为差异有统计学意义.
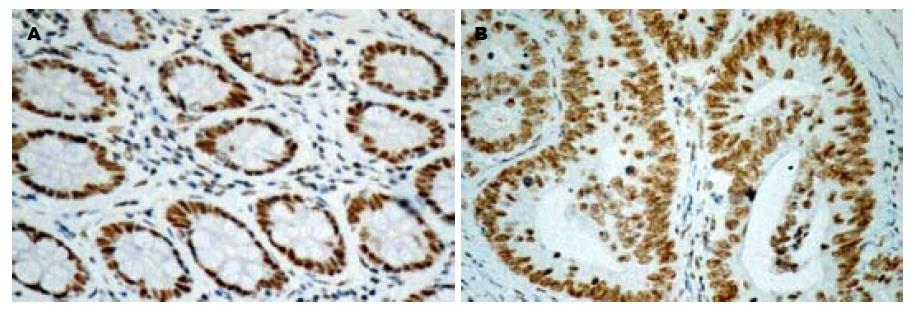
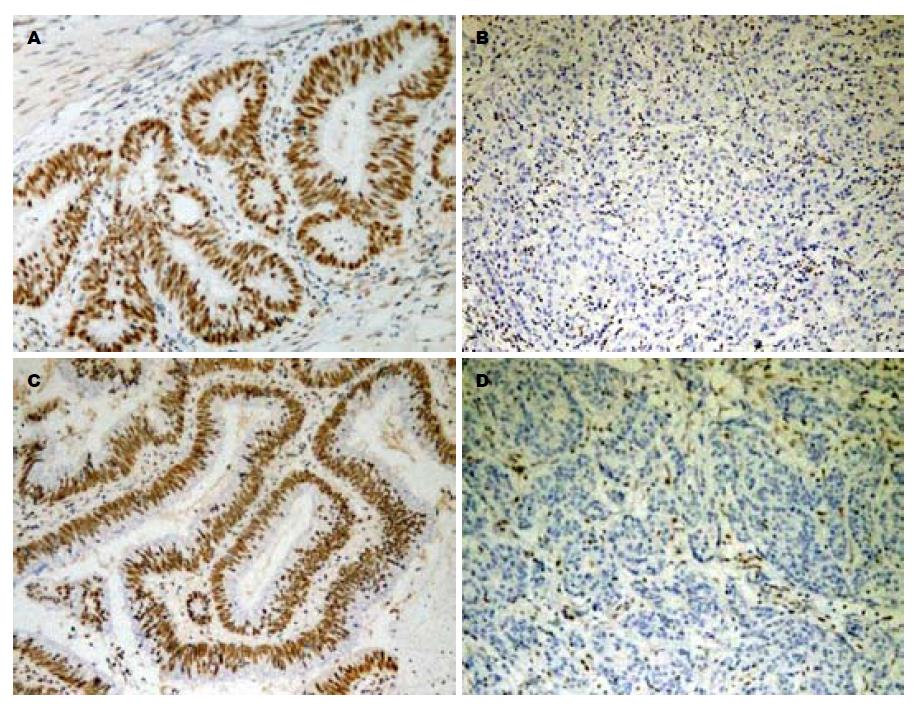
在正常结直肠黏膜组织(normal colorectal mucosa, NCM)中hMLH-1和hMSH-2均表达; 在SCC中, hMLH-1缺失表达30例, hMSH-2缺失表达18例, hMLH-1和hMSH-2共同缺失的有10例. 根据表达程度不同, hMLH-1在SCC中阴性率(31.6%, 30/95)明显高于NCM且差异显著(P<0.05). hMSH-2在SCC中阴性率高于NCM (18.9%, 18/95)且差异显著(P<0.05, 图1).
在SCC组织中, hMLH-1蛋白在SCC组织中表达缺失与肿瘤发生部位及分化程度有关(均P<0.05, 表1); hMLH-1蛋白在汉族、维族、哈族SCC组织中阴性率分别为31.6%、25.0%、27.8%, 但无明显差异; 与性别、年龄、肿瘤最大径、浸润深度、淋巴结有无转移及Dukes分期无关; hMSH-2蛋白在SCC组织中表达缺失与达肿瘤发生部位及分化程度有关(P<0.01, 表1); hMSH-2蛋白在汉族、维族、哈族SCC组织中缺失率分别为18.9%、35.0%、33.3%, 但无明显差异; 与年龄、性别、民族、肿瘤最大径、浸润深度、淋巴结有无转移及Dukes分期无关(P>0.05, 图2, 表1). hMLH-1或 hMSH-2蛋白缺失表达在汉、维、哈族无差异(P>0.05, 表2).
| 病理特征 | n | hMLH-1 | χ2 | P值 | hMSH-2 | χ2 | P值 | ||
| + | - | + | - | ||||||
| 性别 | |||||||||
| 男 | 49 | 35 | 14 | 0.424 | 0.515 | 39 | 10 | 0.141 | 0.708 |
| 女 | 46 | 30 | 16 | 38 | 8 | ||||
| 民族 | |||||||||
| 汉族 | 95 | 65 | 30 | 0.392 | 0.822 | 77 | 18 | 3.753 | 0.159 |
| 维吾尔族 | 20 | 15 | 5 | 13 | 7 | ||||
| 哈萨克族 | 18 | 13 | 5 | 12 | 6 | ||||
| 年龄(岁) | |||||||||
| ≥60 | 55 | 36 | 19 | 0.532 | 0.466 | 45 | 10 | 0.050 | 0.823 |
| <60 | 40 | 29 | 11 | 32 | 8 | ||||
| 肿瘤最大径(cm) | |||||||||
| >5 | 35 | 21 | 14 | 1.189 | 0.177 | 25 | 10 | 3.342 | 0.068 |
| ≤5 | 60 | 44 | 16 | 52 | 8 | ||||
| 部位 | |||||||||
| 右半结肠 | 22 | 9 | 13 | 10.168 | 0.006 | 12 | 10 | 11.809 | 0.002 |
| 左半结肠 | 27 | 20 | 7 | 23 | 4 | ||||
| 直肠 | 46 | 36 | 10 | 42 | 4 | ||||
| 浸润深度 | |||||||||
| 肌层以内 | 26 | 15 | 11 | 1.907 | 0.167 | 20 | 6 | 0.8564 | 0.355 |
| 肌层以外 | 69 | 50 | 19 | 57 | 12 | ||||
| 分化程度 | |||||||||
| 高-中分化腺癌 | 46 | 38 | 8 | 8.480 | 0.014 | 43 | 3 | 9.514 | 0.008 |
| 低分化腺癌 | 26 | 15 | 11 | 18 | 8 | ||||
| 黏液腺癌 | 23 | 12 | 11 | 16 | 7 | ||||
| 淋巴结转移 | |||||||||
| 有 | 36 | 28 | 8 | 2.349 | 0.125 | 28 | 8 | 0.405 | 0.525 |
| 无 | 59 | 37 | 22 | 49 | 10 | ||||
| Dukes分期 | |||||||||
| A+B | 49 | 36 | 13 | 1.194 | 0.275 | 42 | 7 | 1.432 | 0.231 |
| C+D | 46 | 29 | 17 | 35 | 11 | ||||
| 汉族 | 维族 | 哈族 | χ2 | P值 | |
| 性别 | |||||
| 男 | 24 | 7 | 7 | 0.803 | 0.669 |
| 女 | 24 | 5 | 4 | ||
| 年龄(岁) | |||||
| ≥50 | 29 | 5 | 7 | 1.571 | 0.481 |
| <50 | 19 | 7 | 4 | ||
| 肿瘤最大径(cm) | |||||
| >5 | 24 | 8 | 6 | 1.077 | 0.583 |
| ≤5 | 24 | 4 | 5 | ||
| 部位 | |||||
| 右半结肠 | 23 | 3 | 3 | 3.430 | 0.491 |
| 左半结肠 | 11 | 4 | 3 | ||
| 直肠 | 14 | 5 | 5 | ||
| 浸润深度 | |||||
| 肌层以内 | 17 | 6 | 6 | 1.938 | 0.388 |
| 肌层以外 | 31 | 6 | 5 | ||
| 分化程度 | |||||
| 高-中分化腺癌 | 11 | 5 | 6 | 4.788 | 0.312 |
| 低分化腺癌 | 19 | 4 | 3 | ||
| 黏液腺癌 | 18 | 3 | 2 | ||
| 淋巴结转移 | |||||
| 有 | 16 | 8 | 6 | 5.104 | 0.078 |
| 无 | 32 | 4 | 5 | ||
| Dukes分期 | |||||
| A+B | 20 | 6 | 8 | 3.486 | 0.175 |
| C+D | 28 | 6 | 3 |
MMR是生物进化过程中的保守基因, 属于管家基因, 具有识别和修复DNA碱基错配、增强DNA复制忠实性、维持基因组稳定性和降低自发性突变的功能. 目前发现MMR包括hMLH-1、hMSH-2、hPMS-1、hPMS-2等, 其中起主要作用的基因hMLH-1和hMSH-2[2-5]. hMLH-1基因位于染色体3p21-23, 全长100 kb, 含19个外显子, cDNA有2268 bp的开放阅读框架(open reading frame, ORF), hMLH-1与hPMS-2蛋白构成异源二聚体hMutLα, 该异源二聚体能够提高与错配碱基结合效率和切除含有错配碱基的一段DNA链的功能, 从而保证DNA复制忠实性和稳定性及防止微卫星不稳定(microsatellite instability, MSI)的产生. hMSH-2基因是1993年分离克隆到的第1个人类MMR基因. hMSH-2基因定位于人类染色体2p1-22, 其基因组全长约73 kb(不包括启动子), 含16个外显子; cDNA全长3111 bp, ORF长2727 bp; hMSH-2与hMSH6或hMSH-3结合形成异源二聚体hMutSα或hMutSβ, 两个异源二聚体均可识别新合成的DNA核苷酸链上的剪辑错配, 并与错配位点结合, hMutLα二聚体与结合到DNA链上的hMutSα或hMutSβ形成一种暂时的复合物, 启动错配修复, 与相关酶配合, 切除含有错配碱基的DNA链, 以代替被切除的DNA链, 从而完成错配碱基DNA核酸链修复.
大肠癌的发生分为遗传性和散发性[6-8]. 研究发现, 部分散发性大肠癌(sporadic colorectal carcinoma, SCC)中有hMLH-1与hMSH-2蛋白缺失, 主要是hMLH-1基因启动子过度甲基化导致基因转录和翻译沉默表达[9-11]. MMR基因失活并不直接导致肿瘤发生, 而是导致基因组不稳定, 特别是一些简单的核苷酸重复序列. MMR系统失活导致肿瘤发生主要通过以下途径: (1)在DNA复制过程中简单的重复序列长度变异, 表现为肿瘤细胞中出现MSI, 继而引发癌基因的激活或抑癌基因失活, 诱发癌变; (2)MMR缺陷会使发生在某些原癌基因和抑癌基因中的突变快速积累, 最终影响到正常细胞的增殖调控[12,13].
近年来研究发现, hMLH-1和hMSH-2蛋白的表达变化结果可以很好的预示MMR功能缺陷和MSI的存在[14-16]. Lindor等[17]检测1 114例SCC中hMLH-1和hMSH-2表达情况, 发现hMLH-1阴性率明显高于hMSH-2. Wheeler[18]检测38例早期和40例晚期SCC的MSI情况时, 有71.4%的MSI-H病例出现hMLH-1高度甲基化, 说明hMLH-1基因突变在SCC的发生发展过程中有重要作用. 在本研究中, SCC组织中hMLH-1缺失率高于hMSH-2, 与NCM比较有差异, 且hMLH-1和hMSH-2蛋白在SCC组织中表达呈正相关. 提示在SCC组织中, hMLH-1和hMSH-2蛋白共同参与了肿瘤发生, 其中hMLH-1突变率高于hMSH-2, 主要是由于hMLH-1基因启动子区域CpG岛被高度甲基化以致基因的转录和翻译障碍而出现hMLH-1蛋白的表达缺失[19-24], hMSH-2蛋白表达缺失机制尚不明确.
本研究结果中hMLH-1和hMSH-2蛋白表达情况与SCC临床病理特征关系显示, hMLH-1及hMSH-2蛋白阴性率在>60岁年龄组中均高于≤60岁年龄组, 但无显著差异. 文献报道[25], 年龄有可能是hMLH-1发生过甲基化的因素之一, 且高龄人群中SCC多发, 本研究结果与其基本一致. 本研究结果显示hMLH-1和hMSH-2蛋白表达情况与肿瘤最大径、浸润深度、淋巴结转移及Dukes分期均不相关, 提示在肿瘤发生的初始阶段可能已经发生hMLH-1和hMSH-2基因突变, hMLH-1和hMSH-2蛋白缺失可能是发生SCC的早期事件之一. 在本研究中, 发现hMLH-1或hMSH-2蛋白缺失表达在汉、维、哈族无差异; 提示hMLH-1和hMSH-2蛋白在不同民族SCC组织中表达无差异, 可能与样本容量等因素有关, 本结论仅基于本研究之上, 对于大人群该指标的研究尚未开展, 有待进一步研究. 本组实验结果还显示hMLH-1、hMSH-2蛋白与肿瘤分化程度及发生部位有关, 随着SCC分化程度降低, hMLH-1、hMSH-2蛋白阴性率逐渐升高, 提示在低分化SCC中hMLH-1、hMSH-2蛋白更易表达缺失. hMLH-1、hMSH-2蛋白在右半结肠中的阴性率高于左半结肠和直肠, 且差异显著, 这与国内学者蔡崎等[26]和国外学者Tanaka等[27]研究基本一致. 提示发生在右半结肠SCC的MMR系统缺陷途径可能不同于左半结肠和直肠, 在右半结肠SCC组织中更有可能出现hMLH-1基因启动子的过度甲基化, 导致MSI发生. MSI可表现在多种不同的肿瘤中, 而且仅在肿瘤中出现, 提示MSI与细胞的恶性转化有关. 对hMLH-1蛋白表达缺失的SCC组织采用PCR技术检测MSI[28-31], 可以提示hMLH-1蛋白缺失可能是反应SCC组织生物学行为和预测预后的重要参数之一. 有实验研究[32,33], 存在hMLH-1和hMSH-2基因功能缺陷的大肠癌细胞株对5-Fu和顺铂等多种化疗药物具有耐药性, 说明检测hMLH-1和hMSH-2蛋白表达情况对于肿瘤患者的个体化治疗和预测预后有一定的指导意义.
综上所述, 新疆地区SCC病例中部分存在hMLH-1和hMSH-2蛋白表达缺失, 且与肿瘤发生部位及分化程度密切相关, 有助于在肿瘤高发人群中筛选和早期诊断SCC. 在临床治疗中, 通过检测hMLH-1和hMSH-2蛋白表达的情况, 对于判断肿瘤发生发展及临床预测有重要指导意义. 总而言之, 联合检测hMLH-1和hMSH-2蛋白表达情况对于患者临床治疗和预后判断有重要参考价值.
结直肠癌的发生是一个多阶段的过程, 涉及错配修复基因、癌基因、抑癌基因等的改变. 尤其是以hMLH-1和hMSH2为代表的错配修复基因, 作为生物进化过程中的保守基因, 在识别和修复DNA碱基错配、增强DNA复制忠实性、维持基因组稳定性和降低自发性等方面发挥着重要作用.
郝立强, 副教授, 上海长海医院普外二科
结直肠癌患者的生存率是临床治疗中的重点, hMLH-1和hMSH2蛋白表达的情况与患者的预后密切相关. 本实验中涉及到的维、哈等少数民族患者, 仅限于小范围的检查, 实验结论基于此研究之上, 若需进一步研究, 需要扩大检查样本量.
CpG甲基化与右半结肠, 女性, 高龄, 细胞分化程度, 微卫星稳定等因素有关. 大约有一半以上的肿瘤显示CpG甲基化会导致微卫星不稳定. 微卫星不稳定仅出现在肿瘤中, 与细胞的恶性转化有关.
本文研究新疆地区散发性的大肠癌组织中hMLH-1和hMSH-2蛋白表达情况, 与内地相关实验比较差异不大. 本实验中少数民族样本仅是小范围研究, 实验结论仅基于该实验. 维、哈少数民族的发病率较低, 探讨具体机制, 有待于扩大样本量进行进一步研究.
本研究用免疫组织化学的方法检查hMLH-1和hMSH-2在结直肠癌组织中的表达, 有助于探讨其在结直肠癌发生、发展中的作用, 并为结直肠癌恶性程度判断和评估预后提供参考.
微卫星不稳定: 基因组中简单重复序列次数的增加或减少, 可表现在多种不同的肿瘤中, 且仅在肿瘤中出现. 提示MSI的出现在一定程度上与细胞的恶性转化有关. 发生在左半结肠的癌症更容易出现微卫星不稳定, 有的个体上皮内出现淋巴细胞, 这种类型的患者预后不理想.
本文联合检测hMLH-1和hMSH2在结直肠癌中的表达, 更有助于结直肠癌预后的判断, 立意新颖, 数据可信, 论证有据.
编辑: 翟欢欢 电编:鲁亚静
| 2. | Peltomäki P. Deficient DNA mismatch repair: a common etiologic factor for colon cancer. Hum Mol Genet. 2001;10:735-740. [PubMed] [DOI] |
| 4. | Kolodner RD, Marsischky GT. Eukaryotic DNA mismatch repair. Curr Opin Genet Dev. 1999;9:89-96. [PubMed] [DOI] |
| 5. | Adé J, Haffani Y, Beizile FJ. Functional analysis of the Arabidopsis thaliana mismatch repair gene MSH2. Genome. 2001;44:651-657. [PubMed] |
| 6. | Peltomäki P. Lynch syndrome genes. Fam Cancer. 2005;4:227-232. [PubMed] [DOI] |
| 7. | Barrow E, Alduaij W, Robinson L, Shenton A, Clancy T, Lalloo F, Hill J, Evans DG. Colorectal cancer in HNPCC: cumulative lifetime incidence, survival and tumour distribution. A report of 121 families with proven mutations. Clin Genet. 2008;74:233-242. [PubMed] [DOI] |
| 8. | Holinski-Feder E, Morak M. [Hereditary nonpolyposis colorectal carcinoma: state of the art]. Dtsch Med Wochenschr. 2008;133:1690-1695. [PubMed] [DOI] |
| 9. | Kneitz B, Cohen PE, Avdievich E, Zhu L, Kane MF, Hou H, Kolodner RD, Kucherlapati R, Pollard JW, Edelmann W. MutS homolog 4 localization to meiotic chromosomes is required for chromosome pairing during meiosis in male and female mice. Genes Dev. 2000;14:1085-1097. [PubMed] |
| 10. | Gupta S, Gellert M, Yang W. Mechanism of mismatch recognition revealed by human MutSβ bound to unpaired DNA loops. Nat Struct Mol Biol. 2012;19:72-78. [PubMed] [DOI] |
| 11. | Kazama Y, Watanabe T, Kanazawa T, Tanaka J, Tanaka T, Nagawa H. Poorly differentiated colorectal adenocarcinomas show higher rates of microsatellite instability and promoter methylation of p16 and hMLH1: a study matched for T classification and tumor location. J Surg Oncol. 2008;97:278-283. [PubMed] [DOI] |
| 12. | Youn CK, Cho HJ, Kim SH, Kim HB, Kim MH, Chang IY, Lee JS, Chung MH, Hahm KS, You HJ. Bcl-2 expression suppresses mismatch repair activity through inhibition of E2F transcriptional activity. Nat Cell Biol. 2005;7:137-147. [PubMed] [DOI] |
| 13. | Park IJ, Kim HC, Kim JS, Yu ES, Yu CS, Kim JC. Correlation between hMLH1/hMSH2 and p53 protein expression in sporadic colorectal cancer. Hepatogastroenterology. 2005;52:450-454. [PubMed] |
| 15. | Gryfe R, Gallinger S. Microsatellite instability, mismatch repair deficiency, and colorectal cancer. Surgery. 2001;130:17-20. |
| 16. | Shia J. Immunohistochemistry versus microsatellite instability testing for screening colorectal cancer patients at risk for hereditary nonpolyposis colorectal cancer syndrome. Part I. The utility of immunohistochemistry. J Mol Diagn. 2008;10:293-300. [PubMed] [DOI] |
| 17. | Lindor NM, Burgart LJ, Leontovich O, Goldberg RM, Cunningham JM, Sargent DJ, Walsh-Vockley C, Petersen GM, Walsh MD, Leggett BA. Immunohistochemistry versus microsatellite instability testing in phenotyping colorectal tumors. J Clin Oncol. 2002;20:1043-1048. [PubMed] [DOI] |
| 18. | Wheeler JM. Epigenetics, mismatch repair genes and colorectal cancer. Ann R Coll Surg Engl. 2005;87:15-20. [PubMed] [DOI] |
| 19. | Miyakura Y, Sugano K, Konishi F, Ichikawa A, Maekawa M, Shitoh K, Igarashi S, Kotake K, Koyama Y, Nagai H. Extensive methylation of hMLH1 promoter region predominates in proximal colon cancer with microsatellite instability. Gastroenterology. 2001;121:1300-1309. [PubMed] [DOI] |
| 20. | Jin HY, Liu X, Li VK, Ding Y, Yang B, Geng J, Lai R, Ding S, Ni M, Zhao R. Detection of mismatch repair gene germline mutation carrier among Chinese population with colorectal cancer. BMC Cancer. 2008;8:44. [PubMed] [DOI] |
| 21. | Poynter JN, Siegmund KD, Weisenberger DJ, Long TI, Thibodeau SN, Lindor N, Young J, Jenkins MA, Hopper JL, Baron JA. Molecular characterization of MSI-H colorectal cancer by MLHI promoter methylation, immunohistochemistry, and mismatch repair germline mutation screening. Cancer Epidemiol Biomarkers Prev. 2008;17:3208-3215. [PubMed] [DOI] |
| 22. | Bendardaf R, Lamlum H, Ristamäki R, Syrjänen K, Pyrhönen S. Oncoprotein Bcl-2 and microsatellite instability are associated with disease-free survival and treatment response in colorectal cancer. Oncol Rep. 2008;20:999-1004. [PubMed] |
| 23. | Hampel H, Frankel WL, Martin E, Arnold M, Khanduja K, Kuebler P, Clendenning M, Sotamaa K, Prior T, Westman JA. Feasibility of screening for Lynch syndrome among patients with colorectal cancer. J Clin Oncol. 2008;26:5783-5788. [PubMed] [DOI] |
| 24. | Deng G, Peng E, Gum J, Terdiman J, Sleisenger M, Kim YS. Methylation of hMLH1 promoter correlates with the gene silencing with a region-specific manner in colorectal cancer. Br J Cancer. 2002;86:574-579. [PubMed] [DOI] |
| 26. | 蔡 崎, 陆 洪芬, 孙 孟红, 张 太明, 施 达仁. 散发性结直肠癌hMLH-1和hMSH2蛋白表达. 临床与实验病理学杂志. 2003;19:521-525. |
| 27. | Tanaka J, Watanabe T, Kanazawa T, Tada T, Kazama Y, Tanaka T, Nagawa H. Left-Sided microsatellite unstable colorectal cancers show less frequent methylation of hMLH1 and CpG island methylator phenotype than right-sided ones. J Surg Oncol. 2007;96:611-618. [PubMed] [DOI] |
| 28. | 陆 小军, 贾 水前. PCR-DGGE法检测DNA碱基突变及多态性的方法学评价. 四川大学学报(医学版). 2007;38:882-884. |
| 30. | Shen XS, Zhao B, Wang ZJ. Clinical features and hMSH2/hMLH1 germ-line mutations in Chinese patients with hereditary nonpolyposis colorectal cancer. Chin Med J (Engl). 2008;121:1265-1268. [PubMed] |
| 31. | Herman JG, Graff JR, Myöhänen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci USA. 1996;93:9821-9826. [PubMed] [DOI] |
| 32. | Arnold CN, Goel A, Boland CR. Role of hMLH1 promoter hypermethylation in drug resistance to 5-fluorouracil in colorectal cancer cell lines. Int J Cancer. 2003;106:66-73. [PubMed] [DOI] |
| 33. | Hawkins N, Norrie M, Cheong K, Mokany E, Ku SL, Meagher A, O'Connor T, Ward R. CpG island methylation in sporadic colorectal cancers and its relationship to microsatellite instability. Gastroenterology. 2002;122:1376-1387. [PubMed] [DOI] |