修回日期: 2012-11-06
接受日期: 2012-11-07
在线出版日期: 2012-11-28
目的: 探讨不同两歧双歧杆菌菌株(Bifidobacterium bifidum, B. bifidum S17)干预周期对IL-10-/-小鼠结肠上皮肠屏障功能保护作用的影响.
方法: 分成4组: WT组、WT+BBf(B. bifidum)组、IL-10-/-组和IL-10-/-+BBf组, 周期设为2、4、6 wk, 5只/组, 分别灌饲PBS液或B. bifidum溶液, 检测结肠组织肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白介素1β(interleukin-1β, IL-1β)和干扰素γ(interferon-γ, INF-γ)浓度, 小鼠结肠上皮通透性和TER, 紧密连接蛋白的表达.
结果: B. bifidum干预4 wk的小鼠结肠组织TNF-α、IL-1β、INF-γ浓度, 结肠黏膜上皮通透性、TER和紧密连接蛋白表达较对照组、干预2 wk有显著性差异(均P<0.01), 与干预6 wk相比较无显著性差异.
结论: B. bifidum干预4 wk可检测明确的肠屏障保护作用, 增加干预周期, 并不能增加肠屏障保护效果.
引文著录: 韩华中, 梁勇, 石忱长, 杨俊. 两歧双歧杆菌干预周期对IL-10基因敲除小鼠结肠上皮屏障保护作用的影响. 世界华人消化杂志 2012; 20(33): 3203-3210
Revised: November 6, 2012
Accepted: November 7, 2012
Published online: November 28, 2012
AIM: To explore the protective effect of different cycles of intervention with Bifidobacterium bifidum (B. bifidum) on colonic epithelial mucosal barrier in IL-10 knockout mice.
METHODS: Female IL-10 knockout (IL-10-/-) mice and wild type (WT) mice were divided into four groups: WT group, WT + B. bifidum (BBf) group, IL-10-/- group, and IL-10-/- + B. bifidum group. The WT + B. bifidum and IL-10-/- + B. bifidum groups were administered with B. bifidum by gavage at a dose of 109 cells/d per mice for 2 wk, 4 wk, and 6 wk. The other groups were given phosphate buffered saline solution. The expression of tumor necrosis factor (TNF)-α, interleukin (IL)-1β, and interferon (INF)-γ in the colon was measured at the end of the experiment. Colonic tissues were collected for measurement of colonic epithelial permeability, transepithelial electrical resistance (TER), and expression of tight junction protein.
RESULTS: The expression of TNF-α, IL-1β, and INF-γ, and tight junction protein, colonic epithelial permeability, and TER in mice treated with B. bifidum for 4 wk were significantly different from those in control mice and mice treated with B. bifidum for 2 wk (all P < 0.01), but showed no significant differences with those in mice treated with B. bifidum for 6 wk.
CONCLUSION: B. bifidum intervention for 4 wk had a significant protective effect on colonic epithelial mucosal barrier in IL-10 knockout mice, and prolonged intervention did not significantly improve the protective effect of B. bifidum.
- Citation: Han HZ, Liang Y, Shi CZ, Yang J. Influence of treatment with Bifidobacteria bifidum on gut barrier function in IL-10 knockout mice. Shijie Huaren Xiaohua Zazhi 2012; 20(33): 3203-3210
- URL: https://www.wjgnet.com/1009-3079/full/v20/i33/3203.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i33.3203
胆微生态制剂, 包括益生菌及其代谢产物和生长促进因子. 目前已被确认的几种益生菌有双歧杆菌、嗜酸乳杆菌、粪肠球菌和鼠李糖乳杆菌等. 益生菌利用他们在人体中形成优势菌群, 对致病菌进行抑制, 从而减少疾病的发生. 同时, 益生菌在发酵过程中产生的复合代谢物以及多种营养物质, 促使人体肠道微生态易于达到一种平衡. 微生态制剂已在临床广泛用于改善肠道功能, 预防和治疗腹泻; 治疗肠易激综合征(irritable bowel syndrome, IBS)及炎症性肠病(inflammatory bowel disease, IBD); 预防和治疗泌尿生殖系统感染; 增强人体免疫力; 缓解变态反应等, 并取得了良好的临床效果[1]. 但临床应用周期目前尚缺乏系统完整的临床应用指南, 也较难对益生菌制剂的效用作量化评价, 其中临床应用周期是一个临床迫切需要解决的问题, 如果能得到解决, 将对其临床应用产生深刻的影响. IL-10-/-小鼠可自发形成类似于人类结肠炎, 是IBD研究中最常用的基因缺陷动物模型, 该模型小鼠在无菌饲养条件下并不发生结肠炎症, 而转移至有菌环境下则迅速发展成Th1占优势的肠道炎症, 与人类CD非常相似的病理改变[2,3], 且利用抗生素和益生菌干预肠道菌群能有效减轻该模型小鼠结肠炎症, 缓解临床症状[4,5], 所以, IL-10-/-是用以益生菌干预实验的理想动物模型. 本实验围绕双歧杆菌(Bifidobacterium bifidum, B. bifidum)不同干预周期对IL-10-/-结肠上皮肠屏障保护作用效果进行研究.
1.1.1 双歧杆菌菌株及培养: 两歧双歧杆菌菌株(Bifidobacterium bifidum, B. bifidum S17)[6]由上海信谊药厂提供, 以低压冻干菌粉的形式在-20 ℃以下保存, 菌粉用PBS稀释后2 h内经MRS (Man-Rogosa-Sharpe, Difco, BD公司)液体培养基, 37 ℃厌氧培养48 h .
1.1.2 实验动物及分组: 129品系IL-10-/-小鼠及野生型(WT)小鼠均购自美国Jackson Laboratories公司. 本实验所使用的小鼠均为8 wk ♀小鼠, 共60只, 并以IL-10-/-小鼠作为IBD模型. 随机分为WT组、WT+BBf(B. bifidum)组、IL-10-/-组、 IL-10-/-+BBf 组, 采用不同的干预周期, 周期设为2、4、6 wk, 每周期均为5只/组.
1.1.3 试剂和仪器: ZO-1抗体(Abcam, CA, USA), occludin、claudin-1抗体(San Francisco CA, USA). Dye-800或IRDye-700标记的二抗, LI-COR Bioscience, Lincoln, NE. PBS缓冲液和MRS培养基, 上海市疾控中心. 肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、白介素-1β(interleukin-1β, IL-1β)和干扰素-γ(interferon-γ, INF-γ)检测试剂盒(BD Pharmingen, Oxford, UK); 高效冷冻离心机、紫外分光光度计、KODAK凝胶图像分析仪、 Microscan Autoscan-4细菌鉴定系统、RA-ID板、Dade Behring公司和Ultra-Turrax匀浆仪(IRK-WERKE, Germany); Ussing Chamber、EasyMount Chamber、Physiologic Instruments(SanDiego, CA, USA); Odyssey Infrare图像分析系统(LICOR Bioscience, Lincoln, NE).
1.2.1 B. bifidum溶液的配制:B. bifidum菌株于MRS液体培养基中37 ℃厌氧培养12 h, 5 000 r/min离心5 min后除去上清液, 菌体重悬于无菌PBS中, 利用分光光度法配制成2.0×109 CFU/mL浓度的B. bifidum悬液.
1.2.2 动物处理: BBf干预组每日灌胃0.5 mL B. bifidum液(1.0×109 CFU), 其余灌胃PBS 0.5 mL, 持续6 wk, 分别于实验第2、4、6周用颈椎脱臼法处死小鼠(5只/组). 具体操作方法为每日新配制浓度为2.0×109 CFU/mL的两歧双歧杆菌菌液, 并用1 mL注射器取该菌液0.5 mL, 充分混匀后, 接用小鼠灌胃针头将菌液全部灌入胃内. 每周期各组小鼠处死后, 留取结肠中段行Ussing Chamber实验, 测试结肠黏膜通透性和TER, 取材, 置于40 g/L甲醛和新鲜标本固定.
1.2.3 炎症评分: 结肠组织用40 g/L甲醛固定, 经常规处理、6 μm切片、HE染色后镜检, 观察黏膜溃疡、炎症细胞的浸润、肌层的增厚、杯状细胞的减少、出血等现象, 根据每一项出现的现象逐一打分, 并根据其分数总和来判断炎症发生的轻重程度[7].
1.2.4 ELISA法检测TNF-α、IL-1b和INF-γ浓度: 将切取的结肠组织置于800 μL含有PBS、2% FCS和0.5%溴化十六烷基三甲胺的冷匀浆液中, 用Ultra-Turrax匀浆仪匀浆后在4 ℃离心15 min(3 000 r/min). 按照ELISA试剂盒说明检测上清液中TNF-α、IL-1b和INF-γ浓度, 以pg/mg组织表示.
1.2.5 Western blot法检测紧密连接蛋白的表达: 将结肠组织超声粉碎后置于冷的裂解液中[1 μL/mL缓冲液, 50 mmol/L Tris-HCl, pH 7.4, 150 mmol/L NaCl, 1%NP-40(Igepal CA-630), 0.5%脱氧胆酸盐, 0.1%十二烷硫酸钠和5 mmol/L EDTA], 裂解60 min. 按照Zeissig等[8]方法将提取蛋白分离、一抗(ZO-1、occludin、claudin-1), 用Dye-800或IRDye-700标记的二抗孵育, 以β-tubulin作为内参, Odyssey Infrare图像分析系统进行荧光定量分析, 结果以相对丰度表示.
1.2.6 免疫荧光法定位紧密连接蛋白的表达: 将小鼠新鲜结肠组织经PBS冲洗后用组织包埋剂包埋(Sakura, USA), 并置于-80 ℃保存. 将冰冻组织10 μm切片后在95 ℃ 10 mmol/L枸橼酸钠溶液中孵育5 min, 冷却至室温. 用含有5%牛血清白蛋白和5%胎牛血清的PBS室温下孵育30 min以消除非特异性背景. 将以上切片与紧密连接蛋白ZO-1、occludin和claudin-1一抗(Abcom company小鼠抗兔)在4 ℃下孵育过夜, 再用异硫氰酸荧光素标记的次毒蕈环肽室温下染色1 h. 再经相应荧光素标记的二抗(Beyond time兔抗鼠), 孵育1 h之后进行ECL(Thermo Pierce化学发光底物)化学发光.
1.2.7 Ussing Chamber检测肠上皮屏障: 根据Madsen[4]的方法, 检测肠上皮细胞跨膜电阻(transepithelial electrical resistance, TER)和细胞旁路甘露醇通透性, 以此反映肠上皮的屏障功能. 将新鲜剥离的结肠黏膜组织固定于Ussing Chamber, 两侧室灌注3 mL 37 ℃氧合Krebs缓冲液. 调节电压钳零电压, 以1 mv刺激电压每隔60 s刺激0.5 s, 记录跨膜电流(∆Isc)和电压(PD), TER = PD/∆Isc. 为检测肠上皮细胞旁路甘露醇通透性, 将3%甘露醇添加到黏膜面侧溶液中, 平衡30 min后, 每隔30 min抽取浆膜面溶液200 μL, 持续2 h, 并置于液氮中保存. 实验结束后利用HPLC检测甘露醇浓度.
统计学处理 采用Graphpad Prism软件进行统计, 计量数据以mean±SD表示, 采用单因素方差分析(One-Way ANOVA), 组间比较采用SNK法, 检验水准α = 0.05.
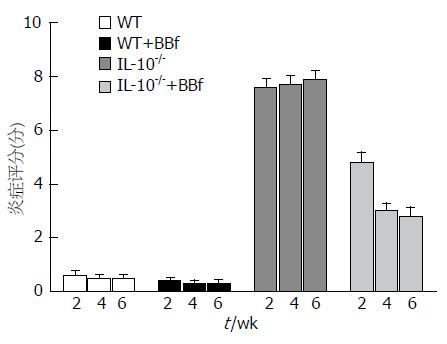
IL-10-/-组炎症评分明显高于WT组(P<0.0001); 虽然IL-10-/-+BBf组较IL-10-/-组炎症评分明显降低, 但并未恢复正常水平; WT组与WT+BBf组的炎症评分比较无统计学意义; IL-10-/-+BBf组的4 wk和6 wk间无显著性差异, 但较2 wk的有显著性差异(P = 0.0025, P = 0.0014), IL-10-/-+BBf组与IL-10-/-的炎症评分有显著性差异(P<0.0001, 图1).
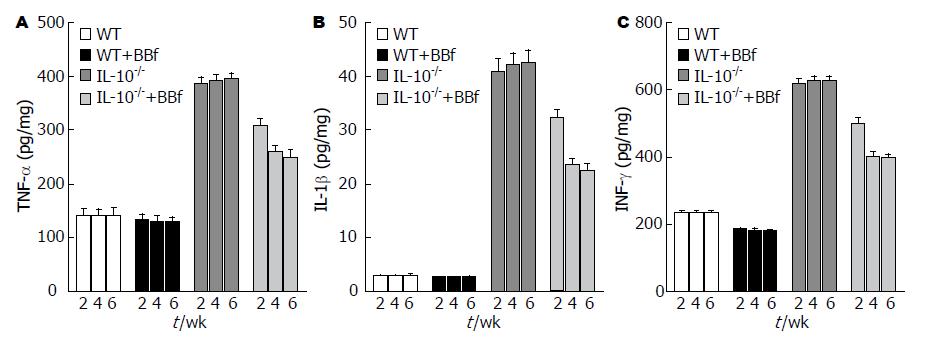
IL-10-/-组小鼠促炎细胞因子TNF-α、IL-1b和INF-g浓度较WT组显著增高(P<0.0001); BBf干预后, IL-10-/-+BBf组小鼠较IL-10-/-组TNF-α、IL-1b和INF-g浓度明显降低(P = 0.0031, P = 0.0023, P = 0.0025), 干预4 wk和6 wk间无统计学差异, 但较2 wk的均有显著性差异(P = 0.0085, P = 0.0047, 图2).
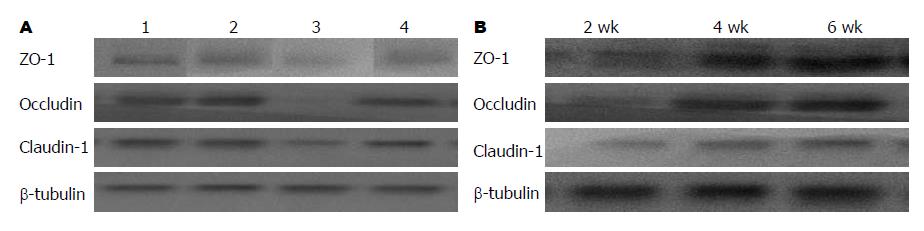
2.3.1 Western blot法检测结果: IL-10-/-组小鼠肠上皮细胞紧密连接蛋白ZO-1、occludin和claudin-1表达较WT组均出现下降; 而经B. bifidum干预治疗后, IL-10-/-+BBf组均较IL-10-/-组紧密连接蛋白ZO-1、occludin和claudin-1表达均显著增加; BBf干预4 wk和6 wk间无显著性差异, 但较2 wk均有显著性差异(图3).
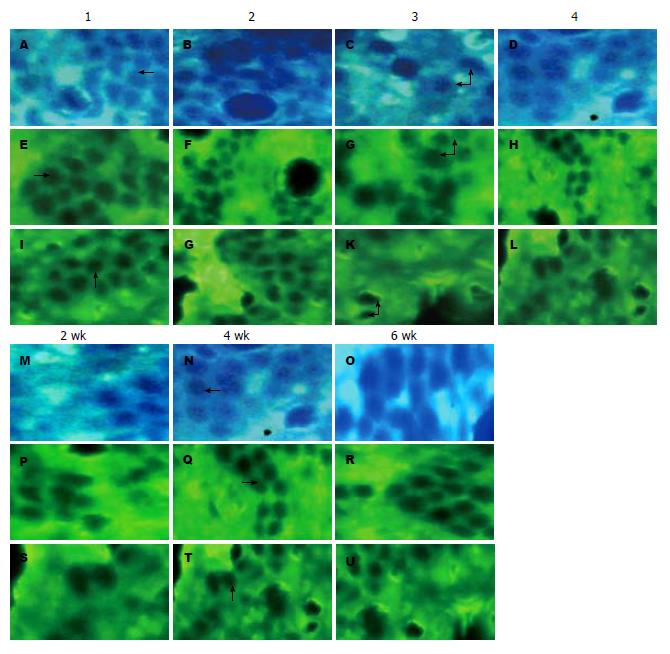
2.3.2 各组免疫荧光检测结果: WT组和WT+BBf组紧密连接蛋白ZO-1、occludin和claudin-1主要分布在肠上皮细胞顶膜, 呈连续性分布; IL-10-/-组小鼠则表现出紧密连接蛋白ZO-1、occludin和claudin-1在细胞顶膜的荧光强度减弱和不连续性分布, 而经B. bifidum干预治疗后, IL-10-/-+BBf组均较IL-10-/-组紧密连接蛋白ZO-1、occludin和claudin-1荧光强度增强, 分布较连续, 但均未达到正常水平; B. bifidum干预4 wk和6 wk间无明显差异, 但较2 wk的有一定的差异(图4).
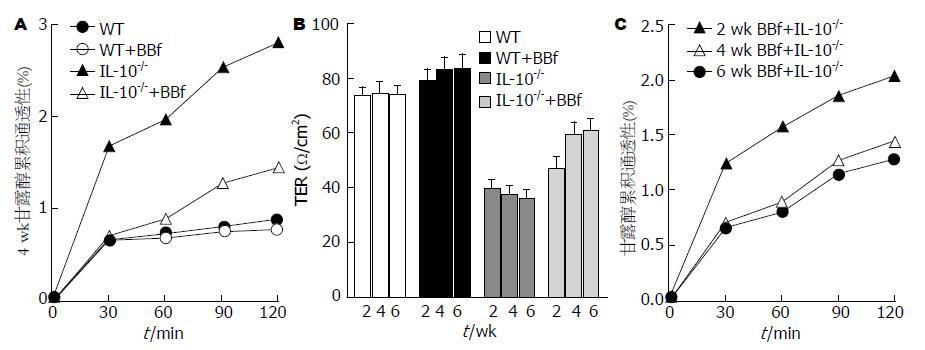
IL-10-/-组小鼠肠上皮细胞旁路对甘露醇的累积通透性明显高于WT组(2.28±0.27 vs 0.78±0.00, P = 0.0013, 图5A), 且TER出现了明显降低(37.47±3.59 vs 74.89±4.25, P<0.0001, 图5B); 而B. bifidum干预4 wk后, IL-10-/-+BBf组较IL-10-/-组的甘露醇累积通透性显著降低(1.08±0.16 vs 2.28±0.27, P = 0.0086, 图5A), TER明显增加(59.34±4.81 vs 37.47±3.59, P = 0.0025, 图5B); B. bifidum干预4 wk和6 wk间上述指标均无显著性差异, 但较2 wk的有显著性差异(P = 0.041, P = 0.021, 图5C).
近年来, 益生菌对IBS和IBD的治疗作用, 大多数学者已经认可. 但关于益生菌制剂的给药剂量、间隔时间和总疗程等问题, 尚未形成共识. B. bifidum是肠道内常见的益生菌, 对维持肠道的微生态平衡以及机体的健康起重要作用, 如降血脂、抗衰老、抗炎、抗感染、免疫调节作用、维持肠黏膜稳定等[9-11]. B. bifidum与肠黏膜屏障功能及IBD之间关系的研究越来越受广大国内外医学科学研究人员的重视[12-14]. 有文献报道[15,16]致病菌的存在刺激机体先天免疫应答并分泌大量促炎因子, 如: IL-1β、IL-6、IL-8、IL-18和TNF-α, 他们集中作用在肠道上皮细胞, 从而促进肠道炎症发展. 来自异常肠道菌群的大量抗原能透过受损的肠上皮细胞屏障持续刺激肠黏膜下免疫细胞, 引起肠上皮损伤, 导致肠炎的发生、发展. Preising等[6]的研究证实两歧双歧杆菌(B. bifidum S17)在体外研究中表现出较强的黏附性、抗炎能力. 耐氧性双歧杆菌(Bifidobacterium animalis)DN-173 010, 青春双歧杆菌属(Bifidobacterium adolescentis)DN-150 017, 或多形拟杆菌(Bacteroides thetaiotaomicron), 其中一种处理DCs, 通过减少CD4+效应T细胞增殖和IFN-γ的分泌刺激原始T细胞成熟和发挥其功能[17]. VSL#3[18](4种混合的乳酸菌, 包括LGG、3种双歧杆菌和一种链球菌)通过减少P38活性或其磷酸化调节IEC MAPK通路. Fujie等[19]在体内试验中证实使用短双歧杆菌(B. breve MCC-117)能有效防止大肠杆菌引起的肠道炎症. Laparra等[20]发现双歧杆菌能抑制麦醇溶蛋白诱发的细胞毒性, 并且抑制肠上皮细胞促炎症反应, 从而引起炎性标志物NF-kB、TNF-α和IL-1β明显降低, 可能对克罗恩病患者存在肠上皮屏障功能障碍有一定的修复作用. 在IL-10基因敲除诱导的UC模型小鼠中, 研究者发现双歧杆菌对结肠及盲肠炎症可以产生显著的降低作用, 并且可以降低促炎症因子IFN-γ、TNF-α及IL-12, 而抗炎因子TGF-β的水平保持不变[21]. 同样, McCarthy等[22]发现在IL-10基因敲除的IBD模型中, 用B. infantis及Lactobacillus. salivarius治疗可以降低上述3种促炎因子的水平. De Palma等[23]研究证实双歧杆菌(B. bifidum IATA-ES2和B. longum ATCC-15707)通过调节单核细胞吸收麦醇溶蛋白刺激反应的黏液并降低IFN-γ的浓度来降低Caco-2细胞屏障通透性, 影响炎性疾病的进程. 与Madsen等[24]研究结果相一致. 本研究发现IL-10-/-小鼠是存在肠道炎症表现, 表现为结肠黏膜溃疡、糜烂和大量中性粒细胞和淋巴细胞浸润; 而双歧杆菌干预后, IL-10-/-+BBf组小鼠仅表现为轻度中性粒细胞和淋巴细胞浸润, 同时IL-10-/-小鼠的促炎细胞因子TNF-α、IL-1β和INF-γ的浓度显著增高, 利用双歧杆菌治疗后上述3种促炎因子出现显著降低, 干预4 wk的较干预2 wk的降低有显著差异性, 而较干预6 wk的无显著性差异, 表明双歧杆菌能减轻肠道炎症, 但干预4 wk和6 wk的肠道炎症均未恢复到正常水平. 干预4 wk和2 wk比较, B. bifidum肠屏障保护作用较好, 增加干预周期至6 wk, 未检测到肠屏障保护作用增强.
目前大多数研究利用益生菌干预的时间选在4 wk左右, 金丹等[25]选用从健康幼儿粪便中分离的特定B. bifidum对小鼠进行处理4 wk后, 表明所用的双歧杆菌菌株减轻了DSS诱导的小鼠肠道炎症反应, 并且增强了肠道免疫细胞IL-10的表达及分泌. Whorwell等[26]的进一步研究表明, 持续4 wk的最适剂量的实验结果证实B. infantis 35624治疗IBS的最有效剂量为108 CFU/mL, 而IBS的所有特征都得到了显著性改变, 在治疗的最后阶段对IBS的全部特征进行评价, 发现益生菌的有效剂量治疗效果好于安慰剂大约20%. 燕善军[27]对84例IBS患者进行口服B. bifidum治疗, 研究结果发现, B. bifidum对IBS常见的腹痛、腹胀、排便频率异常及里急后重等主要症状有明显的改善作用, 治疗4 wk后效果更加明显. 本研究利用益生菌不同的干预周期(2、4和6 wk), 结果发现选用4 wk的干预时间是合理的; 同时延长给药干预的时间, 并没有相应的增加保护肠屏障作用的效果. 从而为临床用药时间提供一个参考, 但真正应用到临床, 还需要大量临床实验证明. Resta-Lenert等[28]发现, 乳酸菌和B. bifidum通过维护细胞骨架和ZO-1蛋白及occludin表达, 对表皮生长因子刺激作用增强, 修复EPEC引起的破坏作用. Qin等[29]研究证实, LP能通过增强紧密连接蛋白(ZO-1、claudin-1、occludin、JAMA-1)在细胞顶膜的表达来阻止EPEC对Caco-2细胞屏障功能的破坏作用. Chen等[30]研究发现LP干预IL-10-/-小鼠4 wk后促进紧密连接蛋白ZO-1、occludin、claudin-1和β-catenin的表达, 从而发挥其对肠屏障功能的修复作用. 本实验显示IL-10-/-小鼠肠上皮细胞紧密连接蛋白ZO-1、occludin和claudin-1表达较WT组均出现下降; 而经B. bifidum干预治疗后, 肠上皮细胞的上述3种紧密连接蛋白表达均显著增加, 因此肠上皮细胞间连接更加紧密, 肠道细胞屏障功能得到了保护.
本实验利用Ussing Chamber技术, 检测肠上皮TER和细胞旁路甘露醇通透性, 发现IL-10-/-组小鼠肠上皮细胞旁路对甘露醇的累积通透性明显高于WT组, 且TER出现了明显降低; 而B. bifidum干预后, IL-10-/-+BBf组较IL-10-/-组的甘露醇累积通透性显著降低, 细胞TER明显增加; B. bifidum干预4 wk和6 wk间上述指标无显著性差异, 但较2 wk的有显著性差异. 表明B. bifidum干预治疗炎症性小鼠后, 会明显增加肠上皮细胞TER和降低肠道上皮细胞的通透性, 从而起到了保护肠道屏障的功能.
总之, IL-10-/-小鼠是存在肠道炎症表现, 屏障功能障碍, 表现为肠上皮细胞间紧密连接超微结构破坏、肠上皮细胞TER降低和甘露醇通透性增加. B. bifidum干预后能明显减轻肠道炎症, 降低肠上皮细胞间通透性, 阻止肠上皮细胞及细胞间紧密连接超微结构的破坏; 降低促炎细胞因子TNF-α、IL-1β和INF-γ的浓度, 促进紧密连接蛋白ZO-1、occludin和claudin-1的表达, 从而发挥肠屏障功能的保护作用. 而B. bifidum干预4 wk和6 wk后均较干预2 wk后有在上述指标发现明显的差异, 而干预6 wk后较干预4 wk后的并没有在上述指标发现明显的差异.
目前需要益生菌干预的时间大多研究选在4 wk左右, 通过本研究证实, 延长给药干预的时间, 并没有相应的增加保护肠屏障作用的效果; 同时本实验再次证实益生菌B. bifidum具有保护IL-10基因敲除小鼠结肠上皮屏障的作用.
微生态制剂, 包括益生菌及其代谢产物和生长促进因子. 目前已被确认的几种益生菌有双歧杆菌、嗜酸乳杆菌、粪肠球菌、鼠李糖乳杆菌等. 益生菌利用他们在人体中形成优势菌群, 对致病菌进行抑制, 从而减少疾病的发生. 同时, 益生菌在发酵过程中产生的复合代谢物以及多种营养物质, 促使人体肠道微生态达到平衡. 微生态制剂在临床已广泛用于改善肠道功能, 预防和治疗腹泻; 治疗肠易激综合征及炎症性肠病; 预防和治疗泌尿生殖系统感染; 增强人体免疫力;缓解变态反应等, 取得了良好的临床效果.
杨桦, 教授, 重庆市第三军医大学新桥医院
肠杆菌-双歧杆菌穿梭质粒载体(pBBAD-Xs), 将重组人白介素-10(hIL-10)基因克隆入该表达载体, 筛选并鉴定携带hIL-10的分泌型转基因双歧杆菌(BL-hIL-10), 通过体内和体外试验, 验证所分泌的hIL-10蛋白是否具有生物学活性和治疗功能, 探索B.BL-hIL-10治疗溃疡性结肠炎的相关机制研究.
Preising等的研究证实两歧双歧杆菌(B. bifidumS17)在体外表现出较强的粘附性、抗炎能力. De Palma等研究证实B. bifidum通过降低IFN-γ的浓度来降低Caco-2细胞屏障通透性, 影响炎性疾病的进程.
目前大多数研究利用益生菌干预的时间选在4 wk左右, 本研究利用益生菌不同的干预周期(2、4和6 wk), 结果发现选用4 wk的干预时间是合理的; 同时延长给药干预时间, 并没有相应的改善保护肠屏障作用的效果.
目前选用的益生菌干预时间大多在4 wk左右, 通过本研究证实, 延长给药干预时间, 并没有相应的改善保护肠屏障作用的效果, 从而为临床用药时间提供参考.
肠易激综合征: 一种以腹痛或腹部不适伴排便习惯改变为特征的胃肠功能性疾病, 病理生理学基础是胃肠动力障碍和内脏感知异常.
本文有一定的创新性, 通过IL-10基因敲除小鼠研究了微生态制剂益生菌双歧杆菌不同的干预周期对结肠肠黏膜屏障功能的保护作用, 研究设计合理, 讨论条理较清楚.
编辑: 翟欢欢 电编:鲁亚静
| 1. | 秦 环龙, 梁 勇. 肠道微生态变化及临床应用. 中国普外基础与临床杂志. 2011;18:1237-1241. |
| 2. | Kennedy RJ, Hoper M, Deodhar K, Erwin PJ, Kirk SJ, Gardiner KR. Interleukin 10-deficient colitis: new similarities to human inflammatory bowel disease. Br J Surg. 2000;87:1346-1351. [PubMed] [DOI] |
| 3. | Madsen KL, Malfair D, Gray D, Doyle JS, Jewell LD, Fedorak RN. Interleukin-10 gene-deficient mice develop a primary intestinal permeability defect in response to enteric microflora. Inflamm Bowel Dis. 1999;5:262-270. [PubMed] [DOI] |
| 4. | Madsen KL. Inflammatory bowel disease: lessons from the IL-10 gene-deficient mouse. Clin Invest Med. 2001;24:250-257. [PubMed] |
| 5. | Madsen K, Cornish A, Soper P, McKaigney C, Jijon H, Yachimec C, Doyle J, Jewell L, De Simone C. Probiotic bacteria enhance murine and human intestinal epithelial barrier function. Gastroenterology. 2001;121:580-591. [PubMed] [DOI] |
| 6. | Preising J, Philippe D, Gleinser M, Wei H, Blum S, Eikmanns BJ, Niess JH, Riedel CU. Selection of bifidobacteria based on adhesion and anti-inflammatory capacity in vitro for amelioration of murine colitis. Appl Environ Microbiol. 2010;76:3048-3051. [PubMed] [DOI] |
| 7. | McCafferty DM, Miampamba M, Sihota E, Sharkey KA, Kubes P. Role of inducible nitric oxide synthase in trinitrobenzene sulphonic acid induced colitis in mice. Gut. 1999;45:864-873. [PubMed] [DOI] |
| 8. | Zeissig S, Bürgel N, Günzel D, Richter J, Mankertz J, Wahnschaffe U, Kroesen AJ, Zeitz M, Fromm M, Schulzke JD. Changes in expression and distribution of claudin 2, 5 and 8 lead to discontinuous tight junctions and barrier dysfunction in active Crohn's disease. Gut. 2007;56:61-72. [PubMed] [DOI] |
| 9. | Rhee YK, Han MJ, Choi EC, Kim DH. Hypocholesterolemic activity of Bifidobacteria isolated from a healthy Korean. Arch Pharm Res. 2002;25:681-684. [PubMed] [DOI] |
| 10. | Hart AL, Lammers K, Brigidi P, Vitali B, Rizzello F, Gionchetti P, Campieri M, Kamm MA, Knight SC, Stagg AJ. Modulation of human dendritic cell phenotype and function by probiotic bacteria. Gut. 2004;53:1602-1609. [PubMed] [DOI] |
| 11. | Sekine K, Ohta J, Onishi M, Tatsuki T, Shimokawa Y, Toida T, Kawashima T, Hashimoto Y. Analysis of antitumor properties of effector cells stimulated with a cell wall preparation (WPG) of Bifidobacterium infantis. Biol Pharm Bull. 1995;18:148-153. [PubMed] [DOI] |
| 12. | Wang Z, Xiao G, Yao Y, Guo S, Lu K, Sheng Z. The role of bifidobacteria in gut barrier function after thermal injury in rats. J Trauma. 2006;61:650-657. [PubMed] [DOI] |
| 13. | Ruan X, Shi H, Xia G, Xiao Y, Dong J, Ming F, Wang S. Encapsulated Bifidobacteria reduced bacterial translocation in rats following hemorrhagic shock and resuscitation. Nutrition. 2007;23:754-761. [PubMed] [DOI] |
| 14. | Ruiz PA, Hoffmann M, Szcesny S, Blaut M, Haller D. Innate mechanisms for Bifidobacterium lactis to activate transient pro-inflammatory host responses in intestinal epithelial cells after the colonization of germ-free rats. Immunology. 2005;115:441-450. [PubMed] [DOI] |
| 15. | Moue M, Tohno M, Shimazu T, Kido T, Aso H, Saito T, Kitazawa H. Toll-like receptor 4 and cytokine expression involved in functional immune response in an originally established porcine intestinal epitheliocyte cell line. Biochim Biophys Acta. 2008;1780:134-144. [PubMed] |
| 16. | Blumberg RS. Inflammation in the intestinal tract: pathogenesis and treatment. Dig Dis. 2009;27:455-464. [PubMed] [DOI] |
| 17. | Baba N, Samson S, Bourdet-Sicard R, Rubio M, Sarfati M. Commensal bacteria trigger a full dendritic cell maturation program that promotes the expansion of non-Tr1 suppressor T cells. J Leukoc Biol. 2008;84:468-476. [PubMed] [DOI] |
| 18. | Jijon H, Backer J, Diaz H, Yeung H, Thiel D, McKaigney C, De Simone C, Madsen K. DNA from probiotic bacteria modulates murine and human epithelial and immune function. Gastroenterology. 2004;126:1358-1373. [PubMed] [DOI] |
| 19. | Fujie H, Villena J, Tohno M, Morie K, Shimazu T, Aso H, Suda Y, Shimosato T, Iwabuchi N, Xiao JZ. Toll-like receptor-2-activating bifidobacteria strains differentially regulate inflammatory cytokines in the porcine intestinal epithelial cell culture system: finding new anti-inflammatory immunobiotics. FEMS Immunol Med Microbiol. 2011;63:129-139. [PubMed] [DOI] |
| 20. | Laparra JM, Sanz Y. Bifidobacteria inhibit the inflammatory response induced by gliadins in intestinal epithelial cells via modifications of toxic peptide generation during digestion. J Cell Biochem. 2010;109:801-807. [PubMed] |
| 21. | Quigley EM. Prebiotics and probiotics; modifying and mining the microbiota. Pharmacol Res. 2010;61:213-218. [PubMed] [DOI] |
| 22. | McCarthy J, O'Mahony L, O'Callaghan L, Sheil B, Vaughan EE, Fitzsimons N, Fitzgibbon J, O'Sullivan GC, Kiely B, Collins JK. Double blind, placebo controlled trial of two probiotic strains in interleukin 10 knockout mice and mechanistic link with cytokine balance. Gut. 2003;52:975-980. [PubMed] [DOI] |
| 23. | De Palma G, Cinova J, Stepankova R, Tuckova L, Sanz Y. Pivotal Advance: Bifidobacteria and Gram-negative bacteria differentially influence immune responses in the proinflammatory milieu of celiac disease. J Leukoc Biol. 2010;87:765-778. [PubMed] [DOI] |
| 24. | Madsen KL, Doyle JS, Jewell LD, Tavernini MM, Fedorak RN. Lactobacillus species prevents colitis in interleukin 10 gene-deficient mice. Gastroenterology. 1999;116:1107-1114. [PubMed] [DOI] |
| 26. | Whorwell PJ, Altringer L, Morel J, Bond Y, Charbonneau D, O'Mahony L, Kiely B, Shanahan F, Quigley EM. Efficacy of an encapsulated probiotic Bifidobacterium infantis 35624 in women with irritable bowel syndrome. Am J Gastroenterol. 2006;101:1581-1590. [PubMed] [DOI] |
| 28. | Resta-Lenert S, Smitham J, Barrett KE. Epithelial dysfunction associated with the development of colitis in conventionally housed mdr1a-/- mice. Am J Physiol Gastrointest Liver Physiol. 2005;289:G153-G162. [PubMed] [DOI] |
| 29. | Qin HL, Zhang ZW, Hang XM, Jiang YQ. plantarum prevents enteroinvasive Escherichia coli-induced tight junction proteins changes in intestinal epithelial cells. BMC Microbiol. 2009;9:63. [PubMed] [DOI] |
| 30. | Chen HQ, Yang J, Zhang M, Zhou YK, Shen TY, Chu ZX, Zhang M, Hang XM, Jiang YQ, Qin HL. Lactobacillus plantarum ameliorates colonic epithelial barrier dysfunction by modulating the apical junctional complex and PepT1 in IL-10 knockout mice. Am J Physiol Gastrointest Liver Physiol. 2010;299:G1287-G1297. [PubMed] [DOI] |