修回日期: 2012-10-23
接受日期: 2012-11-07
在线出版日期: 2012-11-28
目的: 探讨黄芩苷对肝癌细胞缝隙连接细胞间通讯(gap junction intercellular communication, GJIC)及细胞间隙连接蛋白26(connexion26, Cx26)、细胞间隙连接蛋白43(connexion43, Cx43)表达的影响.
方法: 人肝癌细胞株SMMC-7721分为黄芩苷10、20、40 mg/L组和对照组. 划痕染料示踪技术检测GJIC的变化. 用RT-PCR法检测肝癌细胞Cx26、Cx43基因表达, 用Western blot法检测Cx26蛋白表达, 用免疫细胞化学检测Cx43蛋白表达.
结果: 对照组细胞的染料局限于划痕两侧的细胞内, 无明显的荧光染料传输现象. 随着黄芩苷浓度的增强, LY染料传输范围逐渐增大. 黄芩苷10、20、40 mg/L各浓度组Cx26 mRNA表达水平与对照组比较显著提高(0.148±0.111, 10.253±0.222, 17.283±0.024 vs 0.138±0.111; P<0.05). Cx26蛋白表达量与对照组比较明显增加(0.516±0.029, 0.759±0.020, 1.019±0.076 vs 0.367±0.029; P<0.05). 黄芩苷各浓度组Cx43 mRNA表达量与对照组比较无显著变化. 而Cx43蛋白的表达水平与对照组比较明显增加(5.512±0.003, 5.844±0.046, 6.216±0.015 vs 4.316±0.032; P<0.05).
结论: 黄芩苷促进肝癌细胞Cx26及Cx43表达, 导致肝癌细胞GJIC功能的恢复, 这很可能是黄芩苷抑制肿瘤生长的分子机制之一.
引文著录: 郭昱, 王娜, 高咏梅, 姚金锋, 李元, 尹崇娇, 张文娟. 黄芩苷对肝癌细胞GJIC及Cx26、Cx43表达的影响. 世界华人消化杂志 2012; 20(33): 3197-3202
Revised: October 23, 2012
Accepted: November 7, 2012
Published online: November 28, 2012
AIM: To investigate the effect of treatment with baicalin on the expression of connexion 26 (Cx26) and connexion 43 (Cx43) in human hepatocellular cell line SMMC-7721.
METHODS: SMMC-7721 cells were randomly divided into 4 groups: normal control group, low-dose (10 mg/L) baicalin group, medium-dose (20 mg/L) baicalin group, and high-dose (40 mg/L) baicalin group. Gap junction intercellular communication (GJIC) was measured by scrap loading/dye transfer assay (SL/DT). The expression of Cx26 and Cx43 mRNAs in SMMC-7721 cells was determined by RT-PCR. The expression of Cx26 protein was detected by Western blot, and that of Cx43 protein was detected by immunohistochemistry.
RESULTS: Compared to the normal control group, the expression of Cx26 mRNA and protein was significantly enhanced in SMMC-7721 cells treated with low, medium and high concentrations of baicalin (mRNA: 0.148 ± 0.111, 10.253 ± 0.222, 17.283 ± 0.024 vs 0.138 ± 0.111; all P < 0.05; protein: 0.516 ± 0.029, 0.759 ± 0.020, 1.019 ± 0.076 vs 0.367 ± 0.029; all P < 0.05). Compared to the normal control group, the expression of Cx43 mRNA showed no significant changes, but the expression of Cx43 protein was significantly enhanced in SMMC-7721 cells treated with different concentrations of baicalin.
CONCLUSION: Restoration or enhancement of GJIC induced by up-regulation of Cx26 and Cx43 is likely to be an important molecular mechanism by which baicalin inhibits tumor growth.
- Citation: Guo Y, Wang N, Gao YM, Yao JF, Li Y, Yin CJ, Zhang WJ. Treatment with baicalin up-regulates the expression of connexion 26 and connexion 43 in human hepatocellular carcinoma cell line SMMC-7721. Shijie Huaren Xiaohua Zazhi 2012; 20(33): 3197-3202
- URL: https://www.wjgnet.com/1009-3079/full/v20/i33/3197.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i33.3197
黄芩苷为传统中药黄芩的主要有效成分, 具有广泛的药理活性, 除传统意义上的抗炎、抗病毒以及解热和保肝作用外, 近年来发现其具有显著的抗肿瘤效应[1-4]. 我们以往的系列研究发现黄芩苷能抑制肝癌细胞增殖, 诱导肝癌细胞分化, 且具有抗侵袭、抗黏附作用[5-7]. 缝隙连接蛋白介导的缝隙连接细胞间通讯(gap junction intercellular communication, GJIC)是细胞间最重要的信息交流形式. 缝隙连接在多种肿瘤中常发生异常改变, 与肿瘤的发生、转移等密切相关, 是目前抗肿瘤药物治疗的新靶点[8-13]. 本研究旨在观察黄芩苷对肝癌细胞GJIC及缝隙连接蛋白26(connexion26, Cx26)、缝隙连接蛋白43(connexion43, Cx43)表达的影响.
人肝癌SMMC-7721细胞株由河北医科大学药理学实验室惠赠; 黄芩苷购自成都曼斯特生物科技有限公司; 罗氏黄(lucifer yellow, LY)购自美国Sigma公司; 山羊抗Cx26多克隆抗体购自美国Santa Cruz公司; 兔抗Cx43多克隆抗体购自Bioworld公司; 免疫组织化学染色试剂盒购自北京中杉金桥生物技术有限公司; 逆转录酶AMV购自美国Promega公司; DNA marker购自北京赛百盛基因有限公司; Cx26引物设计检索文献依据检索结果, 由赛百盛公司合成与纯化.
1.2.1 细胞培养: 将人肝癌细胞株SMMC-7721接种于RPMI 1640培养液中, 内含100 μg/mL链霉素、100 U/mL青霉素、10%胎牛血清, 37 ℃、50 mL/L CO2, 恒温密闭式孵箱内培养, 2-3 d后细胞融合达到80%-90%时, 用37 ℃预热的消化液消化3-5 min即可, 传代比例为1:2或1:3.
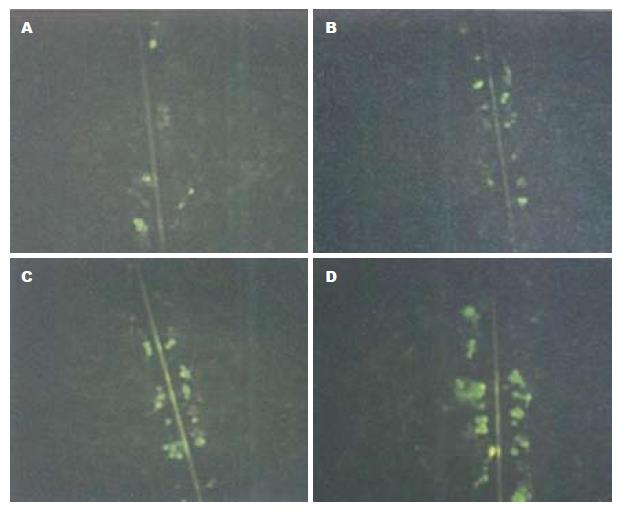
1.2.2 黄芩苷处理及GJIC变化检测: 传代后将人肝癌细胞株SMMC-7721以2×105个/mL接种于培养皿中, 每皿2 mL, 24 h后分为4组, 分别加入黄芩苷至终浓度10、20、40 mg/L, 设空白对照组. 细胞继续培养48 h后吸出培养液, PBS冲洗培养皿3次, 加入1 mL 0.5 g/L的LY染料, 用手术刀在培养皿表面作3道划痕, 室温静置3 min, 吸除染料, 再用PBS冲洗除去多余染料, 滴加少许PBS, 荧光倒置显微镜下观察染料在划痕垂直方向上的迁移距离, 每组实验重复3次. 半定量结果判定: 罗氏黄通过缝隙连接(gap junctions, GJ)传递, 在蓝色激发光下显绿色荧光. 荧光只出现划痕旁1列细胞中(-), 出现在划痕旁2列细胞中(+), 3列中(++), 4列或更远(+++).
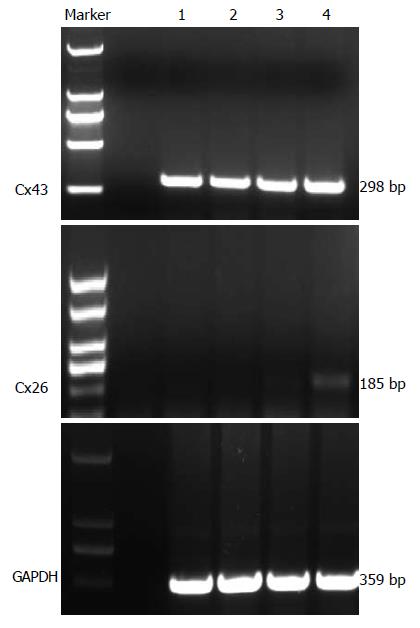
1.2.3 Cx26、Cx43 mRNA表达分析: 将细胞以密度为5×104/mL接种于细胞培养瓶, 作用48 h后收集细胞, 每1×107个细胞加入TRIzol 1 mL提取总的RNA, 按照逆转录试剂盒说明书进行逆转录. Cx26正义: 5'-GCTGCAAGAACGTGTGCTAC-3', 反义: 5'-TGGGTTTTGATCTCCTCGAT-3', 扩增的目的片段长度为185 bp, PCR的具体循环参数为: 94 ℃ 2 min; 94 ℃ 30 s; 56 ℃ 40 s; 58 ℃ 30 s, 经过35个循环, 以后72 ℃延伸10 min. Cx43正义: 5'-GGCTGCTCCTCACCAACCGC-3', 反义: 5'-GCTGGCTCTGCTTGAAGGTCG-3', 扩增的目的片段长度为298 bp, PCR的具体循环参数为: 94 ℃ 4 min; 94 ℃ 30 s; 58 ℃ 30 s; 72 ℃ 30 s, 经过35个循环, 以后72 ℃延伸10 min. GAPDH正义: 5'-CAAGGTCATCCATGACAACTTTG-3', 反义: 5'-GTCCACCACCCTGTTGCTGTAG-3', 扩增的目的片段长度为359 bp, PCR的具体循环参数为: 95 ℃ 5 min; 94 ℃ 30 s; 54 ℃ 45 s; 72 ℃ 30 s, 循环33次, 以后72 ℃延伸1 min. 用美国ST公司AlphaImagerTM 1200型读胶仪分析灰度值, 以目标基因与GAPDH扩增产物的灰度值的比值来表示基因表达水平.
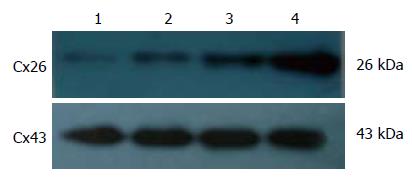
1.2.4 Western blot法检测Cx26蛋白表达: 黄芩苷作用48 h后收集分别提取对照细胞和加药作用后细胞总蛋白, 加入细胞裂解液, 冰上静置0.5-1.0 h, 4 ℃, 12 000 r/min离心15 min后, 取其上清液分装, -80 ℃冰箱保存备用. 将蛋白煮沸变性后, 经SDS-PAGE凝胶电泳将蛋白转移至NC膜上, 脱脂奶粉封闭1 h, 与山羊抗Cx26多克隆抗体稀释浓度为(1:500)4 ℃冰箱过夜, 再加入(1:1 000)比例稀释的二抗, 与化学发光试剂ECL于暗室中进行反应, 待胶片爆光显影后分析结果. 采用美国Image JA软件对Western blot结果进行定量分析, 灰度值以累积吸光度值表示, 结果以目的蛋白与β-actin的累积吸光度的比值表示.
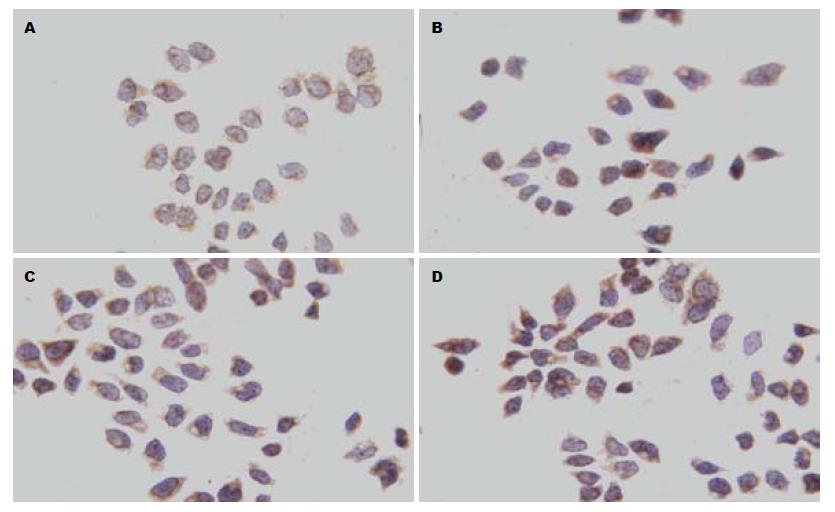
1.2.5 Cx43蛋白的表达分析: 各组细胞干预48 h后, 收集细胞爬片, 4 ℃多聚甲醛固定30 min, 按SP免疫组织化学试剂盒实验步骤进行, 然后DAB显色, 封片后用JEDA-801D形态学图像分析系统自动选取染为棕黄色的阳性区域计算积分吸光度值, 反映蛋白表达量的变化.
统计学处理 用SPSS13.0软件统计分析, 所有计量资料数据均采用mean±SD, 同一个指标的各组间比较采用单因素方差分析, P<0.05表示差异有显著性.
细胞处理48 h后, 对照组细胞的荧光染料局限于划痕两侧的细胞内, 无明显的荧光染料传输现象, GJIC半定量(-), 黄芩苷10 mg/L组半定量为(+), 20 mg/L组半定量为(++), 40 mg/L组半定量为(+++), 结果显示随着黄芩苷浓度的增强, LY染料传输范围逐渐增大, SMMC-7721肝癌细胞GJIC功能逐渐增强, 呈剂量依赖关系(图1).
黄芩苷各处理组Cx26 mRNA表达量明显高于对照组, 且随着黄芩苷浓度的增加表达量随之增加, 有明显的剂量依赖关系(图2, 表1, P<0.05). 黄芩苷组各处理组Cx43 mRNA表达量与对照组比较有增加的趋势, 但差异无显著性.
Western blot分析显示, 不同浓度黄芩苷作用于肝癌细胞SMMC-7721 48 h后, Cx26蛋白表达水平增高, 有明显的剂量依赖关系(图3, 表2, P<0.05).
GJIC是相邻细胞间普遍存在的直接通讯方式. 对细胞的新陈代谢及许多生理过程(如增殖、凋亡、转移等)发挥着重要的调节作用. GJIC在几乎所有的实体瘤中表达下调或丧失[14-18], Krutovskikh等[19]用致癌剂诱导建立大鼠肝癌模型, 发现肝癌细胞与癌周组织细胞间无细胞间通讯活动存在. 既然多数肿瘤组织中存在瘤细胞之间或瘤细胞与正常细胞之间的通讯功能障碍, 推测如果恢复GJIC功能有可能逆转瘤细胞表型使之良性化. 恢复GJIC可以通过以下机制达到肿瘤治疗的目的: (1)直接抑制细胞增殖, 有学者将Cx26转染肿瘤细胞, GJIC功能恢复表现出肿瘤生长的抑制和转化表型抑制; (2)增加肿瘤细胞对化疗药物的敏感. 药物通过缝隙连接运送到远处细胞, 这样使药物在肿瘤组织中弥散, 增强了化疗效果[20]; (3)许多肿瘤实验中自杀基因有明显的旁观者效应, 增强旁观者效应可以通过缝隙连接发挥间接杀瘤作用[21,22].
GJIC的物质基础是相邻细胞膜上连接子耦联形成的通讯通道, 只允许相对分子质量<1 000 000物质通过, 每个连接子含6个连接蛋白(connexon, Cx). Cx是一个较保守的蛋白家族, 至今在人类中已经发现21种, 依据相对分子质量命名, 如Cx26、Cx32、Cx43等. Cx的表达与肿瘤的生物学全过程包括细胞转化、肿瘤发生、生长及演进等都密切相关, 被誉为"第二类抑癌基因"[23-25]. Cx26、Cx43是重要的缝隙连接通道蛋白, Cx43是间隙连接家族中分布最广的分子, 几乎对所有组织细胞具有生长调控的作用, 其功能也最为复杂和重要. 许多肿瘤如大肠癌、神经胶质瘤、胃癌、肝癌、乳腺癌等均显示Cx26、Cx43表达减少或缺失, 而且表达水平和肿瘤分级成反比. Cx26在正常肝组织的表达高于其在肝癌组织中的表达, 在高分化组织中的表达高于其在低分化组织中的表达, 提示Cx26表达可能与肝癌的分化程度有关[26]. 上调Cx蛋白的表达, 恢复细胞间缝隙连接通讯可抑制肿瘤的生长和转移[27]. Muramatsu等[28]在人肝细胞癌中转染Cx26基因, 研究发现其表达可抑制癌细胞的增殖, 甚至进一步引起细胞的凋亡. 有趣的是因Cx26基因转染而"正常化"的肝癌Hela细胞再次转入突变的Cx26 cDNA, 细胞表型重新"恶化".
有研究结果显示胃癌组织中Cx43表达减少或缺失, 并随细胞分化程度的下降而表达降低, Cx43表达阴性者更易发生淋巴结转移. 因此, Cx43表达下降或缺失对判断胃癌预后有一定的价值[29]. Zhu等[30]组成的研究小组将Cx43 cDNA转染神经胶质瘤细胞C6提高该细胞Cx43蛋白的表达水平, 结果发现在导致C6细胞增值率降低的同时部分细胞的胞质中出现了肌动蛋白张力丝, 且细胞体积变大、形态扁平, 恶性表型特征变模糊, 有向良性转化的趋势.
已有大量研究发现某些物质如绿茶提取物、类胡萝卜素、类维生素A、维甲酸、姜黄素等通过上调靶组织Cx表达, 促进GJIC恢复, 发挥抑制肿瘤生长作用[26]. 但黄芩苷对GJIC功能及Cx表达的影响尚未见文献报道. 本实验研究结果显示肝癌细胞间无GJIC, 黄芩苷能促进肝癌细胞GJIC恢复. Cx在翻译、转录或者转录后的蛋白水平的几个过程中均可以调控GJIC的状态. 黄芩苷能提高Cx26 mRNA及蛋白表达, 并与浓度呈剂量依赖关系, 从而认为黄芩苷对Cx26的作用靶点可能是在转录水平. 黄芩苷对肝癌细胞Cx43 mRNA的表达无明显影响, 而免疫组织化学研究结果证实在SMMC-7721肝癌细胞中, Cx43蛋白定位于细胞浆, 随着黄芩苷浓度的增加Cx43蛋白表达也随之增加. 故推测黄芩苷对Cx43作用靶点可能在Cx43转录后水平.
因此, 可以认为黄芩苷通过促进Cx的表达, 而建立细胞间GJ通道, 从而恢复细胞的GJIC功能, 可能是其抗肿瘤作用机制之一.
黄芩苷是传统中药黄芩的主要有效成分之一, 具有抗炎、抗变态反应、抗肿瘤等多种药理作用. 本课题组以往的系列研究显示黄芩苷可以抑制肝癌细胞增殖, 诱导其凋亡, 但其作用机制是否通过影响缝隙连接细胞间通讯(GJIC)尚无报道.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院干细胞与组织器官工程研究中心
细胞间隙连接蛋白(Cx)是存在于细胞之间的负责物质及信息交换的通道蛋白, 对细胞增殖、分化及机体的生长发育至关重要. Cx的正常或异常表达, 可直接影响到细胞及组织、器官的功能状态, 最新研究发现他与肿瘤的发生发展密切相关.
1991年, Eghbali等率先报道将Cx32 cDNA转染人肝癌细胞株后,使细胞GJIC状态由"无"转为"正常化", 同时细胞生长明显受到抑制.
本研究首次从黄芩苷对肝癌细胞GJIC的影响方面探讨黄芩苷抗肿瘤的作用机制. 他克服了传统肿瘤治疗中单一追求彻底杀死瘤细胞的指导思想, 丰富和完善了抗肿瘤理论.
本研究结果进一步加深了对黄芩苷抗肿瘤作用机制的认识, 对其开发应用提供了理论基础.
间隙连接细胞间通讯(GJIC): 生物体内相邻细胞间主要通过细胞间隙连接通道互相传递离子、代谢物质极小的信号分子等, 从而控制细胞间的协调生长. 这种由间隙连接介导的细胞间物质、能量及信息的交换活动称为间隙连接细胞间通讯.
本研究结果有一定创新性, 具有较高的学术价值.
编辑: 翟欢欢 电编:鲁亚静
| 1. | Zheng J, Hu JD, Chen YY, Chen BY, Huang Y, Zheng ZH, Liu TB. Baicalin induces apoptosis in leukemia HL-60/ADR cells via possible down-regulation of the PI3K/Akt signaling pathway. Asian Pac J Cancer Prev. 2012;13:1119-1124. [PubMed] [DOI] |
| 2. | Chen WC, Kuo TH, Tzeng YS, Tsai YC. Baicalin induces apoptosis in SW620 human colorectal carcinoma cells in vitro and suppresses tumor growth in vivo. Molecules. 2012;17:3844-3857. [PubMed] [DOI] |
| 3. | Zhang X, Tang X, Liu H, Li L, Hou Q, Gao J. Autophagy induced by baicalin involves downregulation of CD147 in SMMC-7721 cells in vitro. Oncol Rep. 2012;27:1128-1134. [PubMed] |
| 4. | Chiu YW, Lin TH, Huang WS, Teng CY, Liou YS, Kuo WH, Lin WL, Huang HI, Tung JN, Huang CY. Baicalein inhibits the migration and invasive properties of human hepatoma cells. Toxicol Appl Pharmacol. 2011;255:316-326. [PubMed] [DOI] |
| 8. | Sun P, Liu Y, Ying H, Li S. Action of db-cAMP on the bystander effect and chemosensitivity through connexin 43 and Bcl-2-mediated pathways in medulloblastoma cells. Oncol Rep. 2012;28:969-976. [PubMed] |
| 9. | Czyż J, Szpak K, Madeja Z. The role of connexins in prostate cancer promotion and progression. Nat Rev Urol. 2012;9:274-282. [PubMed] [DOI] |
| 10. | Ding L, Hu HG, Zheng S. [Effects of osteopontin on gap junctional intercellular communication in colon cancer cell lines]. Zhonghua Yixue Zazhi. 2011;91:2578-2581. [PubMed] |
| 11. | Hao J, Zhang C, Zhang A, Wang K, Jia Z, Wang G, Han L, Kang C, Pu P. miR-221/222 is the regulator of Cx43 expression in human glioblastoma cells. Oncol Rep. 2012;27:1504-1510. [PubMed] |
| 12. | Bodenstine TM, Vaidya KS, Ismail A, Beck BH, Diers AR, Edmonds MD, Kirsammer GT, Landar A, Welch DR. Subsets of ATP-sensitive potassium channel (KATP) inhibitors increase gap junctional intercellular communication in metastatic cancer cell lines independent of SUR expression. FEBS Lett. 2012;586:27-31. [PubMed] [DOI] |
| 13. | Hong X, Wang Q, Yang Y, Zheng S, Tong X, Zhang S, Tao L, Harris AL. Gap junctions propagate opposite effects in normal and tumor testicular cells in response to cisplatin. Cancer Lett. 2012;317:165-171. [PubMed] [DOI] |
| 14. | Yu SC, Xiao HL, Jiang XF, Wang QL, Li Y, Yang XJ, Ping YF, Duan JJ, Jiang JY, Ye XZ. Connexin 43 reverses malignant phenotypes of glioma stem cells by modulating E-cadherin. Stem Cells. 2012;30:108-120. [PubMed] [DOI] |
| 15. | Zhang X, Liu Y, Si YJ, Chen XH, Li ZJ, Gao L, Gao L, Zhang C. Effect of Cx43 gene-modified leukemic bone marrow stromal cells on the regulation of Jurkat cell line in vitro. Leuk Res. 2012;36:198-204. [PubMed] [DOI] |
| 16. | Baltaziak M, Kańczuga-Koda L, Rutkowski R, Musiatowicz M, Koda M, Leśniewicz R, Sulkowska U, Baltaziak M, Leśniewicz T, Sulkowski S. [Gap junction intercellular communication in carcinogenesis of endometrial cancer]. Ginekol Pol. 2011;82:520-524. [PubMed] |
| 17. | Bernzweig J, Heiniger B, Prasain K, Lu J, Hua DH, Nguyen TA. Anti-breast cancer agents, quinolines, targeting gap junction. Med Chem. 2011;7:448-453. [PubMed] [DOI] |
| 18. | Losa D, Chanson M, Crespin S. Connexins as therapeutic targets in lung disease. Expert Opin Ther Targets. 2011;15:989-1002. [PubMed] [DOI] |
| 19. | Krutovskikh VA, Troyanovsky SM, Piccoli C, Tsuda H, Asamoto M, Yamasaki H. Differential effect of subcellular localization of communication impairing gap junction protein connexin43 on tumor cell growth in vivo. Oncogene. 2000;19:505-513. [PubMed] [DOI] |
| 20. | Bier A, Oviedo-Landaverde I, Zhao J, Mamane Y, Kandouz M, Batist G. Connexin43 pseudogene in breast cancer cells offers a novel therapeutic target. Mol Cancer Ther. 2009;8:786-793. [PubMed] [DOI] |
| 21. | Huang Q, Liu XZ, Kang CS, Wang GX, Zhong Y, Pu PY. The anti-glioma effect of suicide gene therapy using BMSC expressing HSV/TK combined with overexpression of Cx43 in glioma cells. Cancer Gene Ther. 2010;17:192-202. [PubMed] [DOI] |
| 22. | Liu X, Wu J, Zhang S, Li C, Huang Q. Novel strategies to augment genetically delivered immunotoxin molecular therapy for cancer therapy. Cancer Gene Ther. 2009;16:861-872. [PubMed] [DOI] |
| 23. | Shishido SN, Nguyen TA. Gap junction enhancer increases efficacy of Cisplatin to attenuate mammary tumor growth. PLoS One. 2012;7:e44963. [PubMed] [DOI] |
| 24. | Ionta M, Rosa MC, Almeida RB, Freitas VM, Rezende-Teixeira P, Machado-Santelli GM. Retinoic acid and cAMP inhibit rat hepatocellular carcinoma cell proliferation and enhance cell differentiation. Braz J Med Biol Res. 2012;45:721-729. [PubMed] [DOI] |
| 25. | Hagemann IS, Pasha TL, Roberts SA, Yum SW, Zhang PJ. Aberrant connexin 43 and 26 expression in cervical dysplasia. Anal Quant Cytol Histol. 2012;34:28-40. [PubMed] |
| 26. | 李 学东, 尚 西亮, 刘 锡文, 黄 长文, 傅 华群. 三七总皂甙对人肝癌细胞缝隙连接细胞间通讯的调节机制. 中国组织工程研究与临床康复. 2007;38:7609-7612. |
| 27. | Govindarajan R, Chakraborty S, Johnson KE, Falk MM, Wheelock MJ, Johnson KR, Mehta PP. Assembly of connexin43 into gap junctions is regulated differentially by E-cadherin and N-cadherin in rat liver epithelial cells. Mol Biol Cell. 2010;21:4089-4107. [PubMed] [DOI] |
| 28. | Muramatsu A, Iwai M, Morikawa T, Tanaka S, Mori T, Harada Y, Okanoue T. Influence of transfection with connexin 26 gene on malignant potential of human hepatoma cells. Carcinogenesis. 2002;23:351-358. [PubMed] [DOI] |
| 30. | Zhu D, Caveney S, Kidder GM, Naus CC. Transfection of C6 glioma cells with connexin 43 cDNA: analysis of expression, intercellular coupling, and cell proliferation. Proc Natl Acad Sci U S A. 1991;88:1883-1887. [PubMed] [DOI] |