修回日期: 2012-10-21
接受日期: 2012-11-07
在线出版日期: 2012-11-28
目的: 探讨1,25-二羟基维生素D3[1,25-dihydroxyvitamin D3, 1,25(OH)2D3]对蛋氨酸-胆碱缺乏(methionine-choline-deficient, MCD)饮食诱导的非酒精性脂肪肝性肝纤维化的抑制作用及其可能机制.
方法: 将30只C57BL/6J小鼠随机分为正常组、模型组和干预组, 每组10只. 采用MCD饮食诱导建立非酒精性脂肪肝性肝纤维化模型. 其中, 模型组和干预组饲以MCD饲料. 干预组给予1,25(OH)2D3(5 μg/kg)腹腔注射, 正常组和模型组给予同样剂量的生理盐水腹腔注射, 2次/wk. 干预8 wk后, 试剂盒检测小鼠血清谷丙转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(aspartate aminotransferase, AST)水平; 肝组织苏木素和伊红(hematoxylin and eosin, HE)染色观察组织形态学变化; RT-PCR检测转化生长因子β(transforming growth factor beta, TGF-β)、α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)和Ⅰ型胶原mRNA的
表达.
结果: 与正常组相比, 模型组小鼠ALT和AST水平以及TGF-β1, α-SMA和Ⅰ型胶原mRNA的表达均明显升高(P = 0.000, P = 0.000, P = 0.044, P = 0.003, P = 0.027); 而与模型组相比, 1,25(OH)2D3干预组除了TGF-β1 mRNA的表达无变化外, 其他指标均显著下降(P = 0.000, P = 0.005, P = 0.020, P = 0.027). HE染色结果显示, 模型组肝组织可见大量脂肪变性(胞质内充满大小较一致的脂滴空泡), 且血管周围炎症细胞浸润严重; 而干预组两者程度都有减轻, 但后者效果更明显.
结论: 1,25(OH)2D3可改善肝功能, 且可能通过对α-SMA和Ⅰ型胶原基因的调控达到减缓MCD饮食诱导的非酒精性脂肪肝性肝纤维化进程的目的.
引文著录: 李艳芳, 唐夕岚, 凌文华. 1,25-二羟基维生素D3对小鼠非酒精性脂肪肝性肝纤维化进程的抑制作用. 世界华人消化杂志 2012; 20(33): 3191-3196
Revised: October 21, 2012
Accepted: November 7, 2012
Published online: November 28, 2012
AIM: To investigate whether 1,25-dihydroxyvitamin D3 (1,25(OH)2D3), the active form of vitamin D, inhibits fibrosis induced by a methionine-choline-deficient (MCD) diet in C57BL/6J mice and to explore the possible mechanisms involved.
METHODS: Male C57BL/6J mice (n = 30) were divided randomly into control group, MCD group, and MCD + 1,25(OH)2D3 group. The MCD and MCD + 1,25(OH)2D3 groups were fed a MCD diet. All the mice were intraperitoneally injected with 1,25(OH)2D3 (5 μg/kg) or equal volume of saline twice weekly. After 8 wk, the mice were sacrificed to take serum samples for biochemical measurements and liver samples for HE staining and RT-PCR.
RESULTS: Serum levels of alanine aminotransferase, aspartate aminotransferase, and mRNA expression of transforming growth factor beta1 (TGF-β1), α-smooth muscle actin (α-SMA) and collagenⅠa1 of MCD group significantly increased in the MCD group compared to the control group (P = 0.000, 0.000, 0.044, 0.003, 0.027). In the MCD + 1,25(OH)2D3 group, all the above parameters significantly decreased (P = 0.000, 0.005, 0.020, 0.027) except the mRNA expression of TGF-β1, which showed no significant change, compared to the MCD group. Steatosis was significantly improved, as revealed by the presence of fewer lipid drops in the cytoplasm and less inflammatory cell infiltration around the vessels, in the MCD + 1,25(OH)2D3 group compared to the MCD group.
CONCLUSION: 1,25(OH)2D3 can improve liver function and inhibit fibrosis possibly by down-regulating the mRNA expression of α-SMA and collagenⅠa1 in mice with NAFLD induced by a MCD diet.
- Citation: Li YF, Tang XL, Ling WH. 1,25-dihydroxyvitamin D3 inhibits fibrosis in mice with NAFLD induced by a methionine-choline-deficient diet. Shijie Huaren Xiaohua Zazhi 2012; 20(33): 3191-3196
- URL: https://www.wjgnet.com/1009-3079/full/v20/i33/3191.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i33.3191
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是以肝细胞脂肪变为主要特征的临床病理综合征[1]. 其疾病谱包括单纯性脂肪肝、脂肪性肝炎(nonalcoholic steatohepatitis, NASH), 进一步可发展为肝纤维化和肝硬化, 甚至导致肝细胞癌[2]. 随着人们生活水平的提高以及生活饮食方式的改变等, NAFLD的发病率日益升高. 在欧美等发达国家, 普通民众NAFLD的患病率高达20%-30%[3-6]. 而在我国, 多项流行病学研究结果显示脂肪肝的患病率不断升高. 在我国较发达的地区如上海、广州等, NAFLD的发病率分别高达17%和15%[7,8]. 而肝纤维化是进展为肝硬化的重要阶段, 且被认为是肝损伤最客观的指标以及肝脏疾病发病率和死亡率最好的预后指标[9]. 其主要特征是以Ⅰ型胶原为主的细胞外基质(extracellular matrix, ECM)在窦周间隙的大量沉积[10]. 肝星状细胞(hepatic stellate cells, HSCs)在肝纤维化的发生发展中起着关键作用, 主要是因为其活化分泌大量的ECM. α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)是迄今为止被广泛认可的HSCs活化的可靠指标, 而转化生长因子β(transforming growth factor beta, TGF-β)是最有效的促纤维化的细胞因子, 可以促进ECM组分的合成及沉积[11,12].
1,25-二羟基维生素D3[1,25-dihydroxyvitamin D3, 1,25(OH)2D3]作为维生素D(vitamin D, VD)在体内最终的生物活性形式, 一直以来被认为与机体内钙及骨盐平衡密切相关. 但事实上, 1,25(OH)2D3调控着数百不同的基因, 在许多正常或恶性肿瘤细胞的增殖、分化以及凋亡中发挥着重要作用[13-16]. 最近有研究证实VD或其类似物在肺及肾等组织器官中均具有抗纤维化作用[17,18]. Abramovitch等[19]的最新研究显示, 1,25(OH)2D3能减轻硫代乙酰胺诱导的♂Wistar大鼠肝纤维化的程度. 但1,25(OH)2D3能否减缓非酒精性脂肪肝性肝纤维化的进程尚未见报道. MCD(methionine-choline-deficient)饮食诱导的C57BL/6J小鼠模型是经典的NASH模型, 主要用于NASH和肝纤维化的研究. 本实验将通过建立MCD饮食诱导的非酒精性脂肪肝性肝纤维化模型, 探讨1,25(OH)2D3的抗肝纤维化作用.
离心机(Eppendorf, 德国), 酶标仪(Bio-Tek, 美国), 石蜡切片机(Leica, 德国), 倒置荧光显微镜(Nikon, 日本), 生物分光光度计(Eppendorf, 德国), PCR仪(Bio-Rad, 美国), 实时荧光定量PCR仪(ViiA 7, Applied Biosystems, 美国), 1,25(OH)2D3(Cayman, 美国), 血清谷丙转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(aspartate aminotransferase, AST)测试盒(南京建成生物工程研究所), HE染色剂(广州秀威贸易有限公司), TRIzol(Invitrogen, 美国), 逆转录试剂盒(DRR047A, TaKaRa, 日本)和PCR反应试剂盒(DRR081A, TaKaRa, 日本).
1.2.1 动物分组与处理: 健康8 wk的SPF级♀C57BL/6J小鼠(由广东省动物中心提供), 体质量18-25 g. 随机分为正常组(control)、模型组(MCD)和干预组[MCD+1,25(OH)2D3], 每组10只. 其中, 正常组小鼠饲以蛋氨酸和胆碱充足的正常饲料, 模型组和干预组小鼠饲以MCD饲料. 1,25(OH)2D3 1 mg溶于1 mL二甲基亚砜(dimethyl sulfoxide, DMSO)中, 再用医用生理盐水稀释至所需浓度. 干预组给予相应剂量的1,25(OH)2D3 (5 μg/kg)腹腔注射, 正常组和模型组给予同样剂量的生理盐水腹腔注射, 2次/wk. 干预8 wk后, 实验动物禁食12 h, 称质量, 眼球取血, 取出肝脏并称取质量. 4 ℃离心分离血清, 分装保存, 以用于肝功能检测. 部分肝组织以40 g/L中性甲醛固定, 备做病理切片, 其余肝组织用液氮快速冷冻, 置于-80 ℃冰箱保存, 备提取mRNA.
1.2.2 血清ALT和AST水平检测: 按南京建成生物工程研究所的ALT和AST测试盒说明书进行.
1.2.3 组织切片HE染色: 标本用40 g/L中性甲醛固定, 石蜡包埋并切片; 切片脱蜡并经HE染色后, 用中性树胶封片; 最后在倒置显微镜下观察拍照.
1.2.4 RT-PCR: 用TRIzol一步抽提法提取肝脏组织总RNA, 根据产品说明书操作. 用生物分光光度计测定RNA浓度和纯度. 取2 μg RNA样本, 用逆转录试剂盒进行逆转录合成cDNA, 并以此为模板进行PCR扩增反应. 逆转录和PCR反应条件按照试剂盒说明书设置. 扩增引物由上海生工生物工程公司合成. TGF-β1的上游引物5'-GTC AGA CAT TCG GGA AGC AG-3', 下游引物5'-GCG TAT CAG TGG GGG TCA-3'; α-SMA的上游引物5'- AAA CAG GAA TAC GAC GAA G-3', 下游引物5'-CAG GAA TGA TTT GGA AAG GA-3';Ⅰ型胶原的上游引物5'-GAG CGG AGA GTA CTG GAT CG-3', 下游引物5'-GCT TCT TTT CCT TGG GGT TC-3'; β-actin的上游引物5'-GAG ACC TTC AAC ACC CCA GC-3', 下游引物5'-ATG TCA CGC ACG ATT TCC C-3'. 利用Applied Biosystems ViiA7型实时荧光定量PCR仪自带软件ViiA 7 RUO Software1.0进行相关数据处理, 以β-actin为内参基因, 采用2-∆∆Ct法计算基因表达的相对变化.
统计学处理 实验结果以mean±SD表示, 多组间比较首先进行方差齐性检验(方差不齐时, 采用对数转换以满足方差齐性条件), 然后进行单因素方差分析(one-way ANOVA), P<0.05为差异有统计学意义. 当P<0.05时, 两组间比较采用最小有意义差异t检验(least significance difference t test, LSD-t). 所有数据的统计分析均借助统计软件SPSS16.0完成.
为了观察研究MCD饮食对C57BL/6J小鼠肝功能的影响, 以及1,25(OH)2D3是否对肝功能有改善作用, 我们检测了实验小鼠血清ALT和AST的水平(表1). 与正常组相比, 模型组ALT和AST水平均明显升高, 分别是正常组的5倍和4倍, 且差异均具有统计学意义(P = 0.000). 而1,25(OH)2D3干预组显著地抑制了模型组ALT和AST水平的升高. 与模型组相比, 其ALT水平下降了54%, 且差异具有统计学意义(P = 0.000), 尽管平均水平高于正常组, 但没有统计学差异; 而AST水平下降了49%, 且差异具有统计学意义(P = 0.005), 但其AST水平还是高于正常组, 且差异具有统计学意义(P = 0.005).
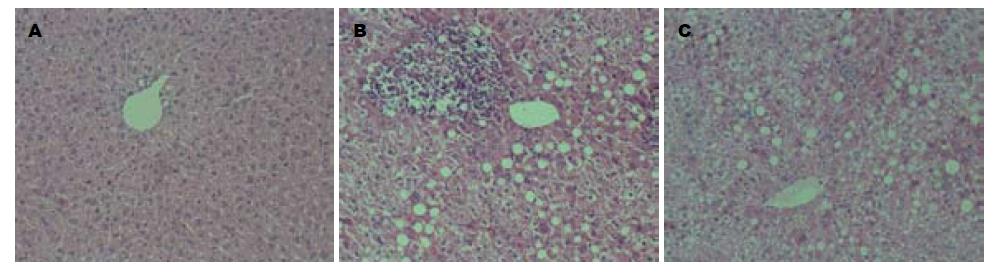
各组肝组织切片经HE染色后, 在倒置显微镜下观察. 可见正常组肝组织形态结构均正常, 无脂肪变性, 血管周围无炎症细胞浸润; 模型组肝组织可见大量脂肪变性, 胞质内充满大小较一致的脂滴空泡, 血管周围炎症细胞浸润严重; 而干预组与模型组相比, 脂肪变性程度稍有减轻, 但血管周围炎症细胞浸润程度明显减轻(图1).
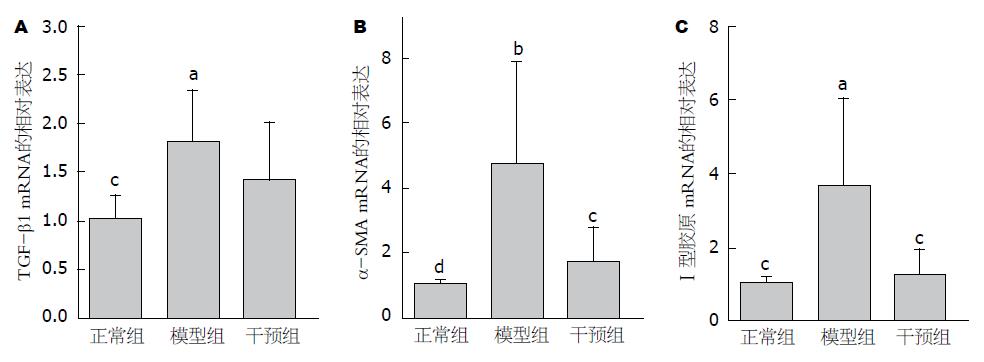
与正常组相比, 模型组TGF-β1 mRNA水平升高, 接近正常组的2倍, 且差异具有统计学意义(P = 0.044). 但与模型组相比, 干预组TGF-β1 mRNA水平只是略有下降, 且无统计学意义. 与正常组相比, 模型组α-SMA和Ⅰ型胶原mRNA水平均明显升高, 分别接近正常组的5倍和4倍, 且差异均具有统计学意义(P = 0.003, P = 0.027). 而干预组显著地降低了这两者的mRNA水平, 且差异均具有统计学意义(P = 0.020, P = 0.027). 与模型组相比, 干预组α-SMA和Ⅰ型胶原mRNA水平分别下降了60%和70%左右(图2).
随着肥胖和Ⅱ型糖尿病等疾病的发病率越来越高, NAFLD的发病率急速上升, 且已成为欧美等西方发达国家最常见的慢性肝病[4,20]. 而其在人群中的高发病率以及发展为肝硬化和肝功能衰竭的可能性使对其的研究具有临床意义[21]. 作为NAFLD发展为肝硬化的重要阶段, 如何减缓非酒精性脂肪肝性肝纤维化的进程, 成为减轻NAFLD危害的重要手段. 随着国内外学者的深入研究, 1,25(OH)2D3的各种非传统功能被发现. 而1,25(OH)2D3与NAFLD之间的联系也为越来越多的研究证明[22-28], 且VD受体在包括HSC等在内的肝非实质细胞中表达[29]的研究发现更是支持了这一现象.
本研究发现1,25(OH)2D3可显著降低MCD饮食诱导的非酒精性脂肪肝性肝纤维化模型的ALT和AST水平, 表明1,25(OH)2D3具有改善肝功能的作用. 而通过肝组织切片HE染色, 我们观察到1,25(OH)2D3干预组的脂肪变性程度稍有减轻, 而炎症细胞浸润程度显著降低, 显示1,25(OH)2D3可能能够减缓肝纤维化进程. 此结果与Abramovitch等[19]的研究结果一致. 他们在硫代乙酰胺诱导的♂Wistar大鼠肝纤维化模型中发现, 1,25(OH)2D3可显著减少Ⅰ型胶原沉积、减轻肝纤维化程度. Ramirez等[17]观察了1,25(OH)2D3对TGF-β1处理的鼠肺纤维细胞的影响, 发现1,25(OH)2D3抑制了TGF-β1诱导的α-SMA的表达, 阻止了胶原表达的正向调节; 而Tan等[18]发现, VD的类似物帕立骨化醇通过减少包括Ⅰ、Ⅲ型胶原在内的间质基质的表达和沉积, 显著地减轻了大鼠梗阻肾模型的纤维化病变. 因此, 本实验检测了TGF-β1、α-SMA和Ⅰ型胶原的mRNA表达水平. 结果显示, 1,25(OH)2D3显著降低了α-SMA和Ⅰ型胶原的mRNA表达水平, 且有统计学意义, 但并未发现统计学意义上TGF-β1的降低, 提示1,25(OH)2D3可能通过抑制肝星状细胞的活化以及Ⅰ型胶原mRNA的合成, 降低Ⅰ型胶原和其他纤维化相关因子的表达, 进而减轻肝纤维化程度, 从而改善MCD饮食诱导的非酒精性脂肪肝性肝纤维化程度. 本研究未发现1,25(OH)2D3对TGF-β1 mRNA水平的抑制作用, 可能是因为1,25(OH)2D3通过对TGF-β/Smad信号通路的下游基因进行调控, 从而影响肝纤维化进程, 且已有研究发现1,25(OH)2D3与TGF-β/Smad信号通路之间的相互作用[30,31].
迄今为止, 临床上缺乏非酒精性脂肪肝性肝纤维化的有效治疗方法. 阐明1,25(OH)2D3影响肝纤维化的作用机制, 可能对防治NAFLD这一日益威胁人类健康的疾病提供新的经济实惠以及不良反应小的有效方法.
感谢郭红辉、蒋鑫炜及李真同志在本实验中给予的大力帮助.
非酒精性脂肪肝(NAFLD)在人群中的高发病率以及发展为肝硬化和肝功能衰竭的可能性使其受到重视. 而肝纤维化是进展为肝硬化的重要阶段. 因此, 开展有关抗肝纤维化的研究对于防治NAFLD具有重要意义.
高泽立, 副教授, 周浦医院消化科, 上海交大医学院九院周浦分院
越来越多的研究表明, 维生素D或其类似物在肺、肾及肝脏等组织器官中均具有抗纤维化作用. 但是1,25-二羟基维生素D3[1,25(OH)2D3]能否减缓非酒精性脂肪肝性肝纤维化的进程尚未见报道.
研究显示, 1,25(OH)2D3能减轻硫代乙酰胺诱导的雄性Wistar大鼠肝纤维化的程度, 并且能够抑制肝星状细胞的增殖及促纤维化标志物的表达. 且能抑制转化生长因子β1诱导的鼠肺纤维细胞α平滑肌肌动蛋白(α-SMA)的表达, 阻止胶原表达的正向调节.
本实验通过生化检测、形态学观察以及分子水平的研究, 发现1,25(OH)2D3可改善肝功能, 且可能通过对α-SMA和Ⅰ型胶原基因的调控达到减缓MCD饮食诱导的非酒精性脂肪肝性肝纤维化进程的目的.
迄今为止, 临床上缺乏非酒精性脂肪肝性肝纤维化的有效治疗方法. 阐明1,25(OH)2D3影响肝纤维化的作用机制, 可能对防治NAFLD这一日益威胁人类健康的疾病提供新的经济实惠以及不良反应小的有效方法.
本研究设计合理, 统计方法得当, 参考文献较新, 值得临床医师阅读.
编辑: 翟欢欢 电编:鲁亚静
| 1. | Sanyal AJ. AGA technical review on nonalcoholic fatty liver disease. Gastroenterology. 2002;123:1705-1725. [PubMed] [DOI] |
| 2. | Guha IN, Parkes J, Roderick P, Chattopadhyay D, Cross R, Harris S, Kaye P, Burt AD, Ryder SD, Aithal GP. Noninvasive markers of fibrosis in nonalcoholic fatty liver disease: Validating the European Liver Fibrosis Panel and exploring simple markers. Hepatology. 2008;47:455-460. [PubMed] [DOI] |
| 3. | Browning JD, Szczepaniak LS, Dobbins R, Nuremberg P, Horton JD, Cohen JC, Grundy SM, Hobbs HH. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology. 2004;40:1387-1395. [PubMed] [DOI] |
| 4. | Bedogni G, Miglioli L, Masutti F, Tiribelli C, Marchesini G, Bellentani S. Prevalence of and risk factors for nonalcoholic fatty liver disease: the Dionysos nutrition and liver study. Hepatology. 2005;42:44-52. [PubMed] [DOI] |
| 5. | Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003;37:1202-1219. [PubMed] [DOI] |
| 6. | Bellentani S, Saccoccio G, Masutti F, Croce LS, Brandi G, Sasso F, Cristanini G, Tiribelli C. Prevalence of and risk factors for hepatic steatosis in Northern Italy. Ann Intern Med. 2000;132:112-117. [PubMed] |
| 7. | Fan JG, Zhu J, Li XJ, Chen L, Li L, Dai F, Li F, Chen SY. Prevalence of and risk factors for fatty liver in a general population of Shanghai, China. J Hepatol. 2005;43:508-514. [PubMed] [DOI] |
| 8. | Zhou YJ, Li YY, Nie YQ, Ma JX, Lu LG, Shi SL, Chen MH, Hu PJ. Prevalence of fatty liver disease and its risk factors in the population of South China. World J Gastroenterol. 2007;13:6419-6424. [PubMed] [DOI] |
| 9. | Adams LA, Sanderson S, Lindor KD, Angulo P. The histological course of nonalcoholic fatty liver disease: a longitudinal study of 103 patients with sequential liver biopsies. J Hepatol. 2005;42:132-138. [PubMed] [DOI] |
| 10. | Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. J Biol Chem. 2000;275:2247-2250. [PubMed] [DOI] |
| 11. | Moreira RK. Hepatic stellate cells and liver fibrosis. Arch Pathol Lab Med. 2007;131:1728-1734. [PubMed] |
| 12. | Friedman SL. Cytokines and fibrogenesis. Semin Liver Dis. 1999;19:129-140. [PubMed] [DOI] |
| 13. | Holick MF. Resurrection of vitamin D deficiency and rickets. J Clin Invest. 2006;116:2062-2072. [PubMed] [DOI] |
| 14. | Nagpal S, Na S, Rathnachalam R. Noncalcemic actions of vitamin D receptor ligands. Endocr Rev. 2005;26:662-687. [PubMed] [DOI] |
| 15. | Bikle D. Nonclassic actions of vitamin D. J Clin Endocrinol Metab. 2009;94:26-34. [PubMed] [DOI] |
| 16. | Barreto AM, Schwartz GG, Woodruff R, Cramer SD. 25-Hydroxyvitamin D3, the prohormone of 1,25-dihydroxyvitamin D3, inhibits the proliferation of primary prostatic epithelial cells. Cancer Epidemiol Biomarkers Prev. 2000;9:265-270. [PubMed] |
| 17. | Ramirez AM, Wongtrakool C, Welch T, Steinmeyer A, Zügel U, Roman J. Vitamin D inhibition of pro-fibrotic effects of transforming growth factor beta1 in lung fibroblasts and epithelial cells. J Steroid Biochem Mol Biol. 2010;118:142-150. [PubMed] [DOI] |
| 18. | Tan X, Li Y, Liu Y. Paricalcitol attenuates renal interstitial fibrosis in obstructive nephropathy. J Am Soc Nephrol. 2006;17:3382-3393. [PubMed] [DOI] |
| 19. | Abramovitch S, Dahan-Bachar L, Sharvit E, Weisman Y, Ben Tov A, Brazowski E, Reif S. Vitamin D inhibits proliferation and profibrotic marker expression in hepatic stellate cells and decreases thioacetamide-induced liver fibrosis in rats. Gut. 2011;60:1728-1737. [PubMed] [DOI] |
| 20. | Bellentani S, Marino M. Epidemiology and natural history of non-alcoholic fatty liver disease (NAFLD). Ann Hepatol. 2009;8 Suppl 1:S4-S8. [PubMed] |
| 21. | Angulo P. Nonalcoholic fatty liver disease. N Engl J Med. 2002;346:1221-1231. [PubMed] [DOI] |
| 22. | Nakano T, Cheng YF, Lai CY, Hsu LW, Chang YC, Deng JY, Huang YZ, Honda H, Chen KD, Wang CC. Impact of artificial sunlight therapy on the progress of non-alcoholic fatty liver disease in rats. J Hepatol. 2011;55:415-425. [PubMed] [DOI] |
| 23. | Roth CL, Elfers CT, Figlewicz DP, Melhorn SJ, Morton GJ, Hoofnagle A, Yeh MM, Nelson JE, Kowdley KV. Vitamin D deficiency in obese rats exacerbates nonalcoholic fatty liver disease and increases hepatic resistin and Toll-like receptor activation. Hepatology. 2012;55:1103-1111. [PubMed] [DOI] |
| 24. | Terrier B, Carrat F, Geri G, Pol S, Piroth L, Halfon P, Poynard T, Souberbielle JC, Cacoub P. Low 25-OH vitamin D serum levels correlate with severe fibrosis in HIV-HCV co-infected patients with chronic hepatitis. J Hepatol. 2011;55:756-761. [PubMed] [DOI] |
| 25. | Petta S, Cammà C, Scazzone C, Tripodo C, Di Marco V, Bono A, Cabibi D, Licata G, Porcasi R, Marchesini G. Low vitamin D serum level is related to severe fibrosis and low responsiveness to interferon-based therapy in genotype 1 chronic hepatitis C. Hepatology. 2010;51:1158-1167. [PubMed] [DOI] |
| 26. | Barchetta I, Angelico F, Del Ben M, Baroni MG, Pozzilli P, Morini S, Cavallo MG. Strong association between non alcoholic fatty liver disease (NAFLD) and low 25(OH) vitamin D levels in an adult population with normal serum liver enzymes. BMC Med. 2011;9:85. [PubMed] [DOI] |
| 27. | Targher G, Bertolini L, Scala L, Cigolini M, Zenari L, Falezza G, Arcaro G. Associations between serum 25-hydroxyvitamin D3 concentrations and liver histology in patients with non-alcoholic fatty liver disease. Nutr Metab Cardiovasc Dis. 2007;17:517-524. [PubMed] [DOI] |
| 28. | Manco M, Ciampalini P, Nobili V. Low levels of 25-hydroxyvitamin D(3) in children with biopsy-proven nonalcoholic fatty liver disease. Hepatology. 2010;51:2229; author reply 2230. [PubMed] [DOI] |
| 29. | Gascon-Barré M, Demers C, Mirshahi A, Néron S, Zalzal S, Nanci A. The normal liver harbors the vitamin D nuclear receptor in nonparenchymal and biliary epithelial cells. Hepatology. 2003;37:1034-1042. [PubMed] [DOI] |
| 30. | Aschenbrenner JK, Sollinger HW, Becker BN, Hullett DA. 1,25-(OH(2))D(3) alters the transforming growth factor beta signaling pathway in renal tissue. J Surg Res. 2001;100:171-175. [PubMed] [DOI] |
| 31. | Subramaniam N, Leong GM, Cock TA, Flanagan JL, Fong C, Eisman JA, Kouzmenko AP. Cross-talk between 1,25-dihydroxyvitamin D3 and transforming growth factor-beta signaling requires binding of VDR and Smad3 proteins to their cognate DNA recognition elements. J Biol Chem. 2001;276:15741-15746. [PubMed] [DOI] |