修回日期: 2012-04-25
接受日期: 2012-05-18
在线出版日期: 2012-11-18
目的: 探讨不同大小的流体剪切应力对大鼠肝星状细胞株HSC-T6的活化和基因表达的影响.
方法: 对种植于鼠尾胶原上的HSC-T6细胞施以剪切应力处理, 剪切应力的大小分别为6、12、20 dyn/cm2, 干预时间为3 h. TRIzol法提取mRNA, 采用SYBR Green荧光定量RT-PCR方法分别检测各组α-SMA、Collogen-Ⅰ、Collogen-Ⅲ、MMP-2及MMP-9基因的表达情况, 流式细胞术检测细胞内蛋白α-SMA的表达.
结果: 剪切应力处理3 h后, 与对照组相比, 6 dyn/cm2剪切应力组α-SMA、 Collogen-Ⅲ的表达降低, 但随着剪切应力的增加(12 dyn/cm2、20 dyn/cm2), α-SMA mRNA较对照组表达升高; 20 dyn/cm2剪切应力组Collogen-Ⅲ基因表达较对照组升高; 3种剪切应力组之间Collogen-ⅠmRNA的表达无统计学差异; 3种剪切应力均上调MMP-2 mRNA的表达.
结论: 低剪切应力对HSC-T6的活化有一定的抑制作用, 相反高剪切应力可以促进HSC-T6的活化, 促进Collogen-Ⅲ、MMP-2的表达.
引文著录: 崔晓栋, 尹青令, 张晓芸, 李宏, 官秀梅, 李鑫, 王建英, 成敏. 流体剪切应力对肝星状细胞的活化和相关基因表达的影响. 世界华人消化杂志 2012; 20(32): 3135-3139
Revised: April 25, 2012
Accepted: May 18, 2012
Published online: November 18, 2012
AIM: To investigate the effects of different types of fluid shear stress on the activation of hepatic stellate cells-T6 (HSC-T6) and expression of α-SMA, collogen-Ⅰ, collogen-Ⅲ, MMP-2, and MMP-9.
METHODS: HSC-T6 cells were seeded on slides precoated with rat tail collagen and exposed to different types of fluid shear stress (6, 12, 20 dyn/cm2) for 3 h, and static cells served as controls. The gene expression of α-SMA, collogen-Ⅰ, collogen-Ⅲ, MMP-2 and MMP-9 was assayed by real-time RT-PCR. Intracellular α-SMA protein was analyzed by FACS.
RESULTS: After treatment by fluid shear stress, the expression of α-SMA and collogen-Ⅲ was lower in the low shear stress (6 dyn/cm2) group than that in the control group. However, the expression of α-SMA was higher in the moderate (12 dyn/cm2) and high (20 dyn/cm2) shear stress groups than that in the control group, and the expression of collogen-Ⅲ was higher in the high shear stress group than that in the control group. There was no significant difference in the expression of collogen-Ⅰ among different fluid shear stress groups. The expression of MMP-2 was higher that in three fluid shear stress groups than in the control group.
CONCLUSION: High fluid shear stress can lead to the activation of HSC-T6 cells and promote the mRNA expression of α-SMA, collogen-Ⅲ and MMP-2.
- Citation: Cui XD, Yin QL, Zhang XY, Li H, Guan XM, Li X, Wang JY, Cheng M. Effect of fluid shear stress on activation of hepatic stellate cells and expression of α-SMA, collogen-Ⅰ, collogen-Ⅲ, MMP-2, and MMP-9. Shijie Huaren Xiaohua Zazhi 2012; 20(32): 3135-3139
- URL: https://www.wjgnet.com/1009-3079/full/v20/i32/3135.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i32.3135
肝纤维化的发生是肝脏内纤维结缔组织异常增生的病理生理过程. 目前研究表明肝间质细胞, 尤其是肝星状细胞(hepatic stellate cell, HSC)的激活是肝纤维化发生、发展的关键因素[1,2]. HSCs存在于肝血窦Disse间隙内皮屏障下, 同时其细胞质突起与肝窦内皮细胞壁平行, 正常情况下HSCs处于静止状态. 当各种致肝病因子如生物、化学、物理因素等造成肝脏细胞损伤时, 大量HSCs被活化, 转化成肌成纤维细胞(myofibro-blast, MFB), 合成较多的细胞外基质(extracellular matrix, ECM), 使其在肝脏内不断沉积, 致使肝纤维化、肝硬化的形成. HSC所处的特殊位置决定了其不仅容易受到化学因素, 同时还可直接或间接受到肝脏血液流体动力学因素的影响[3]. 本实验通过平行板流室系统模拟HSC在体内的流体剪切应力环境, 初步探讨不同大小流体剪切应力对大鼠肝星状细胞基因表达的影响.
HST-T6购自中南大学湘雅中心实验室. 荧光定量PCR(美国伯乐IQ5); 50 mL/L CO2培养箱(Thermo); 高糖型DMEM(Gibco公司), 胎牛血清(杭州四季青公司), TRIzol试剂(Invitrogen), SYBR® PrimeScript® RT-PCR Kit Ⅱ及相关引物设计合成(大连宝生物公司), 0.25%胰蛋白酶、鼠尾胶原蛋白、琼脂糖、α-SMA抗体均购自sigma公司.
1.2.1 细胞培养和接种: 将HST-T6接种于含100 mL/L胎牛血清的DMEM(高糖)培养基中, 置于37 ℃、50 mL/L CO2饱和湿度的培养箱培养. 每3 d换液, 融合度达90%后胰酶消化, 接种于经鼠尾胶原打底处理的载玻片上, 待其铺满程度达80%后行剪切应力干预.
1.2.2 流体剪切应力加载装置和条件设置: 剪切应力加载所应用的实验装置[4,5]由蠕动泵、储液瓶、管道及平行板流室组成. 平行板流室的流室测试区满足: (1)层流; (2)二维流动; (3)充分发展的流动. 给予HSC-T6施加6、12、20 dyn/cm2的力学刺激, 干预时间为3 h, 力学负荷大小参考丁纪明等[6]文献.
1.2.3 实验分组: 设立实验组和对照组. 实验组施加不同大小剪切应力处理, 对照组为未施加剪切应力静止状态, 即0 dyn/cm2的HSC-T6组.
1.2.4 流式细胞术检测HSC-T6 α-SMA的表达: 待处理组HSC-T6用PBS清洗3次, 采用2%Triton X-100破膜5 min. 取2×106-4×106个细胞, 加入一抗α-SMA抗体(1:100), 室温下避光反应2 h, PE标记相应二抗染色, 行FACS检测, 每组样本收集10 000个细胞, 数据用Flow Jo软件分析.
1.2.5 荧光定量RT-PCR方法检测不同基因的表达: 按TRIzol试剂说明书提取总RNA, 溶于DEPC处理的去离子水中, -80 ℃保存备用. 荧光定量RT-PCR根据宝生物说明书操作. 反应引物均委托宝生物设计合成. 反应体系为25 μL, 引物浓度为终浓度为0.4 μmol/L. PCR反应程序: 95 ℃预变性30 s; 95 ℃ 变性30 s, 60 ℃退火30 s, 40个循环. 实验中以超纯水(PCR级, 无RNase)作为阴性对照. 根据Ct值, 利用公式2-△△Ct计算出相对表达量, 重复3次. 扩增后采用1.5%琼脂糖凝胶电泳检测扩增片段大小及有无非特性扩增.
统计学处理 采用SPSS10.0统计学软件处理, 正态分布资料组间差异性分析采用单因素方差分析, 非正态分布资料采用Mann-Whitney U检验. 数据均以mean±SD表示, P<0.05有统计学差别.
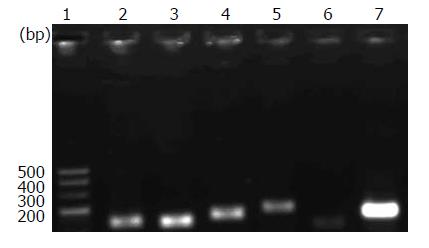
荧光定量RT-PCR扩增曲线显示所有样品均进入平台期, 提示反应条件设定准确, 同时溶解曲线未见杂峰, 琼脂糖凝胶电泳条带EB染色, 目的条带均在理论位置(图1).
不同剪切应力作用HSC-T6 12 h, 和静止组HSC-T6相比, 12、20 dyn/cm2处理组α-SMA蛋白表达量升高(P<0.05), 提示12、20 dyn/cm2剪切应力作用后可促进其表达(图2).
不同的流体剪切应力处理3 h后, 与对照组相比, 低剪切应力(6 dyn/cm2)组α-SMA mRNA表达降低(0.743±0.011), Collogen-Ⅲ表达降低(0.547±0.0012), 差异均有统计学意义(P<0.05), 但随着剪切应力的增加(12、20 dyn/cm2)α-SMA mRNA表达均升高, 分别为1.330±0.013, 2.101±0.012, 差异有统计学意义(P<0.05); 当剪切应力增加到20 dyn/cm2时, Collogen-Ⅲ基因表达与对照组相比较升高(1.337±0.010). 但3种剪切应力对HSCT6 Collogen-ⅠmRNA的表达则无统计学差异.
流体剪切应力6、12、20 dyn/cm2干预3 h后, 与对照组相比, HSC-T6 MMP-2 mRNA表达均增高, 分别为2.001±0.018, 2.010±0.016, 2.415±0.013, 有统计学差异(P<0.05); 低剪切应力(6 dyn/cm2)干预后发现MMP-9表达较对照组降低(0.672±0.010), 有统计学差异(P<0.05).
肝纤维化是病毒性肝炎、酒精性、自身免疫性、胆管性肝病等多种原因损害后肝脏的一种修复过程, 但这一过程往往由于胞外基质的过度积累而造成肝功能障碍. 研究表明: 肝纤维化是一个ECM形成和降解失衡的过程. 其涉及到的机制包括物理、化学、生物等方面的变化致使静止状态的HSC激活、活化、转化为肌成纤维细胞(标志分子为α-SMA)[7,8], 使HSC收缩能力增强, 参与对肝血窦血流量的调控. 除此之外, 活化后的HSC能合成大量的ECM, 如Ⅰ、Ⅱ、Ⅲ和Ⅳ胶原和非胶原基质蛋白. 与此同时, 活化的HSC还分泌多种基质金属蛋白酶(matrix metall proteinase, MMP)[9], 催化胞外基质的分解. HSC存在于肝血窦Disse间隙内皮下, 激活后的HSC在结构上有长的细胞质突起与肝窦内皮细胞壁平行且在内皮细胞间穿插, 因此活化后的HSC直接或间接受到血流动力学的影响发生相应的变化[3].
肝脏血流丰富, 肝血窦也接受两种血供: 末端入口微静脉(the terminal portal venule, TPVn)和末端肝微动脉(the terminal hepatic arteriole, THAo). TPVn直接与肝血窦相联系, 提供约80%血量, 而THAo通过末端的毛细血管前括约肌的舒缩调节, 主要为肝血窦提供平稳和恒定的动力. 小静脉内剪切应力<10 dyn/cm2[10], 但基于肝血窦血流特殊特点, 肝血窦内也属静脉系统, 但其内剪切应力比一般小静脉偏高些. 随着肝纤维化、肝硬化的发生, 肝内血管阻力增加, 门静脉血流量增加, 此时肝血窦剪切应力可以异常增加. 故本实验综合参考丁纪明等[6]实验数据和Debbaut等[11]计算相关因素, 设置低剪切应力组(6 dyn/cm2)、中剪切应力组(12 dyn/cm2)和高剪切应力组(20 dyn/cm2). 采用Cheng等[4,5]剪切应力力学加载装置, 以DMEM高糖完全培养基作为流体, 通过力学公式计算出所需具体流量, 使用蠕动泵控制流速达到模拟肝血窦血流的目的.
实验发现, 与对照组相比, 低剪切应力(6 dyn/cm2)处理后HSC-T6 α-SMA mRNA表达量稍低; 相反随着剪切应力增高, α-SMA mRNA和蛋白表达增加, 其活化程度增高, 促进肝纤维化的发生. 同时我们还发现剪切应力处理后, HSC外基质Collogen-Ⅰ和Ⅲ表达差别明显, 3种大小剪切应力对Collogen-Ⅰ的表达与对照组相比均无统计学差异. 但6 dyn/cm2剪切应力可抑制HSC Collogen-Ⅲ表达, 相反高剪切应力20 dyn/cm2可使其表达上调. 提示在高剪切应力状态下HSC可能更容易激活、活化, 其表达ECM可能以Collogen-Ⅲ为主, 而非以Collogen-Ⅰ为主. 究其原因可能是在肝损伤早期主要以Collogen-Ⅲ沉积为主, 而晚期以Collogen-Ⅰ增加最为明显[12]. 随着剪切应力的变化, HSC激活、活化以及其生物学功能如何改变以及其发生的具体机制, 国内外尚未见报道, 有待于进一步深入研究.
如前所述, 肝纤维是一个ECM形成和降解失衡的病理过程, MMPs是一类与细胞间基质蛋白代谢相关的结构蛋白, 是主要的基质降解酶[13,14], 可参与许多正常生物学过程. 有关文献显示肝纤维时HSC是MMP-2[15]和MMP-9[16]的主要细胞来源[17], 因此我们还对剪切应力状态下HSC表达MMP-2和MMP-9做了初步探讨. 发现3种剪切应力均可以促进MMP-2的表达, 而低剪切应力(6 dyn/cm2)却抑制MMP-9的表达, 但12、20 dyn/cm2对MMP-9表达的影响无统计学差异. 提示一定的剪切应力可以促进HSC活化、ECM表达的同时, 还可能促进MMP-2的表达, 以此来发挥其降解相应ECM的作用.
总之, 本实验构建的体外血流动力学模型能较好地反应肝纤维化, 肝硬化前后HSC在肝窦和DISS内所承受的剪切应力, 本研究中对不同的剪切应力对HSC-T6的α-SMA、Collogen-Ⅰ和Ⅲ、MMP-2和MMP-9的变化做了初步探讨, 但其具体机制亟待进一步深入研究.
在肝纤维化过程中, 肝星状细胞(HSC)所处环境中的血液动力学因素变化对肝纤维化进程产生着重要的影响, 因此考察机械力对HSCs的生物学特性的影响是非常有必要的.
季菊玲, 副教授, 南通大学医学院病理教研室
生物力学在研究血管重建, 门脉高压对门静脉的重建方面已经取得丰硕的成果. 但是关于生物力学在肝纤维化发生发展过程中作用的研究尚在起步阶段.
本文从肝脏血液动力学角度研究剪切应力对肝星状细胞的活化及胞外基质表达的影响, 从生物力学角度探讨肝纤维化的病理机制, 具有较高的科学性和创新性.
本文创新性地阐述肝脏血流动力学的改变对肝星状细胞的影响, 初步探讨力学环境对肝纤维化的影响, 该文研究水平较高, 创新性强.
编辑: 李军亮 电编:闫晋利
| 1. | Marcos LA, Terashima A, Yi P, Andrade R, Cubero FJ, Albanis E, Gotuzzo E, Espinoza JR, Friedman SL. Mechanisms of liver fibrosis associated with experimental Fasciola hepatica infection: roles of Fas2 proteinase and hepatic stellate cell activation. J Parasitol. 2011;97:82-87. [PubMed] [DOI] |
| 4. | Cheng M, Liu X, Li Y, Tang R, Zhang W, Wu J, Li L, Liu X, Gang Y, Chen H. IL-8 gene induction by low shear stress: pharmacological evaluation of the role of signaling molecules. Biorheology. 2007;44:349-360. [PubMed] |
| 5. | Cheng M, Wu J, Li Y, Nie Y, Chen H. Activation of MAPK participates in low shear stress-induced IL-8 gene expression in endothelial cells. Clin Biomech (Bristol, Avon). 2008;23 Suppl 1:S96-S103. [PubMed] [DOI] |
| 6. | 丁 纪明, 陈 平, 张 林, 朱 瑾, 熊 燕, 段 世刚, 李 颖. 切应力对大鼠肝窦内皮细胞分泌功能的影响. 中国普外基础与临床杂志. 2005;12:455-458, 468. |
| 8. | Almeida-Porada G, Zanjani ED, Porada CD. Bone marrow stem cells and liver regeneration. Exp Hematol. 2010;38:574-580. [PubMed] [DOI] |
| 10. | Shah V, Haddad FG, Garcia-Cardena G, Frangos JA, Mennone A, Groszmann RJ, Sessa WC. Liver sinusoidal endothelial cells are responsible for nitric oxide modulation of resistance in the hepatic sinusoids. J Clin Invest. 1997;100:2923-2930. [PubMed] [DOI] |
| 11. | Debbaut C, Monbaliu D, Casteleyn C, Cornillie P, Van Loo D, Masschaele B, Pirenne J, Simoens P, Van Hoorebeke L, Segers P. From vascular corrosion cast to electrical analog model for the study of human liver hemodynamics and perfusion. IEEE Trans Biomed Eng. 2011;58:25-35. [PubMed] [DOI] |
| 15. | Li J, Fan R, Zhao S, Liu L, Guo S, Wu N, Zhang W, Chen P. Reactive Oxygen Species Released from Hypoxic Hepatocytes Regulates MMP-2 Expression in Hepatic Stellate Cells. Int J Mol Sci. 2011;12:2434-244. [PubMed] [DOI] |
| 16. | Dechêne A, Sowa JP, Gieseler RK, Jochum C, Bechmann LP, El Fouly A, Schlattjan M, Saner F, Baba HA, Paul A. Acute liver failure is associated with elevated liver stiffness and hepatic stellate cell activation. Hepatology. 2010;52:1008-1016. [PubMed] [DOI] |
| 17. | Han YP. Matrix metalloproteinases, the pros and cons, in liver fibrosis. J Gastroenterol Hepatol. 2006;21 Suppl 3:S88-S91. [PubMed] [DOI] |