修回日期: 2012-09-12
接受日期: 2012-11-02
在线出版日期: 2012-11-18
目的: 研究人死亡受体(death receptor5, DR5)激动型抗体hCTB006联合伊立替康对不同分化程度胃癌细胞BGC823、SGC7901的体外抑瘤作用, 并对其诱导胃癌细胞凋亡的机制进行初步探讨.
方法: 实验将BGC823、SGC7901细胞分为伊立替康组、hCTB006组和两者联合应用组, 应用ATPlite法研究各组药物的体外抑瘤作用; 采用ELISA法研究伊立替康处理胃癌细胞前后DR5表达的变化. 采用Western blot技术检测药物处理前后BGC823、SGC7901细胞X-联锁凋亡抑制蛋白(X-chromosome-linked inhibitory of apoptosis protein, XIAP)的表达变化情况.
结果: BGC823对hCTB006中度敏感, 对SGC7901不敏感, 伊立替康对胃癌细胞的增殖抑制作用呈浓度依赖性, 与hCTB006联合用药后对BGC823具有良好的协同抑制作用, 但对SGC 7901协同作用不明显. ELISA测得伊立替康处理后胃癌细胞DR5的表达量无明显变化. 但伊立替康和hCTB006联合用药可使胃癌细胞BGC823内XIAP水平明显降低, 而对SGC 7901细胞内XIAP没有明显作用.
结论: 伊立替康联合hCTB006后对低分化胃癌细胞BGC823的增殖有明显协同抑制作用, 而对中度分化的SGC7901细胞呈拮抗作用, 这种诱导胃癌细胞凋亡的机制可能与其DR5的表达无关, 而与联合作用后细胞抑凋亡蛋白XIAP的表达水平有关.
引文著录: 王晓, 宁守斌, 沈恩允, 郭雷鸣. hCTB006联合伊立替康对胃癌细胞BGC823、SGC7901协同杀伤的作用机制. 世界华人消化杂志 2012; 20(32): 3130-3134
Revised: September 12, 2012
Accepted: November 2, 2012
Published online: November 18, 2012
AIM: To explore the cytotoxic effect of combined anti-human DR5 monoclonal antibody hCTB006 and irinotecan on human gastric cancer BGC823 and SGC7901 cells in vitro.
METHODS: The cytotoxic effect of hCTB006 and irinotecan, alone or in combination, was evaluated using ATP lite assay. DR5 expression in tumor cells was examined using ELISA. The level of cytoplasmic XIAP was detected by Western blot.
RESULTS: Irinotecan exerted a cytotoxic effect on gastric cancer cells in a concentration-dependent manner, while the effect of hCTB006 on gastric cancer cells was not concentration-dependent. hCTB006 combined with irinotecan resulted in a synergistic cytotoxic effect on BGC823 cells, but not on SGC7901 cells. Irinotecan treatment did not significantly alter DR5 expression. Combined irinotecan and hCTB006 down-regulated XIAP expression in BGC823 cells, but not in SGC7901 cells.
CONCLUSION: Irinotecan can inhibit the growth of gastric cancer dose-dependently. Anti-human DR5 monoclonal antibody hCTB006 and irinotecan exert a synergistic cytotoxic effect on gastric cancer cells possibly by regulating the expression of XIAP.
- Citation: Wang X, Ning SB, Shen EY, Guo LM. Synergistic cytotoxic effect of anti-human DR5 monoclonal antibody hCTB006 and irinotecan on gastric cancer BGC823 and SGC7901 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(32): 3130-3134
- URL: https://www.wjgnet.com/1009-3079/full/v20/i32/3130.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i32.3130
胃癌是最常见的肿瘤之一. 据统计, 全球每年新发胃癌80余万例, 占所有新发癌症的9%, 每年约有60余万人因胃癌死亡, 居癌症死因的第2位[1]. 手术治疗仍是可能治愈胃癌的唯一手段, 但是即使是早期胃癌的根治手术, 其复发及转移率也较高. 因此化疗在胃癌的治疗中仍占有很重要的位置. 目前临床上常用的化疗方案对胃癌的疗效仍不能令人满意, 需要寻找更加有效、安全的化疗方案. 伊立替康是从天然植物喜树的果实中提取分离的一种微量生物碱, 他主要作用于细胞分裂的S期, 并可选择性地抑制拓扑异构酶Ⅰ, 从而干扰DNA的复制, 达到抗癌的目的[2]. 近年来, 因其作用机制独特, 不易与其他化疗药物产生交叉耐药性而成为临床研究的焦点之一. 分子靶向治疗药物因其对肿瘤细胞的专一选择性及低不良反应成为肿瘤治疗的热点, 而人死亡受体5(death receptor5, DR5)是近年来肿瘤治疗的热点, 与其配体(tumor necrosis factor-related apoptosis-inducing ligand, TRAIL/Apo2L)或激动型抗体结合后, 能在体内诱导肿瘤细胞凋亡[3]. X-联锁凋亡抑制蛋白(X-chromosome-linked inhibitory of apoptosis protein, XIAP)是凋亡抑制蛋白(inhibitors of apoptosis, IAPs)家族中的抑凋亡蛋白, 近年来有研究[4]指出, 敲除XIAP可以增加肿瘤细胞对TRAIL的敏感性, 本文旨在探讨联合应用伊立替康与抗人DR5单克隆抗体hCTB006对不同分化程度胃癌细胞的增殖抑制作用, 并初步探讨其作用机制.
人死亡受体激动型抗体hCTB006由北京同为时代生物技术有限公司提供; 人胃癌细胞BGC823(低分化细胞)、SGC7901(中分化细胞)购自美国模式菌种收藏所(ATCC); 细胞培养相关材料、胎牛血清购自GIBCO公司; ATPlite试剂盒购自美国PerkinElmer公司(批号: 0RD00694); Goat_anti human IgG(H+L)RPE(批号: 1031-09)、Goat_anti human RPE(批号: A0808-PB59)为Southern Biotech公司产品; 伊立替康为江苏恒瑞药业有限公司产品(批号: 090807). 微孔板发光分析仪(BHP9504-2)为北京滨松光子技术有限公司产品.
1.2.1 细胞培养: 将胃癌细胞BGC823、SGC7901培养于含10%胎牛血清、0.1%的青霉素+链霉素DMEM培养液中. 在37 ℃、50 mL/L CO2的孵箱中, 培养2-5 d后, 用0.25%胰蛋白酶消化, 以1:2传代, 收集对数生长期且生长状态良好的细胞进行实验.
1.2.2 ATPlite法检测hCTB006与伊立替康合用对胃细胞抑制增殖的影响: (1)实验分组及药物剂量: 把每种胃癌细胞均分为伊立替康、hCTB006组、hCTB006+伊立替康合用组. hCTB006组给予剂量为500.0、250.0、125.0、62.5 μg/mL, 1 h后加入Goat_anti human RPE二抗, 浓度为1 μg/mL; 伊立替康组分别为100.0、50.0、25.0、12.5 μmol/L; hCTB006+伊立替康合用组为50 μmol/L的伊立替康联合以上浓度的hCTB006. 各组均设阴性对照; (2)ATPlite法检测细胞存活率[5]: 用0.25%胰蛋白酶消化胃癌细胞, 用DMEM培养液配成1×105/L单个细胞悬液, 按每孔50 μL即5 000细胞/孔接种于96孔板, 37 ℃、50 mL/L CO2, 培养24 h后加上述各组药物, 每组3个复孔, 终体积为100 μL. 48 h后按ATPlite试剂盒说明检测细胞活率. 数据使用Microplate Manager 5.2.1 软件处理. 细胞存活率(Survival Rate)% = (样品发光值平均值/对照组发光值的平均值)×100%, 3次实验后取平均值. 采用两种药物联合作用系数(combination index, CI)来评价联合用药对肿瘤细胞是否有协同作用, CI = AB/(A×B), 根据细胞发光值进行计算, AB为两药联合组发光值与对照组的发光值的比值, A或B是两药单独使用组与对照组发光值的比值. 若CI<1, 则两药作用为协同性质; 如CI = 1, 则两药作用为相加性质; 如CI >1, 则两药作用性质为拮抗性质[6].
1.2.3 ELISA法测定细胞DR5的表达量: 采用CLEIA双抗体夹心法, 将待检样本稀释到同一蛋白浓度, 取包被好的96孔酶标板, 每孔加25 μL校准品或待检样本, 校准品为DR5-rFC, 37 ℃孵育 1 h; 用1×PBS洗板5次, 加50 μL酶标抗体, 酶标抗体为HRP anti-DR5, 37 ℃孵育 0.5 h, 1×PBS洗板5次, 加50 μL发光底物, 避光反应3 min检测发光值.
1.2.4 Western blot检测胃癌细胞系BGC823、SGC7901细胞XIAP的变化: 将胃癌细胞BGC823、SGC7901按每孔接种5×105个细胞于6孔板中培养过夜. 加药组为伊立替康50 μmol/L; hCTB006: 250 ng/mL, 联合用药组为hCTB006(250 ng/mL)+伊立替康(50 μmol/L); 设阴性对照组; 总体积为1 mL, 培养24 h. 收集胃癌细胞BGC823、SGC7901, 3 000 r/min; 冰上裂解后, 12 000 r/min, 离心5 min, 取上清, BCA法蛋白定量. 电泳, 配制10%的分离胶和5%浓缩胶, 蛋白上样量均为20 μg, 恒流至预染的maker充分分离. 转膜, 100 V电压转膜1 h. 封闭, 5%的脱脂牛奶封闭过夜. XIAP: β-actin按1:3 000稀释, 室温孵育1 h后, 用TBST洗膜3次, 10 min/次. 加入山羊抗小鼠二抗, 按1:3 000稀释, 室温孵育1 h, TBST洗3遍, ECL显影曝光.
统计学处理 用SPSS13.0软件进行统计学分析, 组间比较采用ANOVA方差分析和t检验, P<0.05存在统计学意义.
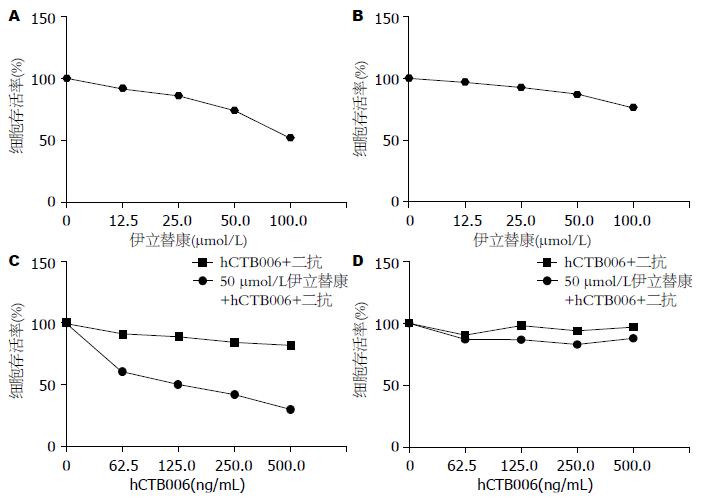
伊立替康、hCTB006单药以及两者联合用药对两种胃癌细胞存活率的影响各不相同(图1). 伊立替康单药对胃癌细胞的抑制增殖作用呈浓度依赖性, 浓度越高抑制作用越明显; hCTB006单药对胃癌细胞SGC7901的抑制增殖作用较弱, 而对BGC823增殖有一定的抑制作用(P<0.05). 研究表明50 μmol/L伊立替康单独作用于BGC823、SGC7901细胞48 h, 细胞存活率分别为74%、87%, 250 ng/mL hCTB006单独作用BGC823、SGC7901细胞48 h, 细胞的存活率分别为85%、94%, 然而当50 μmol/L伊立替康与250 ng/mL的hCTB006联合用药时, BGC823细胞的存活率降低到42%, 而SGC7901的存活率为83%. 根据两种药物联合作用CI来评价联合用药对肿瘤细胞是否有协同作用, 可见两者联合作用后, 对BGC823有协同作用(CI = 0.67<1), 但对SGC7901表现为拮抗作用(CI = 1.01>1).
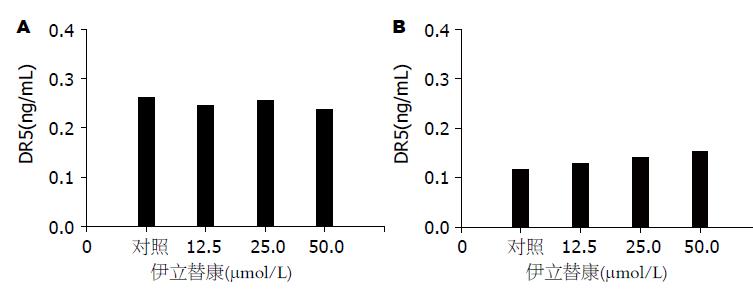
不同浓度的伊立替康作用于胃癌细胞BGC823、SGC7901后, 两者DR5的表达量均没有明显变化(图2).
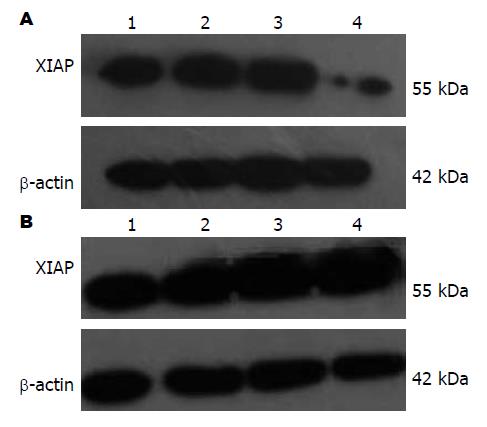
检测hCTB006及伊立替康单用及联合作用对胃癌细胞BGC823、SGC7901细胞内凋亡相关蛋XIAP表达的影响 Western blot检测结果表明: 联合用药24 h后, 胃癌细胞BGC823细胞内凋亡相关蛋白XIAP表达下降(图3A), 而对SGC7901细胞内XIAP的表达并无明显影响(图3B).
TRAIL又名凋亡素2配体(Apo2L), 是TNF超家族中的一员, 目前发现其有5个受体能与TRAIL进行特异性结合, 其中DR5和DR4与其配体结合后可传导TRAIL凋亡信号, 其他3个受体诱骗受体1、诱骗受体2和OPG能够阻止TRAIL凋亡信号的传导而抵抗TRAIL诱导的细胞凋亡. TRAIL与DR4或DR5结合后, 将通过带有死亡结构域的Fas相关蛋白(Fas-associated death domain, FADD)活化caspase-8和caspase-10, 并与之形成死亡诱导信号复合体(DISC), 从而激活下游caspase-3、caspase-6和caspase-7, 最终执行细胞的凋亡程序[7]. TRAIL在肿瘤治疗中有良好的效果, 但是和其他抗肿瘤药物一样, 某些恶性肿瘤对TRAIL并不敏感. 有文章报道[8-10]某些化疗药可以提高肿瘤细胞DR5的表达从而增加TRAIL的敏感性, 如紫花牡荆素、五味子酯、盐酸阿柔比星均可以通过上调细胞DR5的表达从而增强TRAIL的敏感性诱导细胞凋亡. 但TRAIL对人正常肝细胞有不良反应作用. 因此, 如何避免在解决TRAIL耐药性后对正常组织造成损伤仍有待研究. 实验表明抗人DR5单克隆抗体能模拟TRAIL诱导肿瘤细胞凋亡, 且对人正常肝细胞没有不良反应作用[11,12].
我们采用ATPlite法检测伊立替康, hCTB006及其两者联合对胃癌细胞BGC823、SGC7901的杀伤作用, 结果显示50 μmol/L伊立替康单独作用BGC823、SGC7901细胞48 h, 细胞存活率分别为74%、87%, 250 ng/mL hCTB006单独作用BGC823、SGC7901细胞48 h, 细胞的存活率分别为85%、94%, 并没有明显抑制细胞的生长; 然而当50 μmol/L伊立替康与250 ng/mL的hCTB006联合作用时, BGC823细胞的存活率降低到42%, 而SGC7901的存活率为83%. 对BGC823有明显的协同作用, 对SGC7901则表现为拮抗作用. 实验结果显示hCTB006与伊立替康联合作用于BGC823、SGC7901效果是不一样的, 对于低分化的BGC823作用较中分化的SGC7901要显著. 这说明不同分化程度的胃癌细胞对化疗药物联合作用敏感性不同. 组间比较采用单因素的方差分析, 联合用药组与单独用药组比较,有显著性差异.
我们采用ELISA方法检测细胞DR5的表达量,这种方法不仅可以检测细胞膜表面DR5的表达量, 而且反映膜内膜外DR5的动态变化, 其可作为DR5的定量检测. ELISA结果表明用伊立替康处理胃癌细胞BGC823、SGC7901 48 h后, DR5的表达量无明显变化, 伊立替康可能未上调DR5的表达.
Vogler等[13]研究发现, TRAIL联合使用XIAP的抑制剂后, 体内体外实验均可以抑制胰腺癌的进展. Siegelin等[14]也发现TRAIL与XIAP的抑制剂恩倍素联合作用于神经胶质瘤细胞后可协同增效. 因此我们采用Western blot方法检测细胞内XIAP的表达, 进一步探讨两者之间的关系. 从Western blot结果来看, 伊立替康与hCTB006联合作用于BGC823后, 细胞内抑制凋亡蛋白XIAP水平明显降低, 而在SGC7901细胞中XIAP的表达有上调的趋势. 由此可见, 伊立替康联合作用hCTB006对低分化的胃癌细胞BGC823的协同作用可能与XIAP的下调有关, 而对中分化胃癌细胞SGC7901的拮抗作用可能XIAP的上调有关. XIAP是抑凋亡蛋白家族IAP中最有效的caspase抑制物, 可以通过抑制caspase-3和caspase-7的活性来抑制细胞凋亡[15]. 本实验通过研究伊立替康与hCTB006联合作用于低分化的BGC823细胞和中分化的SGC7901, 发现TRAIL介导的细胞凋亡途径可能与细胞内XIAP的表达有关. 其作用机制可能是: 在低分化BGC823细胞中联合用药可使肿瘤细胞内XIAP的表达下降, 从而对caspase的抑制作用减弱, 促进了TRAIL介导的细胞凋亡通路, 而在SGC7901细胞中XIAP的表达升高, 对caspase的抑制作用增加, 阻碍了TRAIL介导的凋亡通路. 联合用药对于不同分化程度的胃癌细胞存在差异, 其作用机制需进一步深入研究. 本文为抗肿瘤药物的开发提供了一个新方向, 也对以后临床联合使用化疗药物提供了参考.
化疗在胃癌的研究中占重要的地位, 但目前有效的治疗方案并不多, 因此寻找安全有效的治疗方案成为临床研究的热点.
陈国忠, 主任医师, 广西中医学院第一附属医院消化内科
目前国内外的研究发现, TRAIL与某些化疗药联合使用后, 可以促进肿瘤细胞凋亡. 也有文献报道, TRAIL联合XIAP的抑制剂后可协同增效, 但目前引起这种现象的机制并不明确.
研究指出, 紫花牡荆素、五味子酯、盐酸阿柔比星等抗肿瘤药物均可上调DR5表达, 从而增强TRAIL诱导的外源性凋亡通路. 一些报道也指出, TRAIL联合XIAP的抑制剂后, 对胰腺癌、神经胶质细胞瘤的生长均有抑制作用.
本文采用ELISA方法检测细胞DR5的表达, 这种方法不但可以反映细胞整体DR5的动态变化, 亦可作为DR5的定量检测指标.
本文为化疗药物伊立替康与分子靶向药物hCTB006联合作用于胃癌机制的研究, 为临床治疗方案的选择及个体化治疗提供一定的参考价值.
该研究选题新颖, 实验设计尚合理, 具有一定的科学意义.
编辑: 翟欢欢 电编:闫晋利
| 2. | 张 天泽. 肿瘤学. 天津: 天津科技出版社 1996; 1464-1465. |
| 3. | Holoch PA, Griffith TS. TNF-related apoptosis-inducing ligand (TRAIL): a new path to anti-cancer therapies. Eur J Pharmacol. 2009;625:63-72. [PubMed] [DOI] |
| 4. | Sensintaffar J, Scott FL, Peach R, Hager JH. XIAP is not required for human tumor cell survival in the absence of an exogenous death signal. BMC Cancer. 2010;10:11. [PubMed] [DOI] |
| 5. | Cree IA, Andreotti PE. Measurement of cytotoxicity by ATP-based luminescence assay in primary cell cultures and cell lines. Toxicol In Vitro. 1997;11:553-556. [PubMed] [DOI] |
| 6. | Chou TC. Preclinical versus clinical drug combination studies. Leuk Lymphoma. 2008;49:2059-2080. [PubMed] [DOI] |
| 7. | Wiezorek J, Holland P, Graves J. Death receptor agonists as a targeted therapy for cancer. Clin Cancer Res. 2010;16:1701-1708. [PubMed] [DOI] |
| 8. | Yang J, Yang Y, Tian L, Sheng XF, Liu F, Cao JG. Casticin-induced apoptosis involves death receptor 5 upregulation in hepatocellular carcinoma cells. World J Gastroenterol. 2011;17:4298-4307. [PubMed] [DOI] |
| 9. | Inoue H, Waiwut P, Saiki I, Shimada Y, Sakurai H. Gomisin N enhances TRAIL-induced apoptosis via reactive oxygen species-mediated up-regulation of death receptors 4 and 5. Int J Oncol. 2012;40:1058-1065. [PubMed] |
| 10. | Horinaka M, Yoshida T, Nakata S, Shiraishi T, Tomosugi M, Yoshikawa S, Wakada M, Sakai T. Aclarubicin enhances tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis through death receptor 5 upregulation. Cancer Sci. 2012;103:282-287. [PubMed] [DOI] |
| 11. | Jo M, Kim TH, Seol DW, Esplen JE, Dorko K, Billiar TR, Strom SC. Apoptosis induced in normal human hepatocytes by tumor necrosis factor-related apoptosis-inducing ligand. Nat Med. 2000;6:564-567. [PubMed] [DOI] |
| 12. | Kari JA. Pregnancy outcome in connective tissue diseases. Saudi Med J. 2001;22:590-594. [PubMed] |
| 13. | Vogler M, Walczak H, Stadel D, Haas TL, Genze F, Jovanovic M, Gschwend JE, Simmet T, Debatin KM, Fulda S. Targeting XIAP bypasses Bcl-2-mediated resistance to TRAIL and cooperates with TRAIL to suppress pancreatic cancer growth in vitro and in vivo. Cancer Res. 2008;68:7956-7965. [PubMed] [DOI] |
| 14. | Siegelin MD, Gaiser T, Siegelin Y. The XIAP inhibitor Embelin enhances TRAIL-mediated apoptosis in malignant glioma cells by down-regulation of the short isoform of FLIP. Neurochem Int. 2009;55:423-430. [PubMed] [DOI] |
| 15. | Nachmias B, Ashhab Y, Ben-Yehuda D. The inhibitor of apoptosis protein family (IAPs): an emerging therapeutic target in cancer. Semin Cancer Biol. 2004;14:231-243. [PubMed] [DOI] |