修回日期: 2012-09-14
接受日期: 2012-10-29
在线出版日期: 2012-11-08
目的: 探讨Hippo信号通路的核心组件Mst1、Lats1及Yap1在正常组、慢性萎缩性胃炎伴肠上皮化生、不典型增生、胃癌组中的表达及临床意义.
方法: 应用PV-6000两步免疫组织化学法测定Hippo通路中3个核心组件Mst1、Lats1及Yap1在30例正常胃黏膜, 60例肠上皮化生、不典型增生及胃癌胃黏膜中的表达情况.
结果: Mst1、Lats1在胃癌中的阳性表达率明显低于其余各组, 其中Mst1在胃癌组与正常组, 肠上皮化生组, 不典型增生组中阳性表达的差异有明显统计学意义(P分别为0.000、0.001和0.007), 而Lats1在胃癌组与正常组, 肠上皮化生组, 不典型增生组中阳性表达也有显著差异(P分别为0.006、0.002和0.004). 由正常组至不典型增生组, Mst1、Lats1的阳性表达率呈逐渐降低的趋势; Yap1在胃癌中的阳性表达率明显高于其余3组(P分别为0.000、0.002和0.006), 差异有统计学意义; Yap1由正常组至不典型增生组其阳性表达率呈逐渐增高的趋势; Mst1、Lats1及Yap1的阳性表达率与胃癌分化程度及有无淋巴结转移密切相关, 差异有显著统计学意义(P分别为0.007、0.028; 0.007、0.014; 0.009、0.013); 胃癌组织中, Yap1与Mst1、Lats1的表达呈负相关(r分别为-0.715、-0.642), Mst1与Lats1的表达呈正相关(r = 0.702).
结论: Hippo信号通路在胃癌的发生发展中起着重要作用, 其转录共激活因子Yap可能会成为胃癌治疗中新的靶点.
引文著录: 魏文超, 张翠萍, 张琪, 王小玮, 张红珠, 赵坤, 田字彬. Hippo信号通路在胃黏膜癌变过程中的作用. 世界华人消化杂志 2012; 20(31): 3027-3032
Revised: September 14, 2012
Accepted: October 29, 2012
Published online: November 8, 2012
AIM: To observe the expression of Mst1, Lats1 and YAP1 in normal gastric mucosa, chronic atrophic gastritis with intestinal metaplasia, dysplasia and gastric cancer.
METHODS: Immunohistochemistry was used to investigate the expression of Mst1, Lats1 and YAP1 in 30 cases of normal gastric musoca, 60 cases of chronic atrophic gastritis with intestinal metaplasia, 60 cases of dysplasia, and 60 cases of gastric cancer.
RESULTS: The positive rates of Mst1 and Lats1 expression in gastric cancer were significantly lower than those in the normal control group, intestinal metaplasia group, and dysplasia group (Mst1: P = 0.000, 0.001, 0.007; Lats1: P = 0.006, 0.002, 0.004). Mst1 and Lats1 expression showed a decreasing trend from the normal gastric mucosa to dysplasia. The positive rate of Yap1 expression in gastric cancer was significantly higher than those in the normal control group, intestinal metaplasia group, and dysplasia group (P = 0.006, 0.002, 0.004), and Yap1 expression showed an increasing trend from the normal gastric mucosa to dysplasia. The positive rates of Mst1, Lats1 and Yap1 expression had a close correlation with tumor differentiation and lymph node metastasis (P = 0.007, 0.028, 0.007; P = 0.014, 0.009, 0.013). The positive rate of Yap1 expression had a negative correlation with those of Mst1 and Lats1 expression in gastric caner (r = -0.715, -0.642), while Mst1 expression had a positive correlation with Lats1 expression (r = 0.702).
CONCLUSION: The Hippo signaling pathway may play an important role in the development of gastric cancer.
- Citation: Wei WC, Zhang CP, Zhang Q, Wang XW, Zhang HZ, Zhao K, Tian ZB. Expression of Hippo signaling molecules in gastric carcinogenesis. Shijie Huaren Xiaohua Zazhi 2012; 20(31): 3027-3032
- URL: https://www.wjgnet.com/1009-3079/full/v20/i31/3027.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i31.3027
胃癌是常见的恶性肿瘤之一, 发病率很高. 在我国, 胃癌死亡率占所有恶性肿瘤死亡率的23.02%, 居各类癌症死亡率的首位[1,2]. 在因消化系恶性肿瘤的死亡病例中, 约有半数死于胃癌. 胃癌的病因目前尚未明确, 幽门螺杆菌(Helicobacer pylori, H. pylori)感染、慢性炎症和宿主之间的协同作用可引起胃黏膜癌变. 从正常胃黏膜→慢性浅表性胃炎→慢性萎缩性胃炎→肠上皮化生→异型增生→胃癌的途径已为大多数学者接受[3]. 胃癌的致病因素包括饮食不当, H. pylori感染, 炎性介质的参与, 癌基因的激活及抑癌基因的失活, 信号通路的异常等[4-6]. Hippo通路作为近年来新发现的信号通路, 在维持器官大小、调控细胞增殖及凋亡方面, 发挥着极为重要的作用[7]. 本实验通过免疫组织化学方法检测Hippo通路中的核心组件在正常胃组织、慢性萎缩性胃炎伴肠上皮化生、不典型增生、胃癌组织中的表达情况, 以研究胃癌发生的机制, 从而为针对胃癌的靶向治疗提供新的思路.
经我院伦理委员会批准, 与患者沟通并经患者知情同意后, 选取H. pylori阳性的慢性萎缩性胃炎伴肠上皮化生、不典型增生的标本各60例. 选自2009-06/2011-12在青岛大学医学院附属医院经胃镜检查并取组织活检, 经本院病理科确诊者; 与患者沟通并经患者知情同意后, 选取胃癌标本60例, 选自2009-06/2011-12在青岛大学医学院附属医院手术室进行胃癌根治手术, 术后经病理科诊断为胃癌者; 并选取远端正常胃组织30例作为对照. 实验选用与HE染色一致的蜡块制成4 µm切片行免疫组织化学染色. 入选标准: 随机选取, 胃癌前疾病患者在经病理科确诊前未经过药物干预治疗, 胃癌患者术前未经过放化疗等治疗. 多克隆兔抗人Mst1抗体, 多克隆兔抗人肿瘤抑制基因Lats1抗体, 多克隆兔抗人原癌基因Yes相关蛋白1抗体及PV6000试剂盒、CD34单克隆抗体(即用型), DAB染色剂分别购自北京博奥森生物技术有限公司及北京中杉金桥生物技术有限公司.
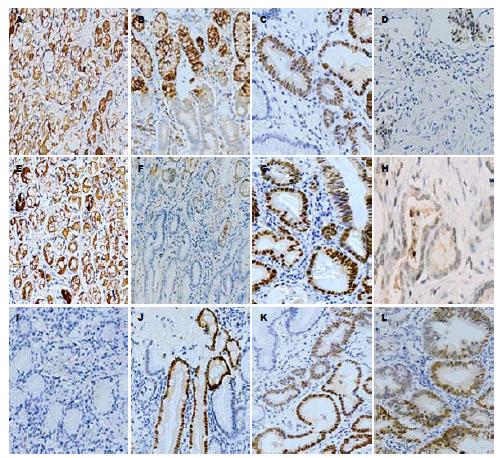
Mst1、Lats1主要定位于细胞质中, 阳性染色为胞质被染成棕黄色. Yap1定位于细胞质或细胞核中(主要为细胞核), 阳性染色为胞质或胞核染成棕黄色. 采用PV6000两步免疫组织化学法测定[8]. 染色强度(A)分为0分(无染色); 1分(弱染色); 2分(中度染色); 3分(强染色). 3个随机选取的视野中, 根据200个细胞中阳性细胞所占的比例数(B)分为0(<5%); 1(5%-25%); 2(26%-50%); 3(51%-75%); 4(>75%). 综合A与B, 结果分为0(-); 1-4(+); 5-8(++); 9-12(+++).
统计学处理 所有数据均应用SPSS19.0统计软件进行统计学数据处理, 在不同胃黏膜组中表达的强度差异采用K-W秩和检验, 与胃癌的临床病理特征之间的关系采用χ2检验, 多组间的两两比较用Bonferroni方法校正检验水平, P<0.05认为差异有统计学意义; 应用非参数统计中Spearman等级相关对3种因子进行相关分析, P<0.05认为差异有统计学意义.
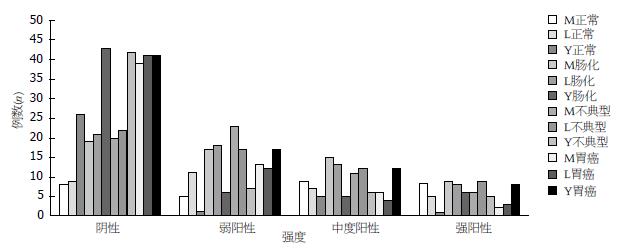
如图1所示, 随着疾病进展, Mst1和Lats1在胃组织中的阳性表达率逐渐降低, Yap1在胃组织中的阳性表达率逐渐增高.
Mst1的K-W秩和检验示统计量H = 23.846, P = 0.000, 说明Mst1在4组中的阳性表达率各不相同; 对任意2组进行两两比较, 检验水平α = 0.05, 因4组间共比较6次, 最终取α = 0.05/6 = 0.0083; 胃癌与正常组, 肠上皮化生组, 不典型增生组阳性表达的差异有统计学意义, P分别为0.000, 0.001和0.007; 余组间比较无明显统计学意义. Lats1的K-W秩和检验示统计量H = 15.956, P = 0.001. 胃癌与正常组, 肠上皮化生组, 不典型增生组阳性表达的差异有统计学意义, P分别为0.006, 0.002和0.004; 余组间比较无明显统计学意义. Yap1的K-W秩和检验示统计量, H = 23.287, P = 0.000, 说明Yap1在4组中的阳性表达率各不相同; 胃癌与正常组, 肠上皮化生组及不典型增生组阳性表达的差异有统计学意义, P分别为0.000, 0.002和0.006; 余组间比较无明显统计学意义(图2).
Mst1、Lats1和Yap1在胃癌中阳性表达的差异与分化程度的不同及有无淋巴结转移有明显统计学意义, P值分别为0.007、0.028、0.007、0.014、0.009和0.013. 而与性别、病理类型表达的差异无统计学意义(P>0.05, 表1).
| n | Mst1阳性表达数 | P值 | Lats1阳性表达数 | P值 | Yap1阳性表达数 | P值 | |
| 性别 | |||||||
| 男 | 42 | 15 | 0.859 | 14 | 0.672 | 25 | 0.602 |
| 女 | 18 | 6 | 5 | 12 | |||
| 分化程度 | |||||||
| 高 | 29 | 15 | 0.007 | 14 | 0.007 | 13 | 0.009 |
| 中低 | 31 | 6 | 5 | 24 | |||
| 病理类型 | |||||||
| 肠型胃癌 | 26 | 10 | 0.623 | 10 | 0.322 | 18 | 0.292 |
| 弥漫型胃癌 | 34 | 11 | 9 | 19 | |||
| 有无淋巴结转移 | |||||||
| 有 | 16 | 2 | 0.028 | 9 | 0.014 | 14 | 0.013 |
| 无 | 44 | 19 | 10 | 23 | |||
胃癌组织中Mst1与Yap1异向表达52例(Mst1阳性而Yap1阴性18例, Mst1阴性而Yap1阳性34例), 同向表达8例(共同阳性3例, 共同阴性5例); Lats1与Yap1异向表达50例(Lats1阳性而Yap1阴性16例, Lats1阴性而Yap1阳性34例), 同向表达10例(共同阳性3例, 共同阴性7例); Mst1、Lats1与Yap1的表达均呈负相关, r分别为-0.715和-0.642, P均为0.000; 胃癌组织中Mst1与Lats1异向表达8例(Mst1阳性而Lats1阴性5例, 反之为3例), 同向表达52例(共同阳性16例, 共同阴性36例), Mst1与Lats1的表达呈正相关, r = 0.702, P = 0.000.
Hippo信号通路首先在黑腹果蝇体内被发现, 是一种高度保守的信号通路[9]. 他在无脊椎动物和脊椎动物中都发挥着调节细胞增殖和凋亡的重要作用[10]. Hippo通路在哺乳动物中主要由Mst、WW45、Lats、Mob及Yap等构成[9]. 该通路可以抑制细胞生长、诱导细胞凋亡和调控器官大小.该通路一旦失活, 就会使其下游靶基因Yap激活从而导致恶性肿瘤的发生 .
Mst1属于蛋白激酶STE20家族成员[12]. 他的N末端包括丝氨酸/苏氨酸蛋白激酶结构域, 而中心及C末端有卷曲螺旋结构域, 这一结构域指的SARAH结构域[13]. Mst1是Hippo通路中重要的抑癌基因之一[14]. 在哺乳动物体内, 当细胞过量增殖时, Mst1会促进细胞凋亡. 目前研究显示, Mst1通过Mst1(Thr183)/Mst2(Thr180)位点进行自身磷酸化, 激活SAPK、Jnk和P53等信号通路, 最终启动细胞凋亡[15]. Mst缺失的视网膜细胞, 其抑制增殖的能力丧失, 与Cyclin E表达的增加有关, 与此同时, 其促进凋亡的能力下降, 与Diap的降解量减少有关[16]. 在Hippo通路的作用机制中, Mst1可以使Lats1活化, 而Lats1的活化会导致Yap的活性受到抑制从而抑制细胞的过度增殖[17]. Mst1的缺失会导致许多器官如前列腺、胃的过度生长从而导致癌症的发生[18]. 但这种现象具有器官特异性, 肺/肾等器官中Mst1的缺失则无明显的过度增殖现象的发生. 而Lats1在Hippo通路中也发挥着与Mst1相似的作用. Lats1属于NDR蛋白激酶家族成员, 其C末端为丝氨酸/苏氨酸蛋白激酶结构域, 其通过该结构域与WW45相互作用[19]. 从而被Mst1活化而进一步发挥作用. 研究发现, 在大鼠中Last1的剔除会导致卵巢肿瘤和软组织肉瘤, 而Lats1的超甲基化与星型细胞瘤和乳腺癌有关[20]. 我们的研究发现, Mst1和Lats1在正常胃黏膜组, 肠上皮化生组及不典型增生组中阳性表达率的差异无明显统计学意义(可能由于实验例数不充分等条件的限制), 但总体上呈递减趋势, 至胃癌中的阳性表达率逐渐降低, 且随着胃癌恶性程度的增加及淋巴结转移, Mst1、Lats1的表达率也逐渐降低, 这与文献报道的相似[21]. 这可能与在正常胃黏膜中, Hippo通路被激活而发挥其抑癌作用有关. 但随着疾病进展, 该通路由于一系列反应而逐渐失去活性, Mst1、Lats1的活性也逐渐降低, 最终导致其表达率逐渐降低.
Yap1是Hippo通路的转录共激活因子, 是一个高度保守的蛋白, 与果蝇中的Yki具有相似的生物学活性. 作为一个候选的致癌基因, Yap1的扩增增加了细胞周期相关的Cyclin E与Diap1的转录活性, 故增加了细胞增殖, 从而使细胞凋亡受阻[22]. 在慢性浅表性胃炎中, Yap1表达活性较低, 少量表达于细胞质中, 而在细胞核中几乎不表达. 我们的研究发现, 随着疾病进展, 虽然Yap1在正常组、肠上皮化生组及不典型增生组中的阳性表达率的差异无明显统计学意义, 但直至进展至胃癌的过程中, Yap的表达活性呈逐渐增强的趋势, 这与文献报道的相似[23]. 说明Yap1可能具有促进细胞增殖的作用. 在胃癌组织中, Mst1、Lats1及Yap1的表达率与胃癌分化程度及有无淋巴结转移密切相关, 提示他们在胃癌的发生发展及浸润转移过程中起到重要作用; 胃癌组织中, Yap1与Mst1、Lats1的表达呈负相关, Mst1与Lats1的表达呈正相关, 提示他们在胃癌的发生发展中起到相互制约或促进的作用. 由此可见, Mst1、Lats1及Yap1可作为胃癌生物学行为的指标, 对胃癌的靶向治疗提供理论依据.
胃癌的致病因素包括饮食不当、H. pylori感染、炎性介质的参与、癌基因的激活与抑癌基因的失活及信号通路的异常等. Hippo通路作为近年来新发现的信号通路, 在调控细胞增殖及凋亡方面, 发挥着重要的作用, 近年来研究表明其在肿瘤的发生发展中也起到重要的作用.
张庆瑜, 教授, 主任医师, 天津医科大学总医院科研处
研究发现, Hippo信号通路与细胞的增殖与凋亡密切相关, 并能调节器官的大小, 故目前Hippo信号通路与肿瘤的相关研究正逐渐成为热点, 而Hippo信号通路与胃癌的关系也正在引起重视.
Xu的研究表明Hippo信号通路参与了胃癌的发生发展, Mst1在正常胃黏膜进展至胃癌的过程中表达率逐渐降低.
目前关于Hippo通路与肝癌的研究较多, 而与胃癌关系的研究相对较少, 本实验观察了Mst1、Lats1及Yap1在正常胃黏膜、肠上皮化生、不典型增生及胃癌组织中的表达情况, 主要从分子方面研究了胃癌的发生发展.
Hippo信号通路: 首先由Edgar等在黑腹果蝇体内发现, 在哺乳动物中主要由Mst、WW45、Lats、Mob及Yap等组成, 是调节细胞增殖和凋亡的重要通路.
本研究的内容比较重要, 并且立题较为新颖.
编辑: 田滢 电编:鲁亚静
| 3. | 林 一帆, 王 长洪, 刘 杰, 胡 家露, 宋 福林, 陆 宇平, 陈 山泉, 杨 卓. 胃癌与癌前病变CdX2基因蛋白表达的意义. 世界华人消化杂志. 2004;12:1971-1973. [DOI] |
| 4. | Jarosz M, Sekuła W, Rychlik E, Figurska K. Impact of diet on long-term decline in gastric cancer incidence in Poland. World J Gastroenterol. 2011;17:89-97. [PubMed] [DOI] |
| 6. | Michael Stock,Florian Otto. Gene deregulation in gastric cancer. Gene. 2005;360:1-19. [PubMed] [DOI] |
| 7. | Zhao B, Lei QY, Guan KL. The Hippo-YAP pathway: new connections between regulation of organ size and cancer. Curr Opin Cell Biol. 2008;20:638-646. [PubMed] [DOI] |
| 8. | Guo AT, Song X, Wei LX, Zhao P. Histological origin of pseudomyxoma peritonei in Chinese women: clinicopathology and immunohistochemistry. World J Gastroenterol. 2011;17:3531-3537. [PubMed] [DOI] |
| 9. | Zeng Q, Hong W. The emerging role of the hippo pathway in cell contact inhibition,organ size control,and cancer development in mammals. Cancer Cell. 2008;13:188-192. [PubMed] [DOI] |
| 10. | Badouel C, Garg A, McNeill H. Herding Hippos: regulating growth in flies and man. Curr Opin Cell Biol. 2009;21:837-843. [PubMed] [DOI] |
| 11. | Zhao B, Wei X, Li W, Udan RS, Yang Q, Kim J, Xie J, Ikenoue T, Yu J, Li L. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control. Genes Dev. 2007;21:2747-2761. [PubMed] [DOI] |
| 12. | Morinaka A, Funato Y, Uesugi K, Miki H. Oligomeric peroxiredoxin-I is an essential intermediate for p53 to activate MST1 kinase and apoptosis. Oncogene. 2011;30:4208-4218. [PubMed] [DOI] |
| 13. | Praskova M, Khoklatchev A, Ortiz-Vega S, Avruch J. Regulation of the MST1 kinase by autophosphorylation, by the growth inhibitory proteins, RASSF1 and NORE1, and by Ras. Biochem J. 2004;381:453-462. [PubMed] [DOI] |
| 14. | Artemenko Y, Batsios P, Borleis J, Gagnon Z, Lee J, Rohlfs M, Sanséau D, Willard SS, Schleicher M, Devreotes PN. Tumor suppressor Hippo/MST1 kinase mediates chemotaxis by regulating spreading and adhesion. Proc Natl Acad Sci U S A. 2012;109:13632-13637. [PubMed] [DOI] |
| 15. | Lin Y, Khokhlatchev A, Figeys D, Avruch J. Death-associated protein 4 binds MST1 and augments MST1-induced apoptosis. J Biol Chem. 2002;277:47991-48001. [PubMed] [DOI] |
| 16. | Harvey KF, Pfleger CM, Hariharan IK. The Drosophila Mst ortholog, hippo, restricts growth and cell proliferation and promotes apoptosis. Cell. 2003;114:457-467. [PubMed] [DOI] |
| 17. | Avruch J, Zhou D, Fitamant J, Bardeesy N. Mst1/2 signalling to Yap: gatekeeper for liver size and tumour development. Br J Cancer. 2011;104:24-32. [PubMed] [DOI] |
| 18. | Cinar B, Collak FK, Lopez D, Akgul S, Mukhopadhyay NK, Kilicarslan M, Gioeli DG, Freeman MR. MST1 is a multifunctional caspase-independent inhibitor of androgenic signaling. Cancer Res. 2011;71:4303-4313. [PubMed] [DOI] |
| 19. | Callus BA, Verhagen AM, Vaux DL. Association of mammalian sterile twenty kinases, Mst1 and Mst2, with hSalvador via C-terminal coiled-coil domains, leads to its stabilization and phosphorylation. FEBS J. 2006;273:4264-4276. [PubMed] [DOI] |
| 20. | Visser-Grieve S, Zhou Z, She YM, Huang H, Cyr TD, Xu T, Yang X. LATS1 tumor suppressor is a novel actin-binding protein and negative regulator of actin polymerization. Cell Res. 2011;21:1513-1516. [PubMed] [DOI] |
| 21. | Xu ZP, Zhu JS, Zhang Q, Wang XY. A breakdown of the Hippo pathway in gastric cancer. Hepatogastroenterology. 2011;58:1611-1617. [PubMed] [DOI] |
| 23. | Lam-Himlin DM, Daniels JA, Gayyed MF, Dong J, Maitra A, Pan D, Montqomery EA, Anders RA. The hippo pathway in human upper gastrointestinal dysplasia and carcinoma:a novel oncogenic pathway. Int J Gastrointest Cancer. 2006;37:103-109. [PubMed] |