修回日期: 2012-08-24
接受日期: 2012-09-20
在线出版日期: 2012-10-28
目的: 探讨在胃肠道间质瘤(gastrointestinal stromal tumors, GIST)细胞中, 通过体外构建干扰etv1基因的shRNA载体, 干扰ETV1表达, 观察对其侵袭力的影响.
方法: 体外构建干扰hetv1基因的shRNA慢病毒载体, 感染GIST-T1细胞. 设立空白组, 阴性对照组(PLVX-shRNA组)和实验组(PLVX-shRNA-ETV1组), 用Western blot对合成的靶点进行筛选, 采用体外侵袭力试验(Transwell法)和细胞免疫组织化学法检测感染前后细胞侵袭力和蛋白表达的影响.
结果: 实验组中PLVX-shRNA-ETV1-3亚组hETV1蛋白表达与其他组相比, 其表达量最少. 在体外侵袭力实验中, 实验组穿过滤膜微孔细胞数明显少与空白组及阴性对照组, 有显著性差异(P<0.05); 同时在细胞免疫组织化学试验中, 实验组c-Kit蛋白及MMP-2蛋白表达比空白组及阴性对照组少, 有显著性差异(P<0.05).
结论: 通过体外干扰ETV1转录因子, GIST-T1细胞的体外侵袭力明显减弱, 从而影响GIST的发展和转移.
引文著录: 李强, 徐龙. ETV1转录因子在胃肠道间质瘤中的作用. 世界华人消化杂志 2012; 20(30): 2888-2894
Revised: August 24, 2012
Accepted: September 20, 2012
Published online: October 28, 2012
AIM: To investigate the effect of shRNA-mediated knockdown of the ETV1 transcription factor gene on the invasive ability of gastrointestinal stromal tumors-T1 (GIST-T1) cells.
METHODS: A recombinant lentiviral vector carrying a shRNA targeting the etv1 gene (PLVX-shRNA-ETV1) was constructed and used to infect GIST-T1 cells. GIST-T1 cells were divided into three groups: blank control group, negative control group (PLVX-shRNA), and experimental group (PLVX-shRNA-ETV1). After infection, expression of ETV1 protein was detected by Western blot, cell invasion was detected by Transwell assay, and expression of C-kit and MMP-2 proteins was detected by immunohistochemistry.
RESULTS: Expression of ETV1 protein was significantly decreased in cells infected with the PLVX-shRNA-ETV1 vector compared to other groups. The number of cells passing through the martrigel-coated Transwell membrane was significantly lower in the experimental group than in the blank control group and negative control group (60.2000 ± 4.8503 vs 166.2000 ± 14.4201, 142.2000 ± 4.3787, both P < 0.05). Expression of C-kit and MMP-2 proteins was significantly lower in the experimental group than in the blank control group and negative control group (both P < 0.05).
CONCLUSION: ShRNA-mediated knockdown of the ETV1 transcription factor significantly reduces invasive ability of GIST-T1 cells.
- Citation: Li Q, Xu L. ShRNA-mediated down-regulation of the ETV1 transcription factor gene reduces invasive ability of gastrointestinal stromal tumor-T1 (GIST-T1) cells. Shijie Huaren Xiaohua Zazhi 2012; 20(30): 2888-2894
- URL: https://www.wjgnet.com/1009-3079/full/v20/i30/2888.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i30.2888
胃肠道间质瘤(gastrointestinal stromal tumors, GIST)是胃肠道最常见的间叶组织肿瘤, 主要由kit或pdgfra基因突变(kit或pdgfra是酪氨酸激酶受体), 导致酪氨酸激酶持续的活化引起细胞增殖分化失控导致GIST. 目前, 临床针对突变的kit或pdgfra基因为干扰靶点研发的药物, 比如: 伊马替尼等抗肿瘤药物, 但是由于突变的kit或pdgfra基因存在多位点和二次突变的现象, 从而导致抗肿瘤药物的耐药, 这就需要我们寻找新的GIST干预靶点, 从而改善GIST的治疗和预后. ETV1是转录因子ETS家族的成员之一, 高表达于GIST, 在调节GIST的基因转录中, ETV1是一个很主要的调节因子. 本研究体外构建干扰etv1基因的shRNA载体, 干扰ETV1表达, 观察对GIST的侵袭力的影响, 以期找到新的GIST治疗靶点.
人胃肠道间质瘤细胞株GIST-T1由上海拜力生物科技有限公司提供; 高糖的DMEM培养基、胎牛血清(美国Hyclone公司); 兔抗人的ER81单克隆抗体(英国ABCAM公司), 辣根过氧化物酶标记的羊抗兔IgG(北京中杉生物公司), β-Actin抗体(英国ABCAM公司); Transwell小室(8.0 μm孔径PC膜, 美国Corning公司), 基质胶(Matrigel, 美国BD公司), 趋化因子(FN, 美国BD公司), 牛血清白蛋白(BSA, 美国AMRESCO公司); c-Kit及MPP-2抗体(北京中杉生物公司); CO2培养箱(Sanyo公司), 超净工作台(苏州半导体设备厂), Olympus倒置显微镜及成像系统IX71(日本Olympus公司), Bio-Rad DNA电泳系统Sub-Cell GT Cell电泳槽(美国Bio-Rad公司), Bio-Rad蛋白电泳系统Mini-PROTEAN3电泳槽(美国Bio-Rad公司), Bio-Rad半干转膜仪(美国Bio-Rad公司), Bio-Rad凝胶成像系统Gel Imager, Gel-Doc(美国Bio-Rad公司), MicroChemi化学发光成像仪(以色列DNR公司).
1.2.1 细胞培养: GIST-T1用含10%胎牛血清的高糖的DMEM培养基置于37 ℃恒温、50 mL/L CO2的饱和湿度培养箱中培养.
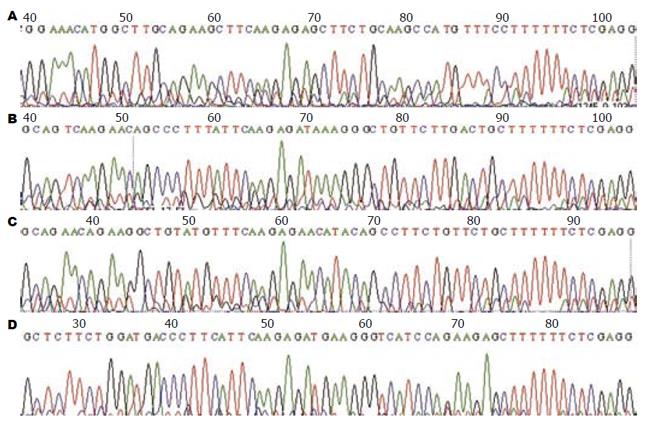
1.2.2 hetv1基因沉默慢病毒质粒的构建: 根据hetv1基因序列设计4条shRNA, 从invitrogen公司合成shRNA片段如下: shRNA-hETV1-1: 5'-GGAAACATGGCTTGCAGAAGC-3'; shRNA-hETV1-2: 5'-GCAGTCAAGAACAGCCCTTTA-3'; shRNA-hETV1-3: 5'-GCAGAACAGAAGGCTGTATGT-3'; shRNA-HetV1-4: 5'-GCTCTTCTGGATGACCCTTCA-3'. 分别用100 μL退火Buffer(10 mmol/L Tris-HCl, 50 mmol/L NaCl, pH 8.0)充分溶解合成DNA片段. 分别对应各取2 mL DNA引物片段(如hAQP8-1-F与hAQP8-1-R)+16 μL退火Buffer, 充分混匀, 100 ℃退火自然冷却至室温. 各取1 μL退火产物+99 μL无菌水稀释100倍. 载体PLVX-shRNA2-m用限制性内切酶PstⅠ酶切, 然后用Klenow酶补平, 限制性内切酶BamHⅠ第二次酶切. 琼脂糖凝胶回收酶切大片段. 质粒PLVX-shRNA2-m回收大片段与hETV1的shRNA稀释退火产物的连接, 22 ℃水浴反应过夜. 各取10 μL过夜连接产物转化100 μL JM109感受态细胞, 将连接产物与感受态细胞混匀后冰浴30 min, 42 ℃热激45 s, 立即置冰上放置2 min, 加入预热至室温的400 μL LB培养基, 200 r/min, 37 ℃恒温摇床培养1 h, 4 000 r/min离心1 min, 弃去400 μL培养上清, 剩余100 μL用移液器混匀后均匀涂布于含100 μg/mL Ampicillin抗性的LB平板上, 37 ℃恒温培养箱倒置培养过夜. 分别挑取4-6个单菌落接种于含5 mL 100 μg/mL Ampicillin抗性的LB培养液中, 250 r/min, 37 ℃恒温摇床培养过夜, 用小量质粒抽提试剂盒抽提质粒, 并分别用XhoⅠ酶切鉴定, 挑取酶切鉴定正确的菌液测序, 测序引物为U6-F: 5'-TACGATACAAGGCTGTTAGAGAG-3'. 用Qiagen大规模质粒抽提试剂盒提取测序结果正确的质粒PLVX-shRNA2-hETV1-1、PLVX-shRNA2-hETV1-2、PLVX-shRNA2-hETV1-3和PLVX-shRNA2-hETV1-4.
1.2.3 转染: 病毒感染前24 h将细胞置于12孔板. 加入1 mL适当的完全培养基(含有血清和抗生素)孵育过夜. 在转染当天细胞应该达到约50%, 准备完全培养基和Polybrene混合物, Polybrene终浓度为: 8 μg/mL. 移去培养基并添加1 mL Polybrene/培养基混合物于每孔中, 在室温下溶化慢病毒颗粒, 使用前轻轻混匀. 培养液中加入shRNA慢病毒颗粒以感染细胞, 轻轻振动培养板使其混匀并孵育过夜. 8 h(<12 h)后移去培养液并添加1 mL完全培养基(不含Polybrene). 孵育细胞过夜. 48-72 h在免疫荧光显微镜下观察转染情况.
1.2.4 Western blot筛选hETV1-shRNA: 接种GIST细胞到六孔板中, 每个孔接种5×105个细胞, 37 ℃、50 mL/L CO2培养箱培养过夜. 用脂质体转染Lipofectamine 2000分别转染质粒PLVX-shRNA2-hETV1-1、PLVX-shRNA2-hETV1-2、PLVX-shRNA2-hETV1-3和PLVX-shRNA2-hETV1-4到GIST细胞中, 6 h后换液, 37 ℃、50 mL/L CO2, 培养箱培养过夜. 培养48 h后收集细胞, 各用100 μL RIPA Buffer消化30 min, 100 ℃孵育10 min, 于4 ℃, 15 000 r/min离心10 min弃去沉淀, 保留上清于EP管中, -20 ℃冰箱保存. 为确保每个蛋白样品的上样量一致, 用Brandford蛋白浓度测定试剂盒测定每个蛋白样品的蛋白浓度, 15%的凝胶配置, 在收集的蛋白样品中加入5×SDS-PAGE缓冲液, 沸水浴中加热5-10 min, 以充分变性蛋白, 冷却到室温后, 12 000 r/min离心5 min, 把蛋白样品上样到SDS-PAGE胶加样孔内, 100V, 120 min电泳. 到预计的蛋白已经被适当分离后即可停止电泳, 转至PVDF膜上, 加入5%的脱脂奶粉, 室温封闭60 min, 分别进行一抗和二抗孵育, 在化学发光成像系统显色拍照.
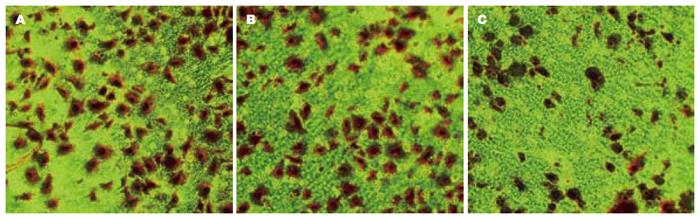
1.2.5 Transwell侵袭实验: GIST-T1细胞转染后48 h用无血清高糖的DMEM培养基饥饿12 h. 调整细胞浓度为1×106个细胞/mL, 每个侵袭小室上室加含0.1%BSA细胞悬液(不含胎牛血清的培养基)100 μL. 每个侵袭小室下室加600 μL含10%胎牛血清培养基. 其中侵袭小室接种前一晚在小室滤膜内表面涂40 μL的FN(125 μg/mL)作为趋化因子, 内表面涂40 μL Matrigel(500 μg/mL), 置于37 ℃恒温、50 mL/L CO2的培养箱孵育12 h, 用棉签轻轻擦去滤膜上层的细胞, 取下滤膜, 900 mL/L乙醇固定, 0.1%结晶紫溶液染色, 置于显微镜下观察并拍照, 每膜计算上下左右中5个低倍视野(×100) 进行细胞计数, 计算平均值, 每组设3个平行孔.
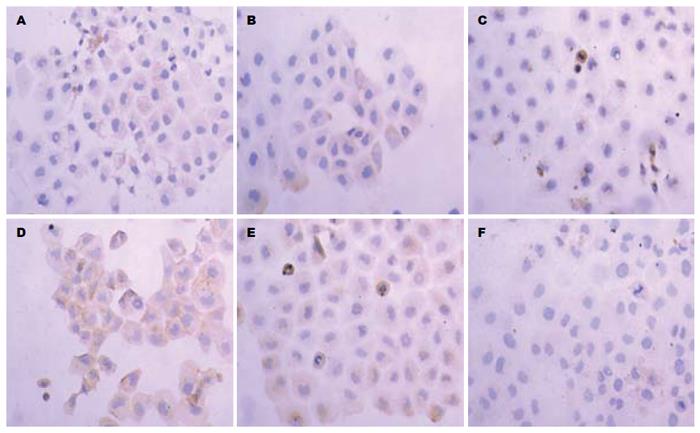
1.2.6 细胞免疫组织化学: 用含10%胎牛血清的高糖DMEM培养基培养细胞, 待细胞基本铺满培养瓶的底部时, 分别加入干扰后的慢病毒(包括空质粒的慢病毒), 共培养24 h, 经0.25%的胰酶消化3-5 min, 常温下离心1 000 r/min, 离心5 min, 弃上清, 在6孔板中加入预先包被多聚赖氨酸的盖玻片, 将已经消化好的单细胞悬在培养基中, 浓度调整为1×105个细胞/mL, 每孔加入2 mL细胞悬液, 过夜后取出盖玻片. 用950 mL/L乙醇脱水固定, PBS冲洗3次, 3%H2O2去离子水孵育5 min, PBS冲洗3次, 分别滴加c-Kit及MMP-2抗体, 4 ℃过夜, PBS冲洗3次, 滴加通用型IgG抗体-HRP多聚体, 37 ℃孵育15 min, PBS冲洗3次, 应用DAB溶液显色. 蒸馏水冲洗、复染、脱水. 透明封片.
统计学处理 采用mean±SD表示, 组间比较用SPSS13.0统计软件进行方差分析.
合成的4个靶点干扰序列分别经过XhoⅠ单酶切鉴定和测序结果证明, hetv1基因已正确插入到原核表达载体PLVX-shRNA中, PLVX-shRNA-hETV1构建成功(图1, 2).
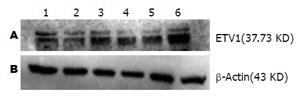
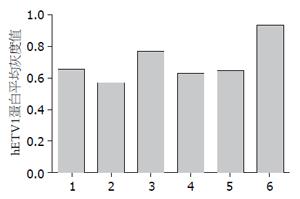
分别用合成的4个靶点序列包装慢病毒, 转染GIST-T1细胞, 用Western blot方法检测各组干扰靶点hETV1蛋白的表达情况. 根据图3, 4所示, 其各组阳性对照蛋白β-Actin条带灰度基本相一致, 空白组hETV1蛋白表达量较高, 质粒PLVX-shRNA2-hETV1-3 hETV1蛋白表达与其他各组相比, 其灰度最低, 通过条带灰度检测软件Quantity One测得的灰度值也最低. 所以最终选择沉默效果最好的质粒PLVX-shRNA2-hETV1-3进行大量包装慢病毒, 进行后续实验.
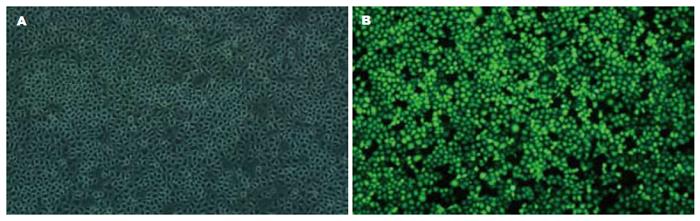
经PLVX-shRNA2-hETV1-3慢病毒转染的GIST-T1细胞, 转染率达90%以上, 表明已合成的干扰序列90%以上转入GIST-T1细胞核中, 从而为合成的干扰etv1基因序列在细胞核内沉默etv1基因奠定了前期理论基础(图5).
空白组(166.2000±14.4201), 阴性对照组(142.2000±4.3787), 实验组(60.2000±4.8503), 阴性对照组与空白组穿透滤膜的平均细胞数相比较, 无明显差异(P>0.05), 无统计学意义; 实验组与空白组、阴性对照组穿透滤膜的平均细胞数相比较, 均有显著性差异(P<0.05), 有统计学意义(图6).
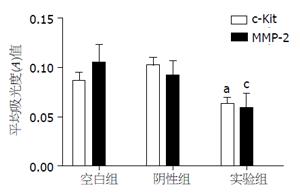
空白组、阴性对照组和实验组分别行c-Kit及MMP-2抗体染色, 实验组与空白组、阴性对照组相比较, 其染色度明显下降; 通过免疫组织化学吸光度分析软件ipwin32分析示, 在c-Kit及MMP-2抗体染色中阴性对照组与空白组相比较, 其吸光度无明显差异(P>0.05), 无统计学意义; 实验组与空白组、阴性对照组相比, 吸光度(A)值均有显著下降, 有显著性差异(P<0.05), 有统计学意义(图7, 8).
GIST是人类常见的肉瘤, 他们大多发生在胃、小肠和结肠, 食管、直肠及其他位置较为少见[1,2],其临床表现不典型, 生长缓慢和隐匿[3]. 原癌基因c-kit参与细胞生存、增生、黏附、分化和凋亡等. 间质瘤中c-kit原癌基因突变可导致Kit酪氨酸激酶在没有配体时持续活化, 细胞增殖分化失控. 因此, 抑制Kit酪氨酸激酶成为治疗和控制GIST的药物研究靶标[4]. 临床诊断时, 25%-30%已有明显的恶性表现, 转移或侵入邻近器官, 失去手术根除的时机. 仅有大约70%GIST手术可完全切除. 甲磺酸伊马替尼等一些靶向治疗药可以有效地阻止Kit受体的持续激活, 抑制肿瘤的生长, 对GIST转移和复发均有显著疗效[5,6]. 因此, 胃肠道间质瘤的非手术治疗的研究非常具有临床意义. 因长期服用甲磺酸伊马替尼等一些靶向治疗药, 有一部分在临床出现耐药现象, 对出现耐药的患者进行基因分析发现, 耐药患者的kit基因存在二次或多次突变的现象, 从而解释了甲磺酸伊马替尼等一些靶向治疗药在临床上出现耐药的现象. 为了进一步解决对于临床耐药患者的治疗, 我们必须寻找新的靶点, 进行靶向干预治疗.
人类ETS域的转录因子家族包括27种蛋白质, 他们都包含保守的ETS DNA结合结构域和共有一个DNA结合特异性的核心, 都集中在序列GGAA/T周围, 参与调节细胞的增殖分化, 与肿瘤的侵袭和迁移关系十分密切[7,8]. PEA3亚科包括3个转录因子, PEA3(也称为ETV4或者E1AF)、ER81(也称为ETV1)和ERM(也作为ETV5). 这些转录因子可识别结合DNA核心序列区域所占的比例分别为95%、85%和50%[9], 这些转录因子与致癌、肿瘤转移存在密切关系[10], PEA3与多种癌症相关, 包括结肠癌[9,11]、乳腺癌[12]、卵巢癌[13]、前列腺癌[14]和食道癌[15]. 与癌症相关的ER81, 其mRNA和蛋白在癌组织中表达量较正常组织高得多. ETV1与前列腺癌[16], 食管和胃肠道肿瘤[7]密切相关. 大量研究证实, ETV1标靶包括合成神经递质多巴胺所需的基因, 以及在细胞迁移和癌症转移有关的基因[17]. Chi等[17]研究发现, ETV1普遍高表达在胃肠道间质瘤和伊马替尼的敏感和耐药的GIST细胞株中, 促进的生长和增殖. 另外基质金属蛋白酶是一个大家族, 目前MMPs家族已分离鉴别出26个成员, 编号分别为MMP1-26, 主要功能是降解细胞外基质作用, 其过度表达与恶性肿瘤的侵袭和转移存在密切的关系. MMP家族的亚族MMP-2与卵巢癌[18,19]、肺癌[20]和肝癌[21]等肿瘤的浸润、转移和血管生成相关.
我们使用基因干扰技术, 沉默GIST-T1细胞株的ETV1转录因子, 对胃肠道间质瘤的恶性行为进行研究, 我们通过模拟人工基底膜的方法, 对GIST-T1细胞进行体外侵袭力实验发现, 实验组较空白及阴性对照组, 其体外细胞穿过滤膜的细胞数明显减少, 说明ETV1转录因子在胃肠道间质瘤侵袭与转移中发挥重要作用, 抑制ETV1转录因子的表达, 对胃肠道间质瘤的侵袭与转移存在明显的抑制作用. 那么, ETV1转录因子通过什么途径调节胃肠道间质瘤侵袭与转移作用? 我们查阅大量文献发现, 金属蛋白酶(matrix metalloproteinase, MMP)与很多肿瘤的侵袭与转移存在密切的关系, 同时c-kit基因的突变也导致其GIST的侵袭行为发生. 由此, 我们选取了已经证实的MMP-2蛋白, 他在许多肿瘤的侵袭与转移扮演着重要的角色. 我们对沉默etv1基因的GIST-T1细胞进行免疫组织化学染色. 结果发现, 沉默etv1基因的实验组较空白及阴性对照组, 染色度明显变浅, 说明沉默etv1基因的GIST-T1细胞体外c-Kit及MMP-2蛋白表达明显降低. 由此, 我们推断, 通过干扰etv1基因, 抑制胃肠道间质瘤体内c-kit及mmp-2基因的表达, 最终抑制其肿瘤的侵袭与转移, 但是etv1基因通过何种信号途径去影响c-kit与mmp-2基因, 还有待进一步研究.
胃肠道间质瘤(GIST)是胃肠道最常见的间叶组织肿瘤, 主要由kit或pdgfra基因突变(kit或pdgfra是酪氨酸激酶受体)导致的酪氨酸激酶持续活化引起.
王文跃, 主任医师, 中日友好医院普通外科
目前临床针对突变的kit或pdgfra基因为干扰靶点研发的抗肿瘤药物有伊马替尼等, 但是由于突变的kit或pdgfra基因存在多位点和二次突变的现象, 从而导致抗肿瘤药物的耐药, 这就需要我们寻找新的GIST干预靶点, 从而改善GIST的治疗和预后.
Chi等研究发现, ETV1在胃肠道间质瘤和伊马替尼的敏感和耐药的GIST细胞株中普遍高表达, 促进其生长和增殖.
通过干扰etv1基因, 能够抑制胃肠道间质瘤体内c-kit及mmp-2基因的表达, 最终抑制其肿瘤的侵袭与转移, 但是etv1基因通过何种信号途径影响c-kit与mmp-2基因, 还有待进一步研究.
本文选题新颖独特、设计缜密、逻辑性强、记录数据真实可靠, 为今后该领域的研究和发展提供了珍贵的循证医学证据.
编辑: 田滢 电编:闫晋利
| 1. | Miettinen M, Monihan JM, Sarlomo-Rikala M, Kovatich AJ, Carr NJ, Emory TS, Sobin LH. Gastrointestinal stromal tumors/smooth muscle tumors (GISTs) primary in the omentum and mesentery: clinicopathologic and immunohistochemical study of 26 cases. Am J Surg Pathol. 1999;23:1109-1118. [PubMed] [DOI] |
| 2. | Reith JD, Goldblum JR, Lyles RH, Weiss SW. Extragastrointestinal (soft tissue) stromal tumors: an analysis of 48 cases with emphasis on histologic predictors of outcome. Mod Pathol. 2000;13:577-585. [PubMed] [DOI] |
| 3. | 贺 慧颖, 方 伟岗, 钟 镐镐, 李 燕, 郑 杰, 杜 娟, 衡 万杰, 吴 秉铨. 165例胃肠道间质瘤中c-kit和PDGFRA基因突变的检测和临床诊断意义. 中华病理学杂志. 2006;35:262-266. |
| 4. | 林 苏, 刘 懿. 胃肠道间质瘤. 国外医学: 消化系疾病分册. 2005;25:25-28. |
| 5. | Li Y, Jiang Z, Xu L, Yao H, Guo J, Ding X. Stability analysis of liver cancer-related microRNAs. Acta Biochim Biophys Sin (Shanghai). 2011;43:69-78. [PubMed] [DOI] |
| 6. | Xu J, Wu C, Che X, Wang L, Yu D, Zhang T, Huang L, Li H, Tan W, Wang C. Circulating microRNAs, miR-21, miR-122, and miR-223, in patients with hepatocellular carcinoma or chronic hepatitis. Mol Carcinog. 2011;50:136-142. [PubMed] [DOI] |
| 7. | Keld R, Guo B, Downey P, Gulmann C, Ang YS, Sharrocks AD. The ERK MAP kinase-PEA3/ETV4-MMP-1 axis is operative in oesophageal adenocarcinoma. Mol Cancer. 2010;9:313. [PubMed] [DOI] |
| 8. | Keld R, Guo B, Downey P, Cummins R, Gulmann C, Ang YS, Sharrocks AD. PEA3/ETV4-related transcription factors coupled with active ERK signalling are associated with poor prognosis in gastric adenocarcinoma. Br J Cancer. 2011;105:124-130. [PubMed] [DOI] |
| 9. | de Launoit Y, Baert JL, Chotteau-Lelievre A, Monte D, Coutte L, Mauen S, Firlej V, Degerny C, Verreman K. The Ets transcription factors of the PEA3 group: transcriptional regulators in metastasis. Biochim Biophys Acta. 2006;1766:79-87. [PubMed] |
| 10. | Oikawa T. ETS transcription factors: possible targets for cancer therapy. Cancer Sci. 2004;95:626-633. [PubMed] [DOI] |
| 11. | de Launoit Y, Chotteau-Lelievre A, Beaudoin C, Coutte L, Netzer S, Brenner C, Huvent I, Baert JL. The PEA3 group of ETS-related transcription factors. Role in breast cancer metastasis. Adv Exp Med Biol. 2000;480:107-116. [PubMed] [DOI] |
| 12. | Horiuchi S, Yamamoto H, Min Y, Adachi Y, Itoh F, Imai K. Association of ets-related transcriptional factor E1AF expression with tumour progression and overexpression of MMP-1 and matrilysin in human colorectal cancer. J Pathol. 2003;200:568-576. [PubMed] [DOI] |
| 13. | Cowden Dahl KD, Zeineldin R, Hudson LG. PEA3 is necessary for optimal epidermal growth factor receptor-stimulated matrix metalloproteinase expression and invasion of ovarian tumor cells. Mol Cancer Res. 2007;5:413-421. [PubMed] [DOI] |
| 14. | Tomlins SA, Laxman B, Dhanasekaran SM, Helgeson BE, Cao X, Morris DS, Menon A, Jing X, Cao Q, Han B. Distinct classes of chromosomal rearrangements create oncogenic ETS gene fusions in prostate cancer. Nature. 2007;448:595-599. [PubMed] [DOI] |
| 15. | Cai C, Hsieh CL, Omwancha J, Zheng Z, Chen SY, Baert JL, Shemshedini L. ETV1 is a novel androgen receptor-regulated gene that mediates prostate cancer cell invasion. Mol Endocrinol. 2007;21:1835-1846. [PubMed] [DOI] |
| 16. | Dissanayake K, Toth R, Blakey J, Olsson O, Campbell DG, Prescott AR, MacKintosh C. ERK/p90(RSK)/14-3-3 signalling has an impact on expression of PEA3 Ets transcription factors via the transcriptional repressor capicúa. Biochem J. 2011;433:515-525. [PubMed] [DOI] |