修回日期: 2011-11-20
接受日期: 2012-01-19
在线出版日期: 2012-01-28
目的: 分析结直肠癌(colorectal cancer, CRC)与正常黏膜间的蛋白质表达差异, 筛选新的肿瘤标志物; 并对兴趣蛋白进行验证, 分析其与CRC的发生、发展及淋巴结转移的关系.
方法: 对6对新鲜的CRC与正常黏膜组织进行以二维差异凝胶电泳(2D differential gel electrophoresis, 2D DIGE)及基质辅助激光解吸飞行时间质谱(matrix-assisted laser desorption/ionization-time of flight mass spectrometry, MALDI-TOF-MS)分析. 以免疫组织化学法验证兴趣蛋白泛醌细胞色素c还原酶核心蛋白1(ubiquinol cytochrome-c reductase core protein 1, UQCRC1)在78例CRC与正常黏膜组织, 和24个转移淋巴结中的表达. 对染色的强弱评分为阴性: 0, 弱阳性: 1, 中阳性: 2, 强阳性: 3.
结果: 2D DIGE分析显示在CRC中一个蛋白点丰度平均显著增高2.14倍(P<0.001). MALDI-TOF-MS分析证实该蛋白为UQCRC1. 免疫组织化学法分析显示UQCRC1在CRC与正常黏膜组织中表达分别为2.28±0.95和1.81±0.88, 有显著差异(P<0.001). UQCRC1表达的强弱与分化、分期及部位均无关(P>0.05). UQCRC1在转移淋巴结与配对的原发灶中表达分别为2.79±0.51和2.33±0.96, 有显著差异(P<0.05).
结论: UQCRC1在结直肠癌变和淋巴结转移过程中发挥一定的作用.
引文著录: 王宁, 陈洋, 姜奕. UQCRC1在结直肠癌及转移淋巴结中的表达. 世界华人消化杂志 2012; 20(3): 259-263
Revised: November 20, 2011
Accepted: January 19, 2012
Published online: January 28, 2012
AIM: To screen new biomarkers for colorectal cancer (CRC) by identifying differentially expressed proteins between CRC and matched normal mucosa using proteomic technology and to analyze the association of identified biomarkers with colorectal carcinogenesis, development and lymph node metastasis.
METHODS: Six pairs of fresh samples of CRC and matched normal mucosa were analyzed by two-dimensional differential gel electrophoresis (2D-DIGE) followed by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF-MS). The expression of the identified differential protein ubiquinol-cytochrome c reductase core protein 1 (UQCRC1) was validated in 78 cases of CRC, matched normal mucosa and lymph node metastases. The immunostaining intensity of UQCRC1 was scored. Wilcoxon signed rank test and Krukal-Wallis test were used for statistical analysis.
RESULTS: 2D-DIGE analysis showed that the intensity of a protein spot was significantly increased by 2.14 folds (P < 0.001) in CRC. This spot was confirmed to be UQCRC1 by MALDI-TOF-MS. Immunohistochemistry analysis revealed that the immunostaining intensity of UQCRC1 was significantly higher in CRC than in matched normal mucosa (2.28 ± 0.95 vs 1.81 ± 0.88, P < 0.001). However, the expression of UQCRC1 had no correlation with differentiation, TNM stage or tumor location (all P > 0.05). The intensity of UQCRC1 was significantly lower in primary CRC than in lymph node metastases (P < 0.05).
CONCLUSION: UQCRC1 may play an important role in colorectal carcinogenesis and lymph node metastases.
- Citation: Wang N, Chen Y, Jiang Y. Expression of UQCRC1 in primary colorectal cancer and lymph node metastases. Shijie Huaren Xiaohua Zazhi 2012; 20(3): 259-263
- URL: https://www.wjgnet.com/1009-3079/full/v20/i3/259.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i3.259
为筛选新的CRC肿瘤标志物, 我们对6对新鲜的结直肠癌(colorectal cancer, CRC)组织与正常黏膜组织进行以二维差异凝胶电泳(2D differential gel electrophoresis, 2D DIGE)及基质辅助激光解吸飞行时间质谱(matrix-assisted laser desorption/ionization-time of flight mass spectrometry, MALDI-TOF-MS)质谱分析. 分析结果显示UQCRC1在CRC中显著增高, 这一现象引起了我们极大的兴趣. UQCRC1是一种核编码的线粒体蛋白, 是线粒体呼吸链内复合体Ⅲ的亚基. 有报道UQCRC1在乳腺癌和卵巢癌中表达增高[1]. 为进一步验证和研究其在结直肠癌中的表达情况, 我们进行如下研究.
收集我院普通外科2008-03/2011-05术前未经放疗化疗的CRC患者组织标本78例. 患者平均年龄(61.2±12.6)岁, 其中男40例、女38例, 术后病理证实均为腺癌. 高分化18例, 中分化40例, 低分化20例; TNM分期Ⅰ期4例, Ⅱ期39例, Ⅲ期31例, Ⅳ期4例. 配对的正常黏膜70个取自距肿瘤10 cm以上肉眼观察正常的组织. 以上组织行甲醛溶液固定, 石蜡包埋, 连续切片. 其中1张切片行苏木精-伊红染色供病理诊断, 其余切片供免疫组化研究. 6对新鲜标本从上述病例中随机抽取, 手术切除后立即-80 ℃保存备用. 2D DIGE用蛋白提纯、定量试剂盒, Cy2、Cy3、Cy5荧光染料, IPG胶条(pH3-10 NL 24 cm)及电泳仪(Ettan IPGphor Ⅲ apparatus), 荧光扫描仪(Typhoon TRIO), 分析软件(DeCyder 6.5), 自动挖点机器人(Ettan-Picker robot)等均购自GE Healthcare公司. MALDI-TOF质谱仪(Autoflex)及分析软件(MS BioTools program)均购自Bruker Daltonics公司. 质谱结果搜索用Matrix Science 的Mascot 软件搜索Swiss-Prot数据库. UQCRC1鼠抗人多克隆抗体购自Abcam公司. 三步法免疫组化试剂盒购自福州迈新公司.
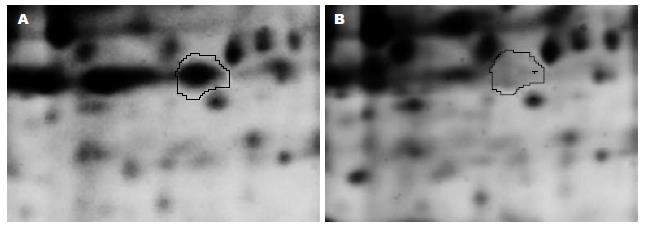
1.2.1 2D DIGE: 取约50 mg新鲜组织超声破碎、裂解后进行蛋白提纯、定量. 取50 μg CRC、正常黏膜组织蛋白, 分别以Cy3、Cy5避光, 冰上标记30 min. 全部6对CRC、正常黏膜组织蛋白, 每个样品取25 μg, 以Cy2标记做内标. 配对的50 μg CRC、正常黏膜组织蛋白和内标于一个胶条内电泳. 6个胶条之一做Master胶, 另加入600 μg不标记的内标蛋白以备后染色和挖点. Ettan IPGphor Ⅲ apparatus电泳仪等电聚焦电泳, 再进行SDS聚丙烯酰胺凝胶电泳. 最后TyphoonTM多功能扫描仪进行图像扫描, DeCyder 6.5软件分析蛋白点丰度差异[2,3].
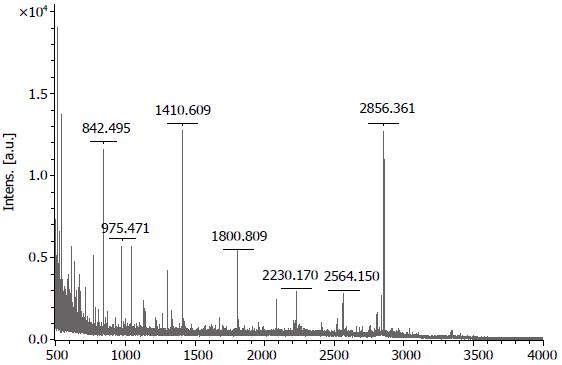
1.2.2 MALDI-TOF质谱分析: 比对2D DIGE结果, 有显著差异的蛋白点以机器人从Master胶挖出, 胰蛋白酶消化、还原, 再烷基化, 最后置于基质上, 以阳离子反射模式进行MALDI-TOF质谱分析. Matrix Science的Mascot软件搜索Swiss-Prot 数据库鉴定蛋白[2,3].
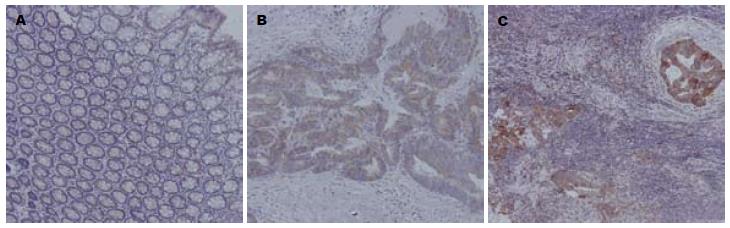
1.2.3 免疫组织化学: 石蜡切片以二甲苯脱蜡、梯度乙醇水化. 3%H2O2溶液去除内源性过氧化酶, 高温高压修复. 羊非免疫血清室温封闭1 h, 滴加一抗1:100, 4 ℃孵育过夜. 滴加生物素标记的羊抗鼠IgG, 室温20 min. 滴加链霉菌抗生物素蛋白-过氧化物酶, 室温20 min. 对氨基联苯胺(DAB)显色, 苏木素复染. 光学显微镜下观察, 依信号的强弱分为无着色-, +<10%细胞着色, ++10-50%, +++>50%, 分别评分为0-3分[1].
统计学处理 均数以mean±SD表示. 2D DIGE分析软件以t检验和ANOVA进行统计学分析. 免疫组化结果以秩和检验进行统计学分析, 对有配对标本者一律进行配对检验. 以P<0.05为有统计学差异.
2D DIGE分析显示, CRC组织中有30多个蛋白点平均丰度大于正常黏膜1.5倍以上(P<0.05), 且经MALDI-TOF质谱分析Swiss-Prot数据库搜索后, 评分在64分以上. 2D DIGE分析显示在CRC中有一个蛋白点(图1)丰度平均显著增高2.14倍(P<0.001), 后经MALDI-TOF-MS分析证实该蛋白为UQCRC1, 搜索评分102(图2). 显著增高的蛋白还有14-3-3 Zeta,丙酮酸激酶同工酶(Pyruvate kinase isozymes M1/M2), 锰过氧化物歧化酶(Manganese superoxidase dismutase), 结合蛋白(Desmin), 膜联蛋白(Annexin)A1、A3, 热休克蛋白27(HSP27), 角蛋白1、10(Cytokeratin), 血清淀粉酶样P成分(serum amyloid p component)等. 因UQCRC1引起了我们的极大兴趣, 所以我们以免疫组化法, 对其在CRC中的表达进行了进一步的验证和分析.
免疫组织化学信号着色主要位于胞浆, 大多数癌细胞及正常腺细胞均有着色. UQCRC1在CRC与正常黏膜组织中表达评分分别为2.28±0.95和1.81±0.88, 有显著差异(P<0.001, 图3). 70例配对的CRC与正常黏膜组织中癌细胞着色强度高于正常腺细胞者占51.43%(36/70), 相近者占37.14%(26/70). UQCRC1在高、中、低分化的CRC中表达分别为2.17±0.99, 2.40±0.87, 2.15±1.09, 无显著差异(P>0.05). Ⅰ/Ⅱ期和Ⅲ/Ⅳ期CRC中表达分别为2.42±0.82和2.11±1.08, 无显著差异(P>0.05). 结肠癌和直肠癌中表达分别为2.24±0.98和2.33±0.92, 无显著差异(P>0.05). 腺癌、黏液腺癌中表达分别为2.40±0.89和1.80±1.08, 有显著差异(P<0.05). UQCRC1在配对的转移淋巴结中表达(2.79±0.51)显著高于原发癌(2.33±0.96), P<0.05(图3). 其中37.5%(9/24)的转移淋巴结中表达评分高于原发癌, 58.33%(14/24)表达评分相同.
CRC在全球范围内的发病率在恶性肿瘤中排第4位, 每年约有100万以上新发病例, 50万以上死于CRC. 医学工作者们尽管在早期诊断, 早期治疗方面取得了很大进步, 但仍有许多患者死于CRC的发展与转移. 究其原因主要在于对其分子生物学机制不甚清楚. 开发新的肿瘤标志物对将有利于开展对CRC的个体化诊断, 和开发个体化治疗的新靶点[4].
蛋白质组学研究以二维电泳、质谱分析加数据库搜索为手段, 近年来已被广泛用于新肿瘤标志物的筛选[5-11]. 尤其是荧光标记的2D DIGE, 由于引入了内标显著减少了胶间差异和工作量, 明显提高了检测差异蛋白的灵敏度、准确率和可重复性[2,3,7-9].
UQCRC1是一种核编码的线粒体蛋白, 他位于线粒体内膜, 是线粒体呼吸链内复合体Ⅲ的亚基. 关于UQCRC1在恶性肿瘤中的表达, Kulawiec等[1]首先报道了其在乳腺和卵巢癌中高表达, 之后Liu等[5]又报道了其在骨肉瘤中高表达, 并认为其参与恶性肿瘤的发生. Feng等[11]在肝癌细胞株SMMC-7721也检测到UQCRC1的高表达. 但据我们所知, 关于UQCRC1在CRC中的表达情况国内外尚未见报道.
本研究中2D DIGE分析显示, 6对组织标本中5对癌组织中UQCRC1的含量明显高于正常黏膜, 蛋白丰度平均增加了2.14倍. 我们的免疫组织化学研究显示UQCRC1在癌细胞及正常黏膜上皮细胞均有表达, 但在癌细胞中显著增高, 这也进一步证实了蛋白质组学研究的结果. 众所周知, 癌细胞代谢增高, 线粒体通过氧化磷酸化等而发挥细胞动力工厂的作用, UQCRC1是线粒体呼吸链内重要组成部分, 故在癌细胞中呈高表达. Kulawiec等[1]认为几乎所有肿瘤均存在线粒体基因突变[1,12-15], 而线粒体与细胞核间存在信息交流(cross talking), UQCRC1即是信息交流中重要蛋白之一. UQCRC1是一种核编码, 胞浆内合成, 在分子伴侣的协助下转运进入线粒体的蛋白[1], 所以免疫组化呈胞浆着色.
Kulawiec等[1]免疫组织化学结果显示UQCRC1表达与乳腺癌分级呈正相关(r = 0.18, P = 0.26), 而与卵巢癌分级呈负相关(r = -0.22, P = 0.24). 然而, 本研究未发现UQCRC1在CRC中表达与分化程度有关, 而且与病程早晚、癌所在部位均无关. 有限的15例黏液腺癌UQCRC1表达显著低于腺癌, 对此现象的机制我们尚未找出合理的解释, 也需要扩大样本量来进一步证实. 在转移淋巴结中UQCRC1表达显著高于配对的原发癌, 分析原因, 可能是转移的癌细胞需要维持更高的代谢所致.
虽然UQCRC1在CRC中表达显著高于正常黏膜, 在转移淋巴结中表达显著高于原发灶, 但显著增高的比例仅占51.43%和37.5%. 因此我们推测, UQCRC1参与结直肠上皮癌变及淋巴结转移, 但并不发挥主要作用.
UQCRC1是一种核编码的线粒体蛋白. Kulawiec等首先报道了其在乳腺和卵巢癌中高表达, 之后Liu等又报道了其在骨肉瘤中高表达. 但关于UQCRC1在结直肠癌(CRC)中的表达情况国内外尚未见报道.
郝立强, 副教授, 上海长海医院普外二科
UQCRC1表达是否与CRC有关, 与CRC的分化、分期、转移及预后的关系都有待于进一步研究.
Kulawiec等首先报道了UQCRC1在74%的乳腺和34%的卵巢癌中高表达并与COXⅡ呈正相关. Liu等报道了其在骨肉瘤中高表达, 并认为其参与恶性肿瘤的发生.
本研究不仅证实了UQCRC1在CRC中表达显著高于正常黏膜, 还详细分析了UQCRC1的表达与结直肠癌变, 分化、分期及淋巴结转移间的关系.
UQCRC1可作为一参考的CRC肿瘤标志物及治疗靶点.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Kulawiec M, Arnouk H, Desouki MM, Kazim L, Still I, Singh KK. Proteomic analysis of mitochondria-to-nucleus retrograde response in human cancer. Cancer Biol Ther. 2006;5:967-975. [PubMed] [DOI] |
| 2. | Alfonso P, Núñez A, Madoz-Gurpide J, Lombardia L, Sánchez L, Casal JI. Proteomic expression analysis of colorectal cancer by two-dimensional differential gel electrophoresis. Proteomics. 2005;5:2602-2611. [PubMed] [DOI] |
| 3. | Friedman DB, Hill S, Keller JW, Merchant NB, Levy SE, Coffey RJ, Caprioli RM. Proteome analysis of human colon cancer by two-dimensional difference gel electrophoresis and mass spectrometry. Proteomics. 2004;4:793-811. [PubMed] [DOI] |
| 4. | Li T, Yang W, Li M, Byun DS, Tong C, Nasser S, Zhuang M, Arango D, Mariadason JM, Augenlicht LH. Expression of selenium-binding protein 1 characterizes intestinal cell maturation and predicts survival for patients with colorectal cancer. Mol Nutr Food Res. 2008;52:1289-1299. [PubMed] [DOI] |
| 5. | Liu X, Zeng B, Ma J, Wan C. Comparative proteomic analysis of osteosarcoma cell and human primary cultured osteoblastic cell. Cancer Invest. 2009;27:345-352. [PubMed] [DOI] |
| 6. | Foster CR, Robson JL, Simon WJ, Twigg J, Cruikshank D, Wilson RG, Hutchison CJ. The role of Lamin A in cytoskeleton organization in colorectal cancer cells: a proteomic investigation. Nucleus. 2011;2:434-443. [PubMed] [DOI] |
| 7. | Meleady P. 2D gel electrophoresis and mass spectrometry identification and analysis of proteins. Methods Mol Biol. 2011;784:123-137. [PubMed] [DOI] |
| 9. | 沙 慧芳, 孙 强玲, 杨 晓华, 储 天晴, 谢 银银, 鲁 静, 包 国良, 冯 久贤, 龚 乐罗. 应用差异凝胶电泳及质谱技术筛选肺癌患者血浆差异蛋白. 上海交通大学学报(医学版). 2010;30:399-403. |
| 11. | Feng Y, Tian ZM, Wan MX, Zheng ZB. Protein profile of human hepatocarcinoma cell line SMMC-7721: identification and functional analysis. World J Gastroenterol. 2007;13:2608-2614. [PubMed] |
| 12. | Radpour R, Fan AX, Kohler C, Holzgreve W, Zhong XY. Current understanding of mitochondrial DNA in breast cancer. Breast J. 2009;15:505-509. [PubMed] [DOI] |
| 13. | Gogvadze V, Orrenius S, Zhivotovsky B. Mitochondria in cancer cells: what is so special about them? Trends Cell Biol. 2008;18:165-173. [PubMed] [DOI] |