修回日期: 2012-09-19
接受日期: 2012-10-08
在线出版日期: 2012-10-18
目的: 观察甘草酸苷(Glycyrrhizin, GL)对乙型肝炎疫苗无应答者外周血单个核细胞(peripheral blood mononuclear cell, PBMC)细胞因子mRNA表达的影响, 探讨GL增强机体免疫功能的作用机制.
方法: 分离乙型肝炎疫苗无应答者的PBMC, 加入HBsAg和/或GL的条件下体外培养, CCK-8法测定PBMC的增殖能力, real-time PCR测定刺激后IFN-γ、IL-4、IL-10 mRNA的表达水平, 并与应答组比较.
结果: GL可刺激提高乙型肝炎疫苗无应答者PBMC的增殖能力, 使之与应答者无显著性差异(F = 3.104, P = 0.138). HBsAg+GL+无应答组PBMC的IFN-γ、IL-10 mRNA表达水平均高于HBsAg+无应答组, 差异有统计学意义(q分别为34.93和26.18, 均P<0.05), 趋向于应答者分泌水平, GL+无应答组IFN-γ与IL-10的表达均高于HBsAg+无应答组(q分别为10.18和9.19, 均P<0.05), 但低于HBsAg+GL+无应答组(q分别为24.75和16.98, 均P<0.05); 而IL-4 mRNA变化在无应答者3组间无统计学意义(P = 0.304).
结论: GL可以调节乙型肝炎疫苗无应答者的免疫状态, 创造有利于保护性抗体产生的环境.
引文著录: 李旭华, 陈月, 吴文苑, 陈玲玲, 费筠. 甘草酸苷对乙型肝炎疫苗无应答者PBMC细胞因子mRNA表达的影响. 世界华人消化杂志 2012; 20(29): 2827-2831
Revised: September 19, 2012
Accepted: October 8, 2012
Published online: October 18, 2012
AIM: To investigate the effect of glycyrrhizin (GL) on the mRNA expression of cytokines in peripheral blood mononuclear cells (PBMCs) from non-responders to hepatitis B vaccine and to explore the mechanism by which GL regulates immune function.
METHODS: PBMCs were isolated from non-responders to hepatitis B vaccine and incubated with GL and (or) HBsAg. The abilities of GL and (or) HBsAg to stimulate the proliferation of PBMCs were evaluated by CCK-8 assay. The mRNA expression levels of IFN-γ, IL-4, and IL-10 were determined by real-time PCR.
RESULTS: GL enhanced the proliferation of PBMCs from non-responders to hepatitis B vaccine and made it comparable to that of PBMCs from responders (F = 3.104, P = 0.138). The mRNA expression levels of IFN-γ and IL-10 in PBMCs from non-responders that were incubated with HBsAg and GL were significantly higher than those incubated with HBsAg alone (q = 34.93, 26.18, both P < 0.05), and tend to reach the levels in PBMCs from responders. The mRNA expression levels of IFN-γ and IL-10 in PBMCs from non-responders that were incubated with GL were higher than those incubated with HBsAg (q = 10.18, 9.19, both P < 0.05), but lower than those incubated with HBsAg and GL (q = 24.75, 16.98, both P < 0.05). The mRNA expression levels of IL-4 had no obvious difference among the three groups (P = 0.304).
CONCLUSION: GL can regulate the immune status of non-responders to hepatitis B vaccine and create an environment conducive to the generation of protective antibodies.
- Citation: Li XH, Chen Y, Wu WY, Chen LL, Fei Y. Effect of glycyrrhizin on mRNA expression of cytokines in PBMCs from non-responders to hepatitis B vaccine. Shijie Huaren Xiaohua Zazhi 2012; 20(29): 2827-2831
- URL: https://www.wjgnet.com/1009-3079/full/v20/i29/2827.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i29.2827
乙型肝炎病毒(hepatitis B virus, HBV)感染是当今世界一个严重的公共卫生问题. 正常人接种乙型肝炎疫苗后仍有5%-10%的抗体滴度不能达到保护性阈值, 从而成为HBV的易感者, 甚至成为慢性携带者[1]. 研究发现, 抗原特异性T细胞增殖能力低下和Th1/Th2类细胞因子的失衡状态是导致机体发生无/弱应答的重要因素[2]. 甘草酸苷(glycyrrhizin, GL)为甘草的主要成分, 是一种良好的免疫调节剂. 本研究通过体外检测GL和HBsAg联合刺激对乙型肝炎疫苗无应答者PBMC细胞因子(IFN-γ、IL-4和IL-10)mRNA表达水平, 以及淋巴细胞特异性增殖反应的影响, 探讨GL对乙型肝炎疫苗无应答者免疫功能的调节作用.
选择我院体检的乙型肝炎疫苗无应答者50例为无应答组, 年龄18-45岁, 其中男27例, 女23例, 均为常规0、1、6三针接种乙型肝炎基因工程疫苗, 于第三针接种后1 mo检测乙型肝炎两对半结果全阴而后加强一针后1 mo检测仍为5项全阴者. 应答组50例为接种乙型肝炎疫苗后HBsAb检测阳性(>100 mIU/mL)的健康人群. 各组均于接种最后一针疫苗1 mo后采血. 全部研究对象均排除HAV、HCV和HBV-DNA(+)隐性感染及心脑肾和其他器官疾病. 荧光定量PCR仪购自美国ABI公司; 台式离心机、紫外分光光度计购自Eppendorf公司; 电泳仪购自瑞士AMERSHAM公司; 凝胶成像系统、酶标仪购自美国Bio-Rad公司; RNA提取试剂TRIzol购自Invitrogen公司; RT-PCR和SYBR Green real-time PCR试剂盒购自Takara公司; 淋巴细胞分离液购自北京鼎国生物公司; Cell Counting Kit-8(CCK-8试剂盒)购自日本同仁化学研究所; 甘草酸苷购自日本米诺发源制药株式会社; HBV表面抗原购自大连高新生物制药有限公司; 引物设计使用Primer 5.0, 由Takara公司合成见表1.
| 引物名称 | 序列(5'-3') | 产物(bp) |
| GAPDH | F: GCACCGTCAAGGCTGAGAAC | 138 |
| R: TGGTGAAGACGCCAGTGGA | ||
| IFN-γ | F: CTTTAAAGATGACCAGAGCATCCAA | 189 |
| R: GGCGACAGTTCAGCCATCAC | ||
| IL-4 | F: AGCAGCTGATCCGATTCCTGA | 100 |
| R: TCCAACGTACTCTGGTTGGCTTC | ||
| IL-10 | F: GAGATGCCTTCAGCAGAGTGAAGA | 198 |
| R: AGTTCACATGCGCCTTGATGTC |
1.2.1 外周血单个核细胞的获取: 取研究对象的外周血单个核细胞(peripheral blood mononuclear cell, PBMC), 肝素抗凝后, 与等量的RPMI 1640液混匀, Ficoll密度梯度离心法分离PBMC; 台盼蓝染色, 证实活细胞达95%以上; 用PBS洗去血小板, 然后再用含10%人AB血清的RPMI 1640液悬浮PBMC.
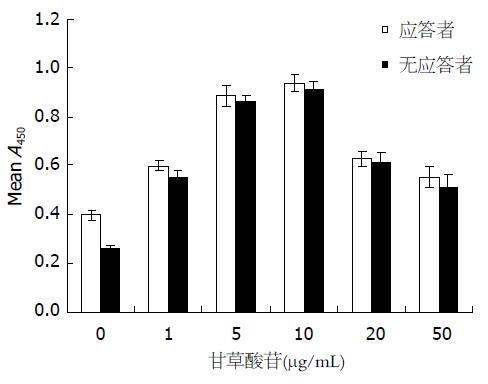
1.2.2 甘草酸苷对乙型肝炎疫苗无应答者外周血单个核细胞的免疫刺激作用: 取乙型肝炎疫苗应答组和无应答组PBMC悬液分别按1×106/mL浓度加入96孔板, 100 μL/孔, 所有孔均给予5 μg/mL终浓度的HBsAg刺激, 然后再于各孔中分别加入终浓度为1、5、10、20和50 μg/mL的GL, 每个GL浓度设3个复孔, 并设不加GL的对照孔和空白对照孔. 于37 ℃、50 mL/L CO2培养箱内培养48 h, 每孔加入CCK-8溶液10 μL, 继续培养4 h后, 测A450值, 结果以3孔均值表示.
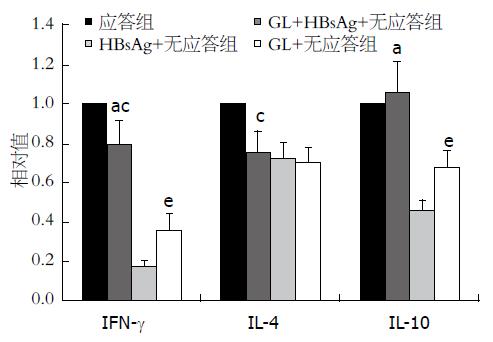
1.2.3 real-time PCR分析细胞因子的表达: 实验分组: (1)应答组: 乙型肝炎疫苗应答者PBMC+HBsAg; (2)GL+HBsAg+无应答组: 乙型肝炎疫苗无应答者PBMC+HBsAg+GL; (3)HBsAg+无应答组: 乙型肝炎疫苗无应答者PBMC+HBsAg; (4)GL+无应答组: 乙型肝炎疫苗无应答者PBMC+GL. 应答组给予终浓度10 μg/mL的GL刺激, 其余3组均给予5 μg/mL终浓度的HBsAg刺激, GL+HBsAg+无应答组同时给予终浓度10 μg/mL的GL刺激, 于37 ℃、50 mL/L CO2培养箱内培养48 h后收集细胞至1.5 mL的EP管中. 每管分别加入1 mL TRIzol, 氯仿/异丙醇法提取总RNA, 紫外分光光度计测定提取的RNA浓度和纯度, 1%琼脂糖凝胶电泳检测RNA完整性. RT-PCR逆转录试剂盒进行逆转录, 并对逆转录的cDNA在ABI7500实时荧光定量基因扩增仪上进行实时荧光定量PCR反应. 反应总体系25 μL. Real-time PCR扩增条件为95 ℃ 30 s预变性, 95 ℃变性5 s, 60 ℃退火和延伸34 s, 40个循环. 每个样品3个重复, 同时设无模板对照. 将IFN-γ、IL-4及IL-10的mRNA与GAPDH的(Ct值)换算为基因的相对表达量2-△△Ct, 将应答组归一化处理, 比较各组间的表达差异.
1.2.4 标准曲线的制备: 取1 μL cDNA加入9 μL去离子水中, 按1∶10倍比稀释得到不同浓度的模板. 将起始拷贝数分别设定为104、103、102、10. 进行Real-time PCR反应. 以起始拷贝数的对数为横坐标, 以循环阈值(Ct)为纵坐标, 分别绘制IFN-γ、IL-4、IL-10及GAPDH的标准曲线, 标准曲线E值为95%-105%, r2>0.95为符合模板要求.
统计学处理 全部数据采用SPSS18.0软件进行统计, 计量资料以mean±SD表示, 多组间统计分析采用F分析, 两两比较采用q检验. P<0.05认为差异有统计学意义.
本研究结果显示, 各浓度的GL均能刺激提高乙型肝炎疫苗无应答者PBMC增殖, 与应答者比较差异无显著性(F = 3.104, P = 0.138), 而且在1-10 μg/mL范围内, 促进增殖的作用逐渐增强, 但随着浓度再增加, 其促进增殖的作用反而减弱. 仅用HBsAg刺激时乙型肝炎疫苗应答者PBMC增殖能力强于无应答者(P<0.05, 图1).
GAPDH、IFN-γ、IL-4及IL-10熔解曲线分别为85.0 ℃、81.7 ℃、84.0 ℃和84.5 ℃, 熔解曲线较锐利, 峰单一, 显示引物的特异性较好. 扩增效率分别102.9%, 100.7%, 102.7%, 99.6%, 都在95%-105%之间, 说明反应属于特异性扩增.
应用Real-time PCR检测结果如图2所示, HBsAg+GL+无应答组PBMC的IFN-γ、IL-4 mRNA表达水平低于应答组(P<0.05), IL-10 mRNA表达无明显差异(P>0.05); GL+无应答组IFN-γ与IL-10的表达均高于HBsAg+无应答组(q分别为10.18和9.19, 均P<0.05)但低于HBsAg+GL+无应答组(q分别为24.75和16.98, 均P<0.05); 但与HBsAg+无应答组比较, HBsAg+GL+无应答组PBMC的IFN-γ、IL-10 mRNA表达水平明显提高(q分别为34.93和26.18, 均P<0.05), 而IL-4 mRNA变化在无应答者的3组间无统计学意义(P>0.05).
GL是一种有效的免疫调节剂, 其免疫调节作用表现在对免疫活性细胞、细胞因子、补体等多方面. 近年研究还发现GL并非单纯地影响某一种或几种细胞因子的升高或降低, 而是可以打破机体Th1和Th2类细胞因子的失衡状态, 对于机体免疫功能失调的修正意义重大[3,4]. 有学者尝试利用其免疫调节功能治疗溃疡性结肠炎、斑秃等免疫失衡引起的疾病, 均取得了良好的效果[5,6]. 现已经临床证实GL治疗慢性乙型肝炎具有一定的优势且疗效确定[7,8], 但其与乙型肝炎疫苗的无/弱应答关系方面鲜有报道. 因此, 我们设想GL与乙型肝炎疫苗联合应用是否可打破机体免疫耐受或低下状态, 诱导机体选择性增强和调节免疫系统, 从而有效地提高机体对乙型肝炎疫苗的免疫应答能力.
乙型肝炎疫苗无/弱应答的发生受多种因素的影响. 研究发现无/弱应答者体内PBMC受HBsAg刺激后增殖能力低下, Th1/Th2类细胞因子分泌水平变化而导致的机体免疫状态失衡是保护性抗体不能产生的重要因素[2]. 其机制是Th细胞数量上的减少可能导致相关细胞因子下降, 进而影响B细胞活化、增殖、分化为浆细胞, 使其合成和分泌的抗体减少, 最终影响乙型肝炎疫苗的免疫效果. Chedid等[9]研究认为, 乙型肝炎疫苗无/弱应答者体内特异性识别HBsAg表位TCR的T淋巴细胞在胸腺分化成熟过程中受到了阴性选择从而发生了类似于自身抗原的免疫耐受. 如果增强PBMC这一类混合免疫细胞的增殖, 可打破这一漏洞, 进而有望实现HBsAg特异性T淋巴细胞的频数与抗-HBs应答水平的正相关性.我们研究结果显示, 与HBsAg单独刺激导致无应答者PBMC增殖明显低于应答者相比, GL+HBsAg联合刺激在体外能明显促进提高乙型肝炎疫苗无应答者PBMC的增殖(P<0.05), 与应答者比较无显著性差异, 且在1-10 μg/mL范围内, 促增殖作用逐渐增强.
IFN-γ是典型的Th1类细胞因子, 同时对IL-2具有促进作用[10], 而IL-2被称为T细胞分化因子, 促进T、B淋巴细胞的增殖, 其缺乏意味着机体对抗原特异性的无能, 即不能正确识别特异性抗原. IL-10最初被认为是一种Th2类细胞因子, 具有抑制单核巨噬细胞抗原提呈, 减少MHC-Ⅱ类分子和共刺激分子表达, 诱导产生免疫耐受的作用[11]. 然而新近研究发现[12], Th1类细胞在IL-12的辅助下亦可分泌IL-10, 阻止B细胞凋亡, 促进其增殖、分化及MHC-Ⅱ类分子表达[13], 并在免疫球蛋白类别转换中起促进作用, 还可以抑制IL-4产生, 说明IL-10的增加在维持Th1/Th2类细胞因子平衡中发挥了重要的作用, 提高机体的体液免疫水平. 现已证明, GL可以促进巨噬细胞产生IL-12[14]. 在本研究中, 通过Real-time PCR检测分析显示: GL单独刺激无应答者PBMC亦可比HBsAg单独刺激无应答者PBMC时IFN-γ、IL-10 mRNA表达水平有所提高, 但与HBsAg+GL+无应答组仍有差距(P<0.05). 与HBsAg+无应答组比较, HBsAg+GL+无应答组的IFN-γ、IL-10 mRNA表达水平明显提高(P<0.05), 尤其是IL-10 mRNA表达水平可达到应答组比较无显著差异(P>0.05), 说明GL可调整乙型肝炎疫苗无应答者的免疫状态, 对于机体产生达到保护作用的抗体具有积极地促进作用. IL-4主要由Th2类细胞产生, 抑制Th1细胞增殖及其应答. 在本研究中IL-4的表达并未有明显变化(P>0.05), 推测与GL对Th1类细胞因子影响作用更大有关.
目前, 尚无十分有效的方法能使对乙型肝炎疫苗无/弱应答者产生足够的免疫力, 这一部分人群仍将成为HBV的易感者. Takahara等[15]报道, GL可阻碍HBsAg颗粒上的唾液酸的补充, 同时清除HBsAg颗粒上的唾液酸, 使其抗原性提高, 机体的原发性免疫增强. 本研究结果提示, GL促进IFN-γ和IL-10的增加不仅使得乙型肝炎疫苗无应答者细胞因子分泌水平有所变化, 亦使得机体的免疫状态重新向Th1方向漂移, 从而有望打破乙型肝炎疫苗无/弱应答者体内的免疫异常状态. 因此, 我们认为GL可能成为一种潜在的有前途的疫苗佐剂用于提高乙型肝炎疫苗接种人群的应答率.
HBV感染是困扰当今世界的一个严重的公共卫生问题. 正常人接种乙型肝炎疫苗后仍有5%-10%的抗体滴度不能达到保护性阈值. 如何增强机体的免疫应答以提高人群对乙型肝炎疫苗的应答率是亟待解决的问题. 抗原特异性T细胞增殖能力低下和Th1/Th2类细胞因子的失衡状态是导致机体发生无/弱应答的重要因素.
谭德明, 教授, 中南大学湘雅医院感染病科
乙型肝炎疫苗的有效应答有赖于机体完善的免疫应答能力, 包括特异性免疫细胞的增殖和相应细胞因子的分泌. 无/弱应答的发生受多种因素的影响, T细胞接触HBsAg后特异性增殖能力低下导致的机体免疫反应不足, 及Th1/Th2类细胞因子比例失衡导致的对乙型肝炎疫苗的免疫耐受状态是其中的重要因素. 因此通过免疫调节打破这一特殊的免疫耐受状态对于提高机体对乙型肝炎疫苗的应答能力作用关键.
王大南等通过实验发现甘草酸苷(GL)具有增强巨噬细胞的功能; 陆富永等利用GL治疗因细胞因子分泌失衡导致的斑秃. 近年来国外有研究发现通过有效地刺激免疫细胞, 改变其应答低下的状态, 有利于机体免疫平衡的恢复及抗体的产生. 提示GL如果能有效地调节乙型肝炎疫苗无应答人群的免疫失衡状态, 对于提高乙型肝炎疫苗的应答率意义重大.
本实验首次以不同浓度的GL联合HBsAg刺激乙型肝炎疫苗无应答者的PBMC, 通过一系列的指标检测来观察GL对该类人群免疫功能的影响. 为从免疫调节的角度合理应用GL来有效提高乙型肝炎疫苗接种人群的应答率提供科学依据.
从临床应用发展角度, 全面阐述了各种肝脏功能评估指标, 对临床有一定指导意义.
本文创新性较强, 成果对于提高乙型肝炎疫苗接种的应答有一定参考价值.
编辑: 田滢 电编:鲁亚静
| 1. | Coates T, Wilson R, Patrick G, André F, Watson V. Hepatitis B vaccines: assessment of the seroprotective efficacy of two recombinant DNA vaccines. Clin Ther. 2001;23:392-403. [PubMed] [DOI] |
| 2. | Goncalves L, Albarran B, Salmen S, Borges L, Fields H, Montes H, Soyano A, Diaz Y, Berrueta L. The nonresponse to hepatitis B vaccination is associated with impaired lymphocyte activation. Virology. 2004;326:20-28. [PubMed] [DOI] |
| 5. | Kudo T, Okamura S, Zhang Y, Masuo T, Mori M. Topical application of glycyrrhizin preparation ameliorates experimentally induced colitis in rats. World J Gastroenterol. 2011;17:2223-2228. [PubMed] [DOI] |
| 7. | Matsuo K, Takenaka K, Shimomura H, Fujii N, Shinagawa K, Kiura K, Harada M. Lamivudine and glycyrrhizin for treatment of chemotherapy-induced hepatitis B virus (HBV) hepatitis in a chronic HBV carrier with non-Hodgkin lymphoma. Leuk Lymphoma. 2001;41:191-195. [PubMed] [DOI] |
| 9. | Chedid MG, Deulofeut H, Yunis DE, Lara-Marquez ML, Salazar M, Deulofeut R, Awdeh Z, Alper CA, Yunis EJ. Defect in Th1-like cells of nonresponders to hepatitis B vaccine. Hum Immunol. 1997;58:42-51. [PubMed] [DOI] |
| 10. | Sharma SK, Pichichero ME. Functional deficits of pertussis-specific CD4+ T cells in infants compared to adults following DTaP vaccination. Clin Exp Immunol. 2012;169:281-291. [PubMed] [DOI] |
| 11. | Adurthi S, Mukherjee G, Krishnamurthy H, Sudhir K, Bafna UD, Umadevi K, Jayshree RS. Functional tumor infiltrating TH1 and TH2 effectors in large early-stage cervical cancer are suppressed by regulatory T cells. Int J Gynecol Cancer. 2012;22:1130-1137. [PubMed] [DOI] |
| 12. | Kemp KL, Levin SD, Stein PL. Lck regulates IL-10 expression in memory-like Th1 cells. Eur J Immunol. 2010;40:3210-3219. [PubMed] [DOI] |
| 13. | Wang RX, Yu CR, Mahdi RM, Egwuagu CE. Novel IL27p28/IL12p40 cytokine suppressed experimental autoimmune uveitis by inhibiting autoreactive Th1/Th17 cells and promoting expansion of regulatory T cells. J Biol Chem. 2012;287:36012-36021. [PubMed] |
| 14. | Dai JH, Iwatani Y, Ishida T, Terunuma H, Kasai H, Iwakula Y, Fujiwara H, Ito M. Glycyrrhizin enhances interleukin-12 production in peritoneal macrophages. Immunology. 2001;103:235-243. |