修回日期: 2012-08-22
接受日期: 2012-09-20
在线出版日期: 2012-10-08
目的: 探讨MSCT和MRI对胃肠道外间质瘤(extra-gastrointestinal stromal tumors, EGIST)的诊断价值.
方法: 回顾性分析22例经免疫组织化学证实的EGIST的MSCT和MRI表现. 16例患者行CT检查, 6例行MRI检查.
结果: 22例EGIST中, 中度危险5例, 高度危险17例. 肿瘤位于肠系膜6例, 网膜5例, 盆腔5例, 腹腔3例, 腹膜后2例, 腹壁1例. 肿瘤最大直径5.7-19.5 cm. 肿瘤呈分叶状4例, 不规则形7例, 类圆形或椭圆形11例. 16例行CT检查中, 肿瘤密度均匀4例, 不均匀12例; 增强后均匀强化2例, 不均匀强化14例. 6例行MRI检查中, T1WI肿瘤呈稍低信号4例, 呈稍低、高混杂信号2例; T2WI呈等、高混杂信号6例; DWI肿瘤实性部分呈高信号6例; 增强后肿瘤实性部分明显强化. 22例EGIST中, 13例在动脉期肿瘤实性成分内可见条状强化的血管影, 9例伴有远处转移, 其中肝转移(5例)最多见.
结论: EGIST的MSCT和MRI表现有一定的特征性, MSCT和MRI是目前诊断EGIST的有效检查方法之一, MRI在早期发现肿瘤有无肠系膜、网膜、腹膜和骨骼的转移方面有一定优势.
引文著录: 李培岭, 任勇军, 翟昭华, 王萍. 胃肠道外间质瘤的MSCT和MRI诊断. 世界华人消化杂志 2012; 20(28): 2717-2723
Revised: August 22, 2012
Accepted: September 20, 2012
Published online: October 8, 2012
AIM: To explore the diagnostic value of multislice spiral computed tomography (MSCT) and magnetic resonance imaging (MRI) in extra-gastrointestinal stromal tumors (EGISTs).
METHODS: Twenty-two patients with EGISTs proved by immunohistochemistry were included in this study, of them 16 received MSCT examination and 6 underwent MRI.
RESULTS: According to immunohistochemistry results, there were 5 cases of mid-risk tumors and 17 cases of high-risk tumors. The locations of the tumors included the mesentery (6 cases), omentum (5 cases), pelvic cavity (5 cases), abdominal cavity (3 cases), retroperitoneum (2 cases), and abdominal wall (1 case). The sizes of the tumors ranged from 5.7 to 19.5 cm. The shape of the tumors was lobulated (4 cases), irregular (7 cases), round or oval (11 cases). Four cases appeared as homogenous density and 12 as heterogenous density on CT scans. Two cases demonstrated homogeneous and 14 tumors showed heterogeneous enhancement on enhanced MSCT scans. Of 6 patients who underwent MRI, the tumor appeared as slightly hypointensity in 4 cases and slightly hypo-hyperintensity in 2 cases on T1 weighted images; as iso-hyperintensity in 6 cases on T2 weighted images. The solid part of the tumor appeared as hyperintensity in 6 cases on DWI. Enhanced blood vessels in the solid component of the tumor could be seen in 13 cases on arterial phase. Nine cases (9/22) had distant metastases, including liver metastases (5 cases).
CONCLUSION: EGISTs show some MSCT and MRI characteristics. MSCT and MRI are effective methods for the diagnosis of EGISTs, and MRI has the advantage of early detection of mesenteric, retinal, peritoneal and bone metastases.
- Citation: Li PL, Ren YJ, Zhai ZH, Wang P. Diagnosis of extra-gastrointestinal stromal tumors by MSCT and MRI. Shijie Huaren Xiaohua Zazhi 2012; 20(28): 2717-2723
- URL: https://www.wjgnet.com/1009-3079/full/v20/i28/2717.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i28.2717
胃肠道外间质瘤(extra-gastrointestinal stromal tumor, EGIST)是起源于胃肠道外与肠壁或内脏浆膜面无关的罕见间叶组织肿瘤, 他与胃肠道间质瘤(gastrointestinal stromal tumor, GIST)具有相似的组织形态、免疫表型及分子生物学特征, 多数位于大网膜、肠系膜和腹膜后腔[1]. 有关EGIST报道较少, 其影像学表现在术前诊断中起着重要的作用. 本文回顾性分析经手术病理证实的22例EGIST患者的临床资料及MSCT和MRI表现, 以提高对本病的认识.
收集2004-06/2012-06经本院手术病理确诊且CT或MRI检查资料完整的胃肠道外间质瘤22例, 其中男12例, 女10例, 年龄37-77岁, 平均57.3岁. 临床表现为腹胀、腹部包块12例, 腹痛7例, 血便1例, 里急后重、肛门坠感不适1例, 进行性排尿困难1例, 排便困难1例.
18例患者行MSCT平扫及增强扫描, 采用日本东芝公司Aquilion16层螺旋CT机进行扫描, 检查前12 h禁食, 扫描前半小时口服清水或泛影葡胺稀释液500-1 000 mL. 扫描参数: 120 KV, 220 MA, 0.5 s/rot, 采用1 mm×16数据采集方式, 层厚5-7 mm, 无间隔, 螺距1.0. 常规取仰卧位, 先平扫后增强扫描, 增强扫描采用高压注射器经肘前静脉注射非离子型造影剂碘海醇100 mL(350 mg/mL), 注射速度3 mL/s, 行动脉期、静脉期扫描, 扫描时间分别为25 s、60 s, 扫描完成后重建为层厚1.0 mm、间隔0.5 mm的图像, 并以病变为中心做多平面重建(multiplanar reformation, MPR).
6例患者行MR平扫加增强扫描, 采用美国GE公司Signa excite 1.5T磁共振成像系统, 最大梯度场38 mT/m, 梯度切换率120 T/(ms), 八通道相控阵列体部线圈, 患者仰卧位, 腹带固定用呼吸门控. 平扫序列包括: 轴位、矢状位梯度回波T1加权(axial gradient echo T1-weighted, GRE)脂肪抑制序列及冠状位梯度回波T1加权序列, 轴位、矢状位和冠状位快速恢复快速自旋回波(Axial fast recovery fast spin echo, FRFSE)脂肪抑制序列和轴位DWI序列; 动态增强扫描序列包括: 脂肪抑制三维肝脏容积加速采集(3D-liver acquisition with volume acceleration, LA-VA)序列和GRE T1WI. GRE T1WI的扫描参数: TR 170-220 ms, TE 1.7 ms; FRFSE扫描参数: TR 4 140-740 ms, TE 97.6-131 ms; DWI采用SE-EPI形式扫描, 扫描参数: b = 500 s/mm2, TR 3 150 ms, TE 54.8 ms; 3D LA-VA序列扫描参数: TR = 4.0 ms, TE = 1.9 ms; DFOV 26 cm×26 cm-42 cm×42 cm, 矩阵256×192-384×224, 层厚/层间距5.0-6.0 mm/1.0-2.0 mm, 一次闭气扫描. 动态增强扫描使用19-G留置针经前臂静脉用高压注射器(Spectris MR Injector System; Medrad, USA)团注马根维显(Bayer Schering Pharma AG, Berlin, Germany)20 mL(0.1 mmol/kg体质量), 注射流率3 mL/s, 在5-7 s注射完毕后用20 mL生理盐水灌洗以确保对比剂充分利用.
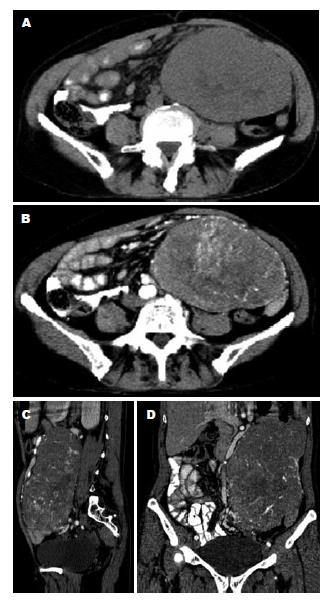
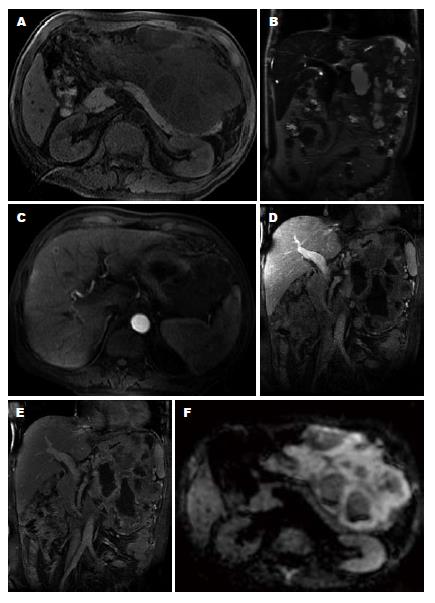
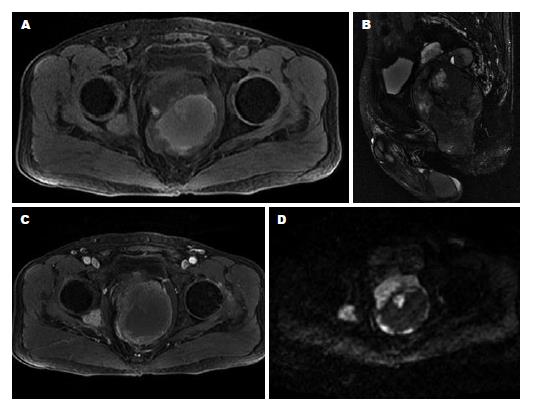
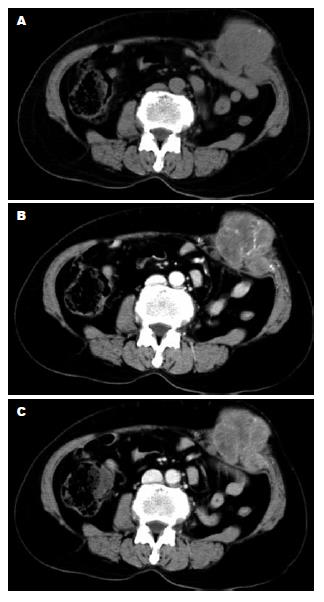
22例EGIST中, 位于肠系膜6例(图1), 网膜5例(图2), 盆腔5例(膀胱直肠间隙3例, 前列腺直肠间隙1例, 无法准确定位1例)(图3), 腹腔3例, 腹膜后间隙2例, 腹壁1例(图4). 肿瘤最大直径5.7-19.5 cm, 其中<10 cm 8例, ≥10 cm 14例. 肿瘤呈分叶状4例(图4), 不规则形7例(图2), 类圆形或椭圆形11例(图1), 其中边界清楚15例(图1, 3, 4), 与周围组织分界不清7例(图2).
16例行CT检查, 平扫表现为软组织密度肿块, 密度均匀4例(图4A), 不均匀12例(图1A), 内见斑片状低密度区(图1A); 增强后肿瘤表现为均匀强化2例(图4B,C), 不均匀强化14例(图1B, D).
6例行MRI检查中, 平扫表现为T1WI上呈稍低信号4例(图2A), 呈稍低、高混杂信号2例(图3A); T2WI上呈等、高混杂信号6例(图2B, 3B); DWI肿瘤实性部分呈高信号6例(图2F, 3D); 增强后肿瘤实质部分明显强化, 囊变、坏死及出血区不强化(图2E, 3C).
22例EGIST中, 肿瘤动脉期呈均匀或不均匀中度强化, 静脉期强化类似于动脉期(5例)(图1, 4); 动脉期呈轻-中度不均匀强化, 静脉期进行性强化, 强化明显高于动脉期(17例)(图2). 13例在动脉期肿瘤实性成分内可见密集或散在的条状强化血管影(图1B, 4B), 手术证实部分肿瘤由结肠系膜血管或胃结肠韧带血管对其供血, 病理结果提示高度危险性间质瘤.
本组22例伴有其他部位转移9例(40.9%)[肝脏5例(图2C), 脾脏、腹膜(图2D)及髋骨各2例(图3)和结肠种植1例], 腹水5例, 不全性肠梗阻1例, 22例均未发现腹腔、腹膜后或盆腔淋巴结转移. 随访10例, 4例肠系膜EGIST, 2例死亡, 2例术后复发(1例出现肝转移); 3例盆腔EGIST, 2例无瘤生存, 1例术后复发; 1例腹膜后EGIST术后复发; 2例大网膜EGIST均无瘤生存.
22例GEIST术后: 肿瘤呈类圆形、椭圆形、分叶状或不规则形, 2例见完整包膜, 12例表现为邻近结构受压、推移, 10例肿瘤与周围组织存在不同程度的粘连浸润, 17例肿瘤内出现囊变、坏死或出血. 光镜下: 肿瘤细胞大多呈栅栏状或编织状排列, 部分呈成群或剿状排列, 细胞丰富, 间质内黏液样变性及出血. 免疫组织化学: CD117阳性22例, CD34阳性19例, 部分SMA及Vimentin阳性. 病理学诊断为中度危险5例, 高度危险17例; 送检淋巴结呈反应性增生, 均未见转移.
目前, 关于EGIST的起源仍存在争议. 多数学者认为GIST的起源于胃肠道的Cajal细胞, 近年来, 大量研究证实, ICC不仅存在于胃肠道, 还普遍存在于其他系统和器官中, 例如泌尿生殖系统、脉管系统、胆道系统以及各种腺体之中[2], 这也许能够较好解释GIST和EGIST的起源; 也有学者[3]提出新的假说, 认为两者均来源于一种多分化潜能的间质干细胞, 这些间质干细胞可向Cajal细胞方向分化. Agaimy等[4]推测EGIST可能是GIST向外扩展生长的结果, 最终导致最小限度或甚至完全脱离肠道固有层. 本组3例术中见肿瘤与胃肠壁、胰腺或前列腺关系密切, 似乎支持Agaimy的观点.
Agaimy等[4]认为真正的EGIST非常罕见, 占GIST的比例不足1.5%. 其发病部位有网膜和肠系膜(45.1%), 盆腔(9.8%), 腹腔(34.3%), 腹膜后腔(3.9%), 腹壁(3.9%)和胰腺(3%)[5], 本组与文献报道基本一致. 但也有EGIST发生于胸膜、肝脏、胆囊、肾上腺、膀胱、前列腺和阴道的报道[6]. Agaimy等[4]认为这些EGIST大多数实际上可能是胃肠道原发肿瘤转移而来. EGIST通常在50岁以上的患者中更常见, 40岁以下患者很少见[7], 本组患者平均年龄57.3岁, 其中≥50岁19例(86.4%), 40-50岁2例(9.1%), 仅1例<40岁(4.5%). EGIST不累及黏膜, 因此与引起胃肠道出血的胃肠道间质瘤相比, 通常无临床症状, 由于其位置较深, 在出现梗阻和疼痛症状之前, 胃肠道外间质瘤也常比胃肠道间质瘤大. 本组肿瘤最大直径≥10 cm者14例(63.6%), 这可能是由EGIST的解剖部位决定的, 腹腔是个潜在的腔隙, 有足够的空间可供肿瘤生长, 早期肿瘤较小时难以发现.
EGIST的生物学行为常难以预测, 文献中关于EGIST的预后因素没有很好的解释. 人们普遍认为, 所有部位GIST最重要的预后因素是肿瘤的大小和有丝分裂计数. 然而, 有丝分裂指数低和体积小, 也不能完全预示良性生物学特征[8]. Franzini等[9]认为EGIST有充足的生长空间, 因此, 结合有丝分裂速度和肿瘤大小确定的分级系统, 通常用于GIST, 可能不适用于EGIST. 应明亮等[10]认为肠系膜和腹膜后的EGIST预后较差, 而网膜的EGIST有较好的预后, 本组的随访结果也证明了这一观点.
MSCT技术的发展使其在胃肠道疾病的诊断中发挥重要作用, 已成为包括EGIST在内的许多病变的首选检查方法[3], 特别是MPR对周围组织器官的侵犯情况显示清晰, 定位准确. EGIST主要好发于网膜、肠系膜、腹膜后及盆腔, 其主要影像学特征有: 多为体积较大的囊实性肿块, 呈类圆形、椭圆形或分叶状(15/22), 边界多清晰(15/22), 胃肠道多呈推压、移位改变(10/22); 肿瘤易坏死液化及出血(17/22), 钙化少见(1/22); 一般不伴有腹腔或腹膜后淋巴结转移(22/22), 部分可伴有其他脏器的转移(9/22), 以肝转移多见(5/9); 部分伴有腹、盆腔积液或肿瘤破裂引起的腹、盆腔积血(5/22); 增强扫描肿瘤实性部分多呈进行性强化, 以静脉期强化最为明显(17/22), 动脉期肿瘤实性部分内可见密集或散在的条状强化血管影(13/22). 文献报道[3,10-12]由于EGIST不是起源于胃肠道肌壁间, 因此不与胃肠道相同, 内部不会出现气体或气液平面.
与CT相比, MRI可提供EGIST的生长情况及与周周结构的关系, 并清楚显示肿瘤内坏死囊变和出血的范围, 预测肿瘤的良恶性, 早期发现有无肠系膜、网膜、腹膜和骨骼的转移及监测肿瘤的治疗后效果. 本组6例MRI检查, T1WI肿瘤实性部分呈以稍低信号, 2例伴有出血呈稍低、高混杂信号(2/6); T2WI呈等、高混杂信号(6/6); DWI肿瘤实性部分呈高信号(6/6); 增强后实性部分呈进行性明显强化. DWI是一种功能影像学技术, 反映了水分子的扩散运动, 已成为显示腹部肿瘤的新手段. 恶性GIST的细胞密度较高, 水分子扩散受限, 在DWI上呈高信号, 并能通过表观弥散系数(ADC)图对肿瘤的良恶性进行定量评估[13]. 目前对GIST的治疗, 包括EGIST, 主要为手术切除, 有50%的GIST术后复发. 酪氨酸激酶抑制剂伊马替尼已被证实对治疗转移性和无法手术切除的GIST是有效的, 伊马替尼能使GIST变小, 但这一般需要数月时间[14]. 文献报道[15]测量肿瘤的ADC值可以发现伊马替尼治疗后的早期改变, ADC值升高通常为肿瘤细胞减少的结果, 而ADC值的变化, 会出现在肿瘤体积变小之前. EGIST多为恶性肿瘤, 可通过血行或种植转移至肝、脾、腹膜、网膜等部位. 较小的腹膜、网膜转移瘤, 由于CT有限的对比度限制了他的检出能力, 文献报道[16]检查腹膜肿瘤最准确的方法是DWI结合延时钆对比剂增强MRI, 本组2例腹膜、网膜转移, MRI均能较好的显示. 由于MRI对含脂肪的骨髓组织中的肿瘤组织及其周围水肿非常敏感, 因此能检出CT甚至核素骨显像不易发现的转移灶, 本组2例髋骨转移, MRI DWI序列均能清晰的显示, 呈明显高信号.
EGIST需与GIST相鉴别, 以下几点有助于两者的鉴别: (1)有报道认为45%-86%的GIST为腔外性生长方式, 胃的GIST多通过细颈与胃壁相连, MSCT的MPR技术及MR多平面成像有助于判断肿瘤的起源部位, 且轻微的胃壁增厚并出现明显的强化也支持胃是肿瘤的起源器官; 而EGIST多与周围组织及器官粘连紧密, 但无明确的起源关系, 胃肠道多呈推压、移位改变; (2)GIST可因黏膜溃疡破溃导致病变与胃肠腔相通, 肿瘤内出现气体、液平或阳性对比剂; 而EGIST不是起源于胃肠道肌壁间, 肿瘤内部不会出现气体或气液平面; (3)GIST主要位于胃肠道的走行区, 并与胃肠壁关系密切, 互为一体; 而EGIST主要位于网膜、肠系膜、腹膜后及盆腔; (4)文献报道[17]CTA显示GIST相应的供血动脉或引流静脉增粗; 而EGIST相应血管增粗不明显.
EGIST需与发生在网膜、肠系膜、腹膜后和腹、盆腔的其他肿瘤如脂肪肉瘤、恶性纤维组织细胞瘤、平滑肌肉瘤、神经源性肿瘤、异位嗜铬细胞瘤、淋巴瘤等相鉴别[3]. (1)去分化型脂肪肉瘤: 体积较大, 密度(信号)不均, 脂肪成分或软组织肿瘤成分间分界清楚, 分界处呈突然中断为特征; (2)恶性纤维组织细胞瘤: 体积较大, 边界较清, 瘤内可见分隔、囊变及出血, 可伴有钙化; (3)平滑肌肉瘤: 女性多见, 体积较大, 易出现坏死囊变, 密度(信号)极不均匀, 增强后显著不均匀强化, 其强化程度较一般EGIST更明显; (4)神经源性肿瘤: 一般沿脊椎中线分布, 多有包膜, 边界清晰, 易囊变, 增强后实性部分明显强化; (5)异位嗜铬细胞瘤: 多见于脊柱两侧, 边缘规整, 伴有阵发性高血压和儿茶酚胺升高; (6)淋巴瘤: 腹膜后大血管周围、胰周间隙或肠系膜广泛性的淋巴结增大, 并融合成均质的分叶状肿块, 密度(信号)均匀, 将邻近动静脉包绕, 与强化的血管形成典型的"三明治征".
总之, EGIST的影像学表现有一定的特征性, 位于腹腔、腹膜后及盆腔体积较大的囊实性肿块, 边界多清晰, 增强后呈进行性强化, 动脉期肿瘤实性成分内可见条状强化血管及不伴有淋巴结转移时, 应考虑到EGIST的可能. MSCT和MRI是目前诊断EGIST的有效检查方法之一, MRI在早期发现肿瘤有无肠系膜、网膜、腹膜和骨骼的转移方面有一定优势.
胃肠道外间质瘤(EGIST)是起源于胃肠道外与肠壁或内脏浆膜面无关的罕见间叶组织肿瘤, 他与胃肠道间质瘤(GIST)具有相似的组织形态、免疫表型及分子生物学特征, 多数位于大网膜、肠系膜和腹膜后腔, 术前确诊率低. 有关EGIST的影像学表现, 特别是MRI表现报道较少, 了解本病的CT和MRI表现, 对临床诊断EGIST有重要的价值.
龙学颖, 副主任医师, 中南大学湘雅医院
目前EGIST在影像学方面的相关研究, 主要集中在其CT表现.
由于EGIET发病率较低, 临床报道多为个案或小组病例报道, 其发病机制、发病率、影像学表现及预后因素尚未被确定.
本文回顾分析EGIST的综合影像学表现, 不仅总结其CT表现, 而且探讨了MRI在诊断EGIST的优势.
EGIST发病率较低, 临床误诊率高, 影像学检查是诊断EGIST的重要方法.
胃肠外GIST相对较为少见, 鉴于GIST的临床特点、预后及治疗方法有别于其他肿瘤, 因此总结该病的一些特点有其临床重要性.
编辑: 李军亮 电编:闫晋利
| 1. | Wada Y, Ogata H, Misawa S, Shimada A, Kinugasa E. A hemodialysis patient with primary extra-gastrointestinal stromal tumor: favorable outcome with imatinib mesylate. Intern Med. 2012;51:1561-1565. [PubMed] [DOI] |
| 4. | Agaimy A, Wünsch PH. Gastrointestinal stromal tumours: a regular origin in the muscularis propria, but an extremely diverse gross presentation. A review of 200 cases to critically re-evaluate the concept of so-called extra-gastrointestinal stromal tumours. Langenbecks Arch Surg. 2006;391:322-329. [PubMed] [DOI] |
| 5. | Cho MY, Sohn JH, Kim JM, Kim KM, Park YS, Kim WH, Jung JS, Jung ES, Jin SY, Kang DY. Current trends in the epidemiological and pathological characteristics of gastrointestinal stromal tumors in Korea, 2003-2004. J Korean Med Sci. 2010;25:853-862. [PubMed] [DOI] |
| 6. | Li ZY, Liang QL, Chen GQ, Zhou Y, Liu QL. Extra-gastrointestinal stromal tumor of the liver diagnosed by ultrasound-guided fine needle aspiration cytology: a case report and review of the literature. Arch Med Sci. 2012;8:392-397. [PubMed] [DOI] |
| 7. | Castillo-Sang M, Mancho S, Tsang AW, Gociman B, Almaroof B, Ahmed MY. A malignant omental extra-gastrointestinal stromal tumor on a young man: a case report and review of the literature. World J Surg Oncol. 2008;6:50. [PubMed] [DOI] |
| 8. | Vij M, Agrawal V, Pandey R. Malignant extra-gastrointestinal stromal tumor of the pancreas. A case report and review of literature. JOP. 2011;12:200-204. [PubMed] |
| 9. | Franzini C, Alessandri L, Piscioli I, Donato S, Faraci R, Morelli L, Del Nonno F, Licci S. Extra-gastrointestinal stromal tumor of the greater omentum: report of a case and review of the literature. World J Surg Oncol. 2008;6:25. [PubMed] [DOI] |
| 11. | 朱 莉, 李 克, 邹 丽萍, 耿 道颖. 胰腺间质瘤1例报道并文献复习. 中国医学计算机成像杂志. 2011;17:89-91. |
| 14. | Hong X, Choi H, Loyer EM, Benjamin RS, Trent JC, Charnsangavej C. Gastrointestinal stromal tumor: role of CT in diagnosis and in response evaluation and surveillance after treatment with imatinib. Radiographics. 2006;26:481-495. [PubMed] [DOI] |
| 15. | Patterson DM, Padhani AR, Collins DJ. Technology insight: water diffusion MRI--a potential new biomarker of response to cancer therapy. Nat Clin Pract Oncol. 2008;5:220-233. [PubMed] [DOI] |
| 16. | Low RN, Sebrechts CP, Barone RM, Muller W. Diffusion-weighted MRI of peritoneal tumors: comparison with conventional MRI and surgical and histopathologic findings--a feasibility study. AJR Am J Roentgenol. 2009;193:461-470. [PubMed] [DOI] |