修回日期: 2012-08-20
接受日期: 2012-09-15
在线出版日期: 2012-10-08
目的: 探讨HLA-DRB1*11、14等位基因多态性与广西乙型肝炎病毒(hepatitis B virus, HBV)感染相关性肝病的关系.
方法: 选取HBV感染相关性肝病患者320例作为研究对象, 选择150例正常人作为对照组, 应用聚合酶链反应/序列特异性引物(polymerase chain reaction/sequence specific primer, PCR-SSP)方法检测HLA-DRB1*11、14等位基因频率, 分析其与HBV感染相关性肝病的关系.
结果: 在HBV携带者(chronic asymptomatic hepatitis B virus carrier, ASC)、慢性病毒性乙型肝炎(chronic hepatitis B, CHB)、肝炎肝硬化(liver cirrhosis, LC)、原发性肝细胞癌(hepatocellular carcinoma, HCC)组中, HLA-DRB1*11的基因频率分别为4.0%、8.6%、18.9%、5.0%, 与正常组(7.3%)比较, LC组P = 0.009; HLA-DRB1*14的基因频率分别是36.0%、30.7%、32.2%、35.0%, 与正常组(19.3%)比较, P值分别为0.016、0.025、0.024、0.035.
结论: (1)HLA-DRB1*14是ASC、CHB、LC、HCC的易感基因; (2)HLA-DRB1*11是乙肝肝硬化的易感基因.
引文著录: 李红玉, 吴继周, 吴健林, 庞裕, 蒋春燕, 覃玲, 韦柯利. HLA-DRB1*11、14等位基因对广西乙肝相关性肝病的影响. 世界华人消化杂志 2012; 20(28): 2672-2677
Revised: August 20, 2012
Accepted: September 15, 2012
Published online: October 8, 2012
AIM: To investigate the association between HLA-DRB1*11/14 alleles and hepatitis B virus (HBV)-related diseases in the Guangxi population.
METHODS: A total of 320 patients with HBV infection and 150 normal control subjects were included in this study. The frequencies of HLA-DRB1* 11/14 alleles were measured by polymerase chain reaction/sequence specific primer (PCR/SSP).
RESULTS: The frequency of the HLA-DRB1*11 allele in patients with liver cirrhosis was markedly higher than that in the normal control group (18.9% vs 7.3%, P = 0.007, OR = 0.340). The frequencies of the HLA-DRB1*14 allele in chronic asymptomatic hepatitis B virus carriers, patients with chronic hepatitis B, liver cirrhosis, or hepatocellular carcinoma were all higher than that in the normal control group (36.0% vs 19.3%, 30.7% vs 19.3%, 32.2% vs 19.3%, 35.0% vs 19.3%; P = 0.016, 0.025, 0.024, 0.035, OR = 0.426, 0.541, 0.504, 2.247).
CONCLUSION: The HLA-DRB1*11 allele is associated with susceptibility to liver cirrhosis, and the HLA-DRB1*14 allele is associated with susceptibility to chronic asymptomatic hepatitis B, chronic hepatitis B, liver cirrhosis and hepatocellular carcinoma in patients with HBV infection.
- Citation: Li HY, Wu JZ, Wu JL, Pang Y, Jiang CY, Qin L, Wei KL. Association between HLA-DRB1*11/14 alleles and HBV-related liver diseases. Shijie Huaren Xiaohua Zazhi 2012; 20(28): 2672-2677
- URL: https://www.wjgnet.com/1009-3079/full/v20/i28/2672.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i28.2672
我国大多数慢性乙型肝炎患者是在新生儿或婴幼儿时期感染乙型肝炎病毒(hepatitis B virus, HBV), 易发生对HBV抗原的免疫耐受, 治疗效果相对较差, 且易慢性化并发展成肝硬化和/或肝癌[1,2]. 因此, 了解HBV感染相关性肝病的进展对指导临床治疗患者具有重要意义. HBV感染相关性肝病的病情进展受多种因素的影响, 在人们的传统观念里, HBV感染是导致乙型肝炎、乙肝后肝硬化、HBV相关性肝癌的核心因素. 但有研究证明[3,4], 不同个体感染HBV后的病程转归各不相同, 除了HBV本身因素之外, 重要的是由于个体对HBV所发生的免疫应答不同, 这种免疫应答能力的不同主要是由人类白细胞抗原(human leukocyte antigen, HLA)决定[5,6]. 我们前期研究结果已表明[7], HLA-A*31、HLA- A*02、HLA-A*11 3个等位基因在慢性病毒性乙型肝炎、肝炎肝硬化、慢性乙肝重型3组间的分布频率均无显著性差别(P>0.05). 本研究是在之前研究的基础上进一步研究和了解HLA-DRB1*11、14等位基因对HBV感染相关性肝病发展的影响.
所有病例均来自2009-2010年在广西医科大学第一附属医院感染科就诊的广西籍HBsAg阳性的患者, 诊断标准按照2005年《慢性乙型肝炎防治指南》, 排除了合并丙型肝炎、丁型肝炎、药物性肝炎、自身免疫性肝病, 并排除了风湿性关节炎、多发性硬化症、糖尿病等免疫缺陷病. HBV携带者(chronic asymptomatic hepatitis B virus carrier, ASC)50例, 其中男23例, 女27例, 平均年龄为29.0岁±8.2岁; 慢性病毒性乙型肝炎(chronic hepatitis B, CHB)140例, 其中男106例, 女34例, 平均年龄为31.2岁±9.6岁; 肝炎肝硬化(liver cirrhosis, LC)90例, 其中男66例, 女24例, 平均年龄为47.0岁±8.9岁; 原发性肝细胞癌(hepatocellular carcinoma, HCC)40例, 其中男27例, 女13例, 平均年龄为54.5岁±10.1岁; 随机选取广西籍壮族及汉族无血缘关系的健康者150例作为正常对照组(normal), 其中男97例, 女53例, 平均年龄为37.8岁±14.4岁.
1.2.1 标本的采集与处理: 抽取研究对象空腹时外周静脉血4 mL, 其中2 mL分离血清后检测乙肝两对半、甲、丙、戊肝抗体、肝功能, 由广西医科大学第一附属医院检验中心完成. 另外2 mL血样混匀分装, 每管300 μL, -20 ℃保存用作DNA提取以检测HLA-DRB1.
1.2.2 DNA提取与检测: 取冻存的血样300 μL, 采用北京天根生化科技有限公司非离心柱型试剂盒提取DNA. 提取后用紫外分光光度仪Nano Drop 2000检测DNA的纯度和浓度, A260/280值需在1.6-1.8之间, DNA的浓度计算公式(μg/μL) = A260读数×50×稀释倍数/1 000, 调整浓度≥50 μg/μL, 4 ℃保存备用.
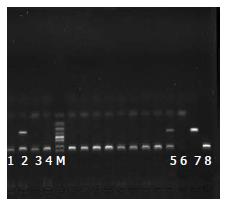
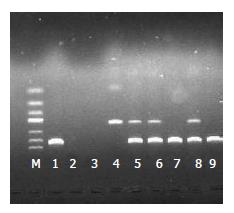
1.2.3 HLA-DRB1等位基因检测: 参照Bunce、Itoh等[8,9]文献设计HLA-DRB1*11(176 bp)和14(244 bp)的特异性引物各一对, 另设计一对人类生长因子引物(438 bp)作为参照来检测PCR反应体系是否正常. 各引物序列由上海生工生物工程技术提供.
1.2.4 PCR反应体系: 反应体系为25 μL. Premix Taq均为12.5 μL、DNA模板均为2 μL, HLA-DRB1*11、14引物(上、下游量相同)分别为0.4 μL和0.3 μL, 内参分别为0.4 μL、0.4 μL和0.3 μL. 其余由ddH2O组成(表1).
| 基因 | 引物序列 | 长度(bp) | 退火 | 基因长度(bp) |
| HLA-DRB1*11 | 5'-GTTTCTTGGAGTACTCTACGTC-3' | 22 | 60 ℃ 30 s | 176 |
| 3'-CTGGCTGTTCCAGTACTCCT-5' | 20 | |||
| HLA-DRB1*14 | 5'-GTTTCTTGGAGTACTCTACGTC-3' | 22 | 58 ℃ 40 s | 244 |
| 3'-TCTGCAATAGGTGTCCACCT-5' | 20 | |||
| 人类生长因子 | 5'-TCATTGACCTCAACTACATG-3' | 20 | 与位点相同 | 438 |
| 3'-GCAGTGATGGCATGGACTGT-5' | 20 |
1.2.5 PCR产物确定: 用2%琼脂糖凝胶、1×TBE液电泳, 在凝胶电泳成像系统上观看结果. 阳性产物送Invitrogen公司测序, 结果与GenBank HLA-DRB1*11、14基因的核苷酸序列进行比对, 确定产物为目的基因片段.
统计学处理 HLA-DRB1等位基因频率采用直接计数法. 各组之间频率的差异用χ2检验. 疾病与等位基因频率的关联强度用比数比(OR)和95%可信区间(95%CI)表示. P<0.05认为差异有统计学意义. 统计分析均通过SPSS16.0软件进行.
在病例组中, HLA-DRB1*11、14在汉族与壮族人群中的基因频率分布均无显著性差别(表2).
| 位点 | 壮族(n = 210) | 汉族(n = 110) | χ2值 | P值 | OR值 | 95%CI | ||
| 阳性 | 阴性 | 阳性 | 阴性 | |||||
| HLA-DRB1*11 | 22 | 188 | 11 | 99 | 0.018 | 0.894 | 1.053 | 0.491-2.260 |
| HLA-DRB1*14 | 68 | 142 | 36 | 74 | 0.004 | 0.950 | 0.984 | 0.602-1.610 |
在正常对照组中, HLA-DRB1*11、14在汉族与壮族人群中的基因频率分布均无显著性差别(表3).
| 位点 | 壮族(n = 87) | 汉族(n = 63) | χ2值 | P值 | OR值 | 95%CI | ||
| 阳性 | 阴性 | 阳性 | 阴性 | |||||
| HLA-DRB1*11 | 8 | 79 | 3 | 60 | 0.505 | 0.477 | 0.494 | 0.126-1.941 |
| HLA-DRB1*14 | 20 | 67 | 9 | 54 | 1.775 | 0.183 | 0.558 | 0.235-1.325 |
在ASC、CHB、LC、HCC各组中, HLA-DRB1*11的基因频率分布分别为4.0%、8.6%、18.9%、5.0%, 分别与正常对照组(7.3%)比较, LC组存在显著性差别(P = 0.007), 其余各组间均无显著性差别(表4).
| 分组 | n | 频率n(%) | χ2值 | P值 | OR值 | 95%CI |
| ASC | 50 | 2(4.0) | 0.247 | 0.619 | 1.899 | 0.406-8.877 |
| CHB | 140 | 12(8.6) | 0.152 | 0.697 | 0.844 | 0.360-1.980 |
| LC | 90 | 17(18.9) | 7.288 | 0.007 | 3.340 | 0.151-0.764 |
| HCC | 40 | 2(5.0) | 0.028 | 0.867 | 1.504 | 0.320-7.075 |
| Normal | 150 | 11(7.3) |
在ASC、CHB、LC、HCC各组中, HLA-DRB1*14的基因频率分布分别是36.0%、30.7%、32.2%、35.0%, 分别与正常对照组(19.3%)比较, 均存在显著性差别(P值分别为0.016、0.025、0.024和0.035, 表5).
| 分组 | n | 频率n(%) | χ2值 | P值 | OR值 | 95%CI |
| ASC | 50 | 18(36.0) | 5.794 | 0.016 | 0.426 | 0.210-0.863 |
| CHB | 140 | 43(30.7) | 5.026 | 0.025 | 0.541 | 0.315-0.929 |
| LC | 90 | 29(32.2) | 5.099 | 0.024 | 0.504 | 0.277-0.918 |
| HCC | 40 | 14(35.0) | 4.427 | 0.035 | 2.247 | 1.045-4.832 |
| Normal | 150 | 29(19.3) |
HLA系统是目前已知人体内基因多态性最为丰富的系统之一, 具有一定的民族差异和地区差异[10]. 壮族是我国人口最多的少数民族, 其中93.7%的壮族人口聚居在广西[11]. 龙桂芳等[12]研究广西地区壮族HLA等位基因的多态性发现, 壮族跟南方汉族HLA-DQA1、DQB1的基因分布最为接近. 潘尚领等[13]检测了13个HLA-DRB1等位基因, 与东南亚的不同民族群体比较, 发现13个等位基因的分布格局: 壮族最接近于布依族, 其次是新加坡华人和南方汉族, 与北方汉族及越南京族的差异则相对明显.
本研究将病例组中210例壮族和110例汉族进行比较, HLA-DRB1*11、14的差别无显著性(P值分别为0.894、0.950, P>0.05); 正常对照组中, 87例壮族和63例汉族比较, HLA-DRB1*11、14的差别亦无显著性(P值分别为0.477、0.183, P>0.05), 表明HLA-DRB1*11、14的基因在广西的壮族和汉族人群中的分布无显著性差别.
据EBI(欧洲生物信息学中心)2012-01的最新数据显示: HLA-DRB1的等位基因数已有1 067个. 而本研究只选取了HLA-DRB1*11、14进行研究. HLA系统调控人类特异性免疫应答的作用机制: 首先, 抗原病毒特异性CD8+CTL(细胞毒淋巴细胞)能直接杀死感染HBV的肝细胞, 这是清除肝细胞内病毒的最主要方式[14,15]. 而CD4+T淋巴细胞对CTL功能的发挥起着重要的支持作用[16,17]. 另外, HLA可以结合来自细胞内或细胞外的肽, 形成HLA-肽复合物, 然后通过抗原递呈细胞(antigen present cells, APC)将该复合物递呈给T细胞(主要是CD4+T细胞), 从而引起一系列免疫应答. 因此, 不同的HLA等位基因对CD4+T细胞的不同的免疫识别和激活能力, 决定了疾病的易感性和病程转归的差异[18,19].
HBV特异的CTL对感染HBV的肝细胞识别被认为是引起肝损害和清除病毒的中心机制[20]. CD4+T淋巴细胞对CTL这种功能的发挥起着重要的支持作用[21,22]. Diepolder等[23]研究发现携带HLA-DRB1*13者有较强的CD4+T细胞应答, 而不携带者则弱得多, 表明HLA-DRB1*13能够较好的进行抗原递呈作用, 调节免疫应答, 由此提出通过加强CD4+T应答来改善HBV感染后疾病的预后. Fletcher等[24]发现, 感染HBV后, 自然恢复组和转为慢乙肝组的HLA-DRB1*11的基因频率并无明显差异. Jin等[25]检测HLA-DRB1*11在36名肝癌患者与432名非肝癌患者中的基因频率, 发现肝癌组与非肝癌组基因频率相比也无显著性差异.
本研究中, 在ASC、CHB、LC、HCC组, HLA-DRB1*11的基因频率分别与正常对照组比较, ASC、CHB、HCC组均无显著性差异, 只有LC组与正常组比较存在显著性差别(P = 0.007, OR = 3.340), 表明HLA-DRB1*11是LC的易感基因, HLA-DRB1*11基因携带者发生LC的危险性是不携带该基因者的3.34倍. HLA-DRB1*11在ASC、CHB、LC组的表达频率分别为4.0%、8.6%、18.9%, HLA-DRB1*11基因的携带率随乙肝病情的加重呈逐渐增高的趋势, 提示HLA- DRB1*11基因携带者可能会促进ASC向CHB、LC发展. Han等[26]研究表明, 上海地区36名携带HLA-DRB1*14基因的慢乙肝患者, 经干扰素治疗后, 应答率明显高于无应答率; Han等[27]将HLA-DRB1*14基因频率在396名HBV感染者与400名正常人进行比较, 并无明显差异. 黄爱春等[28]研究发现HLA-DRB1*14的表达频率在40名肝癌患者中明显高于135名正常人, 表明HLA-DRB1*14是广西人群原发性肝癌的易感基因.
本研究中, HLA-DRB1*14的基因频率在ASC、CHB、LC、HCC组中均显著高于正常组, 但并无逐渐增高或降低的趋势; HLA-DRB1*14在ASC(P = 0.016, OR = 0.426)、CHB(P = 0.025, OR = 0.541)、LC(P =0.024, OR = 0.504)、HCC(P = 0.035, OR = 2.247)组与正常组相比, 具有显著性差异, 表明HLA-DRB1*14是ASC、CHB、LC、HCC的易感基因, 但似与病情的发展的严重程度无明显相关; HLA-DRB1*14基因携带者发生ASC、CHB、LC、HCC的危险性是不携带该基因者的0.426、0.541、0.504、2.247倍.
迄今, 国内外关于HLA-DRB1与HBV感染相关性肝病发生及发展的关系研究结果并不完全一致, 主要原因可能是HLA的分布受环境、民族和生活习惯的差异以及未知因素的影响所致. 与HBV感染相关的HLA某些等位基因可能只是和真正的致病基因处于紧密连锁不平衡, 而该HLA基因本身并不是疾病的直接原因[29]. 就遗传易感因素而言, 每个多态性位点并不是孤立的发挥作用, 而是存在一定的内在关联, 这种内在关联可以表现为相互拮抗或者协同[30]. 因此, 要下结论尚需扩大样本进行更深入的研究.
广西是我国乙型肝炎的高发地区, HBV感染后经历肝炎、肝硬化、肝癌的变化, 病程漫长, 严重困扰着人们的正常生活. 目前研究多在HLA-DRB1的等位基因内, 探索HBV相关类疾病的易感基因, 以期找出本类疾病的标志性基因.
孙殿兴, 主任医师, 白求恩国际和平医院肝病科; 方今女, 教授, 延边大学医学院预防医学教研组
Thursz等的研究认为, 不同个体感染HBV后的病程和转归各不相同, 并不是由HBV本身所决定的, 而是由HLA等位基因的免疫应答能力不同所决定.
目前研究多集中在HLA-DRB1等位基因对乙肝相关性肝病的单一病种的影响, 而本研究主要研究HLA-DRB1等位基因对HBV相关性肝病整个疾病过程的影响.
抗原递呈细胞: 又称辅佐细胞, 这类细胞表面具有大量的HLAⅡ分子的表达, 能够捕捉、加工、处理抗原, 并能够将抗原递呈给具有抗原特异性的淋巴细胞, 在抗感染、抗肿瘤、免疫调节方面都起着不可取代的作用.
本研究探讨了HLA-DRB1*11、14等位基因多态性与广西乙肝病毒感染相关性肝病病情的相关性, 有一定的创新性和临床意义.
编辑: 李军亮 电编:鲁亚静
| 1. | 庄 辉. 乙型肝炎流行病学研究进展. 中国医学前沿杂志(电子版). 2009;1:18-24. |
| 2. | Singh R, Kaul R, Kaul A, Khan K. A comparative review of HLA associations with hepatitis B and C viral infections across global populations. World J Gastroenterol. 2007;13:1770-1787. [PubMed] |
| 3. | Thursz MR, Kwiatkowski D, Allsopp CE, Greenwood BM, Thomas HC, Hill AV. Association between an MHC class II allele and clearance of hepatitis B virus in the Gambia. N Engl J Med. 1995;332:1065-1069. [PubMed] [DOI] |
| 4. | Li X, Liu W, Wang H, Jin X, Fang S, Shi Y, Liu Z, Zhang S, Yang S. The influence of HLA alleles and HBV subgenotyes on the outcomes of HBV infections in Northeast China. Virus Res. 2012;163:328-333. [PubMed] [DOI] |
| 5. | Ramezani A, Hasanjani Roshan MR, Kalantar E, Eslamifar A, Banifazl M, Taeb J, Aghakhani A, Gachkar L, Velayati AA. Association of human leukocyte antigen polymorphism with outcomes of hepatitis B virus infection. J Gastroenterol Hepatol. 2008;23:1716-1721. [PubMed] [DOI] |
| 6. | Yang G, Liu J, Han S, Xie H, Du R, Yan Y, Xu D, Fan D. Association between hepatitis B virus infection and HLA-DRB1 genotyping in Shaanxi Han patients in northwestern China. Tissue Antigens. 2007;69:170-175. [PubMed] [DOI] |
| 8. | Bunce M, O'Neill CM, Barnardo MC, Krausa P, Browning MJ, Morris PJ, Welsh KI. Phototyping: comprehensive DNA typing for HLA-A, B, C, DRB1, DRB3, DRB4, DRB5 & amp; DQB1 by PCR with 144 primer mixes utilizing sequence-specific primers (PCR-SSP). Tissue Antigens. 1995;46:355-367. [PubMed] [DOI] |
| 9. | Itoh Y, Mizuki N, Shimada T, Azuma F, Itakura M, Kashiwase K, Kikkawa E, Kulski JK, Satake M, Inoko H. High-throughput DNA typing of HLA-A, -B, -C, and -DRB1 loci by a PCR-SSOP-Luminex method in the Japanese population. Immunogenetics. 2005;57:717-729. [PubMed] [DOI] |
| 12. | 龙 桂芳, 阿 卜迪. 用PCR-SSP方法研究广西壮族HLA-DQA1和B1基因多态性. 中华微生物学和免疫学杂志. 1999;19:504-505. |
| 13. | 潘 尚领, 刘 承武, 龙 桂芳, 袁 志刚, 石 文, 林 伟雄, 陈 萍, 陈 晶, 陈 文成, 周 小玲. 广西壮族HLA-DRB1基因的多态性及其与主要周边民族的比较. 中华微生物学和免疫学杂志. 2005;25:48-51. |
| 14. | Jung MC, Pape GR. Immunology of hepatitis B infection. Lancet Infect Dis. 2002;2:43-50. [PubMed] [DOI] |
| 16. | Godkin A, Davenport M, Hill AV. Molecular analysis of HLA class II associations with hepatitis B virus clearance and vaccine nonresponsiveness. Hepatology. 2005;41:1383-1390. [PubMed] [DOI] |
| 17. | Cho SW, Cheong JY, Ju YS, Oh do H, Suh YJ, Lee KW. Human leukocyte antigen class II association with spontaneous recovery from hepatitis B virus infection in Koreans: analysis at the haplotype level. J Korean Med Sci. 2008;23:838-844. [PubMed] [DOI] |
| 19. | Hong X, Yu RB, Sun NX, Wang B, Xu YC, Wu GL. Human leukocyte antigen class II DQB1*0301, DRB1*1101 alleles and spontaneous clearance of hepatitis C virus infection: a meta-analysis. World J Gastroenterol. 2005;11:7302-7307. [PubMed] |
| 21. | Sing G, Butterworth L, Chen X, Bryant A, Cooksley G. Composition of peripheral blood lymphocyte populations during different stages of chronic infection with hepatitis B virus. J Viral Hepat. 1998;5:83-93. [PubMed] [DOI] |
| 22. | Bayard F, Malmassari S, Deng Q, Lone YC, Michel ML. Hepatitis B virus (HBV)-derived DRB1*0101-restricted CD4 T-cell epitopes help in the development of HBV-specific CD8+ T cells in vivo. Vaccine. 2010;28:3818-3826. [PubMed] [DOI] |
| 23. | Diepolder HM, Jung MC, Keller E, Schraut W, Gerlach JT, Grüner N, Zachoval R, Hoffmann RM, Schirren CA, Scholz S. A vigorous virus-specific CD4+ T cell response may contribute to the association of HLA-DR13 with viral clearance in hepatitis B. Clin Exp Immunol. 1998;113:244-251. [PubMed] [DOI] |
| 24. | Fletcher GJ, Samuel P, Christdas J, Gnanamony M, Ismail AM, Anantharam R, Eapen CE, Chacko MP, Daniel D, Kannangai R. Association of HLA and TNF polymorphisms with the outcome of HBV infection in the South Indian population. Genes Immun. 2011;12:552-558. [PubMed] [DOI] |
| 25. | Jin YJ, Shim JH, Chung YH, Kim JA, Choi JG, Park WH, Lee D, Lee YS, Kim SE, Kim SH. Relationship of HLA-DRB1 alleles with hepatocellular carcinoma development in chronic hepatitis B patients. J Clin Gastroenterol. 2012;46:420-426. [PubMed] [DOI] |
| 26. | Han YN, Yang JL, Zheng SG, Tang Q, Zhu W. Relationship of human leukocyte antigen class II genes with the susceptibility to hepatitis B virus infection and the response to interferon in HBV-infected patients. World J Gastroenterol. 2005;11:5721-5724. [PubMed] |
| 27. | Han Y, Jiang ZY, Jiao LX, Yao C, Lin QF, Ma N, Ju RQ, Yang F, Yu JH, Chen L. Association of human leukocyte antigen-DRB1 alleles with chronic hepatitis B virus infection in the Han Chinese of Northeast China. Mol Med Report. 2012;5:1347-1351. [PubMed] |
| 28. | 黄 爱春, 吴 继周, 吴 健林, 陈 务卿, 韦 颖华, 罗 双艳, 宁 秋悦, 李 兰兰. HLA-DRB1*14和*15等位基因与肝癌的相关性. 临床肝胆病杂志. 2010;26:420-422. |