修回日期: 2012-08-18
接受日期: 2012-09-04
在线出版日期: 2012-09-28
目的: 探讨TIMP-3和RASSF1A在大肠癌发生发展中的作用及与临床病理特征之间的关系, 并且研究TIMP-3和RASSF1A之间的相关性.
方法: 应用免疫组织化学法检测大肠癌组织, 大肠癌旁组织及正常大肠黏膜组织中TIMP-3和RASSF1A蛋白的表达量并结合患者的年龄、性别、分化程度、淋巴结转移等临床病理因素进行综合分析. 采用Spearman等级相关分析TIMP-3和RASSF1A之间的相关性.
结果: 在正常大肠黏膜、癌旁和腺癌中TIMP-3的阳性率分别为90.0%、70.0%和16.7%, RASSF1A阳性率分别为83.3%、63.3%和23.3%. 大肠癌中TIMP-3和RASSF1A的表达量与淋巴结转移(P<0.05; P<0.01)、浸润深度(P<0.05; P<0.01)及分化程度(P<0.05; P<0.05)有关. 运用Spearman等级相关分析, TIMP-3和RASSF1A的表达呈正相关(r = 0.256, P<0.05).
结论: 在大肠癌中TIMP-3和RASSF1A具有明显相关性, TIMP-3和RASSF1A的表达下调可能与大肠癌的发生有关, 可以作为鉴别大肠良恶性肿瘤的指标.
引文著录: 顾全凯, 闫庆辉, 王凤安, 薛平. TIMP-3和RASSF1A在大肠癌中的表达及临床意义. 世界华人消化杂志 2012; 20(27): 2642-2647
Revised: August 18, 2012
Accepted: September 4, 2012
Published online: September 28, 2012
AIM: To investigate the correlation between TIMP-3 and RASSF1A expression and clinicopathologic features of colorectal cancer.
METHODS: The expression of TIMP-3 and RASSF1A was detected by immunohistochemistry in colorectal cancer, tumor-adjacent colorectal tissue and normal colorectal tissue specimens. The correlation between TIMP-3 and RASSF1A expression and clinicopathologic features, such as patient's age, gender, infiltration degree, and lymph node metastasis, was analyzed. The correlation between TIMP-3 and RASSF1A expression was also determined by spearman′s rank correlation analysis.
RESULTS: The positive rates of TIMP-3 expression in normal colorectal mucosa, tumor adjacent tissue and colorectal cancer were 90.0%, 70.0% and 16.7%, respectively, and those of RASSF1A were 83.3%, 63.3% and 23.3%. In colorectal cancer, the expression of TIMP-3 and RASSF1A was related to lymph node metastasis, depth of invasion, and degree of tumor differentiation (all P < 0.05). Spearman rank correlation analysis showed that there is a positive correlation between TIMP-3 and RASSF1A expression in colorectal adenocarcinoma (r = 0.256, P < 0.05).
CONCLUSION: The expression of TIMP-3 is significantly correlated with that of RASSF1A in colorectal cancer. The down-regulation of TIMP-3 and RASSF1A may be involved in the genesis of colorectal cancer and may be used as an index for evaluation of tumor malignancy.
- Citation: Gu QK, Yan QH, Wang FA, Xue P. Clinical significance of TIMP-3 and RASSF1A expression in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(27): 2642-2647
- URL: https://www.wjgnet.com/1009-3079/full/v20/i27/2642.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i27.2642
大肠癌是常见的恶性肿瘤之一, 现在其发病呈逐年上升的趋势, 在全年有文献报道的恶性肿瘤中排第3位. 在我国, 尤其是在大城市, 发病率明显上升. 大肠癌的发病过程是一个复杂的、多基因、多方面、多因素参与, 共同作用的过程, 从基因学角度研究分析大肠癌的发生和发展是从根本上解决和治疗大肠癌的方法, 浸润和转移是大肠癌主要的生物学行为, 基因的各种改变都会影响大肠癌的浸润和转移. RASSF1和TIMP-3是新近发现的2种抑癌基因. RASSF1A作为抑癌基因, 在抑制肿瘤的发生和发展中的抑制作用机制尚不完全清楚, 目前有2种: (1)通过对Rb家族细胞周期检查点的作用而诱导细胞周期的停滞. RASSF1A可以抑制周期素D1(CyclinD1)的积聚而控制细胞周期G1期向S期转变, 从而调控细胞的增殖[1]; (2)活化的RAS癌蛋白在细胞中可能起到双重作用, 一方面促进细胞生长和转化, 另一方面他又促进细胞的凋亡、衰老、坏死和终末分化. 而RASSF1基因可能编码RAS后的一种效应蛋白, 他的失活破坏了RAS的平衡作用, 导致细胞的恶性转换[2]. TIMP-3具有抑制血管生成的作用, 主要表现在TIMP-3对MMPS的特异性抑制作用, 基质金属蛋白酶(matrix metalloproteinases, MMPs)是重要的血管生成诱导和调控因子[3,4], 他能诱导血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)的生成进而刺激内皮细胞合成蛋白酶[5], 促进了内皮细胞的增殖和迁移. TIMP-3能特异性的抑制MMPS, 进而有效的阻止了内皮细胞的增殖和迁移. 我们通过研究大肠癌中TIMP-3和RASSF1蛋白的表达情况, 初步探讨其与大肠癌发生发展, 浸润和转移的关系, 为大肠癌的治疗寻找新的靶点.
收集河北医科大学第二医院2009-2011年经手术切除的大肠癌标本60例, 对应癌旁组织(距离癌边缘5 cm)及正常大肠组织30例. 福尔马林固定、梯度酒精脱水和常规石蜡包埋. 其中男36例、女24例, 年龄≤50岁26例、>50岁34例; 有淋巴转移的42例、无淋巴转移18例; 高中分化47例、低分化13例; 侵及和超过浆膜层36例、未及浆膜层24例. 以上所有标本均经有经验的病理医师诊断, HE染色证实. 所有入选病例皆未进行过放、化疗、无长期服用非甾体抗炎药、皮质激素类药物史. 每例标本均经HE切片再次复查认定. 鼠抗人RASSF1A单克隆抗体(美国SANTA CRUZ公司); 鼠抗人TIMP-3单克隆抗体(美国SANTA CRUZ公司); DAB法显色试剂盒(北京中杉金桥生物技术有限公司); SP试剂盒(北京博奥森公司).
1.2.1 标本制备: 经10%甲醛溶液固定、常规脱水和石蜡包埋, 连续4 μm切片.
1.2.2 免疫组织化学SP法(链酶卵白素-过氧化酶法): 按试剂盒说明操作, 阴性对照用PBS液代替1抗作为空白对照. 1抗TIMP-3、RASSF1A的工作浓度均为1:200.
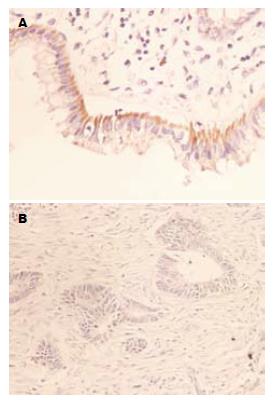
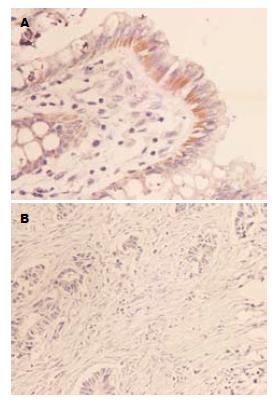
1.2.3 结果判定: TIMP-3以细胞浆内出现棕黄色颗粒为阳性细胞. 按着色强度分4级: 未着色、浅棕色、棕色和深棕色分别为0、1、2和3级; 按着色密度分4级: 着色细胞数≤25%为0级、26%-50%为1级、51%-75%为2级、>75%为3级. 两者之积为0为阴性(-); 1-4分为弱阳性(+); >4分即强阳性(++), (-)-(+)定为表达减弱或缺失, (++)定为阳性表达. RASSF1阳性表达在细胞浆出现棕黄色颗粒. 表达强度判定标准如下: 随机取10个高倍视野, 计算每个视野中100个细胞中的阳性细胞数, 取均值, 以百分数表示阳性指数. 阳性评分标准为: 0-10%为0分; 11%-25%为1分; 26%-50%为2分; 51%-75%为3分; 76%-100%为4分. 以染色强度评分: 不着色为0, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 两者相加之和: 0-1分(-); 2-3分(±); 4-5分(+); 6-7分(++). 将(-)和(±)定为阴性, (+)和(++)定为阳性.
统计学处理 应用SPSS13.0统计软件包进行统计分析, TIMP-3和RASSF1A的表达与临床病理因素之间的关系采用χ2检验. TIMP-3和RASSF1A的相关性采用Spearman等级相关分析, P<0.05差异具有统计学意义.
TIMP-3蛋白主要在细胞质中表达, 阳性染色为棕黄色颗粒或团块(图1). RASSF1A阳性染色位于细胞浆, 染色呈棕黄色. 有的胞质内呈弥漫性均质性阳性, 细胞核不着色(图2), TIMP-3和RASSF1A在正常组、癌旁组及肠癌组中的表达见表1.
| 分组 | n | TIMP-3 | RASSF1A | ||
| 阳性数(n) | 阳性率(%) | 阳性数(n) | 阳性率(%) | ||
| 正常组 | 30 | 27 | 90 | 25 | 83.3 |
| 癌旁组 | 60 | 42 | 70 | 38 | 63.3c |
| 肠癌组 | 60 | 10 | 16.7b | 14 | 23.3 |
在60例大肠癌中TIMP-3+/RASSF1A+ 14例, TIMP-3+/RASSF1A- 19例, TIMP-3-/RASSF1A+ 5例, TIMP-3-/RASSF1A- 22例. 通过Spearman等级相关分析表明: TIMP-3和RASSF1A成正相关(r = 0.256, P = 0.049).
TIMP-3是MMP的全功能抑制剂, 能对明胶酶、胶原酶、基质溶素产生抑制作用, 从而抑制肿瘤的生长、浸润和转移. 他有4个成员, 其中TIMP-3是唯一能与ECM紧密结合的可溶性蛋白. 与MMP结合形成复合物抑制MMP降解ECM的能力, 从而阻止肿瘤的生长、浸润和转移. 限制肿瘤新生血管的生成. TIMP-3在心脏、脑、肺、肾脏、胎盘和子宫等都有表达. 然而许多肿瘤细胞中可见到TIMP-3表达的下降和缺失. Takahashi等[6]用含有TIMP-3基因的仙台病毒脂质体转染大鼠RPE后3 d,激光照射视网膜以诱导CNV(脉络膜新生血管)形成, 结果发现, RPE中TIMP-3的过表达明显抑制CNV的产生. 而Murata等[7]也用类似方法发现了TIMP用于CNV基因治疗的可行性. 从而可以看到TIMP-3在限制肿瘤新生血管中的作用. 在对非小细胞癌的研究中Mino等[8]认为TIMP-3与肿瘤的病理分型和淋巴转移密切相关, 呈高表达TIMP-3的患者5年生存率较高, 且预后好. 同样Mylona等[9]在对乳腺癌的研究中也得出在预后差、恶性程度较高的乳腺癌中TIMP-3的表达较低, 证明TIMP-3与肿瘤分型和临床预后有关.
用免疫组织化学方法检测胃癌TIMP-3的表达情况, 发现在胃癌早期其表达较高, 晚期表达降低. 说明随着病情的进展TIMP-3对MMP的抑制能力减弱, 其MMP降解ECM的能力增强, 利于肿瘤的侵袭和转移. 由此认为TIMP-3可以作为判断胃癌转移和浸润的一个重要观察指标[10]. 胃癌发生是一个复杂的过程, 涉及到遗传学与表观遗传学. 表观遗传学改变主要包括DNA甲基化和组蛋白修饰等, 其中DNA甲基化是最重要的表观修饰机制. 已有研究证实表观遗传学的改变在胃癌的发展过程中起主导作用[11,12]. 研究证实TIMP3基因启动子CpG岛甲基化是其失活的主要机制[13]. 杨杨等[14]通过MSP(甲基化特异性PCR)检测TIMP-3在胃病变中的甲基化情况, 结果显示: 胃癌早期TIMP-3已经表现出很高的甲基化程度, 可以认为其表观遗传学改变是胃癌的早期事件.
在对结直肠癌的研究中发现, 结直肠癌组、癌旁非癌组织组、duck-c+d期伴淋巴转移组和a+b期不伴淋巴转移组TIMP-3的甲基化阳性表达率分别为42%、0、55%和24%. TIMP-3基因甲基化阳性率与结直肠癌的肿瘤部位、淋巴结转移、分化程度和大体类型等病理特征密切相关, 而对不同性别和年龄无显著差异[15].
RASSF1是许多实体肿瘤3q缺失区中一段120 kb的重要的缺失区域, 其转录本编码的蛋白多肽C端与Nore1(小鼠Ras效应蛋白)及Maxp1(大鼠同源蛋白)有近55%的同源性, 故将其cDNA命名为Ras相关区域家族1(RASSF1). 大量研究证实: RASSF1A蛋白几乎在所有正常组织中表达, 但在肺癌和乳腺癌等多种肿瘤中有较高的表达缺失, 这与肿瘤的恶性程度、淋巴转移及临床分期密切相关[16-18]. 内源性CyclinD1的累积可以使细胞避开检测点从而促进细胞增殖, RASSF1A可以在翻译水平抑制Cyclin Dl的累积而使细胞周期阻断在G1/S期, 抑制细胞增殖, 起到抑癌作用[1,16,19]. 启动子CpG岛异常甲基化是RASSF1A重要的失活原因[20]. 在正常组织中, RASSF1基因100%表达, 但在17种肺中小细胞癌细胞中表达缺失[21]. 在对恶性间皮瘤和胃癌的研究中, RASSF1A的甲基化分别与SV40和EB病毒的感染有关, 说明肿瘤的发生与病毒的感染存在一定的关系[22,23]. Dammann等[24]报道肺癌患者的存活情况与RASSF1A甲基化有关, 其甲基化与病人的预后及肿瘤进展参数有关. Byun等[25]对胃癌的研究发现, 95%不表达RASSF1A的原发性肿瘤标本的甲基化发生在启动子区的CpG位点上. 该研究提示, 表型遗传修饰所致的RASSF1(尤其是RASSF1A)失活是胃癌发生中一个重要的事件, 可能在其发展过程中起重要作用. Kang等[23]在对EB病毒致癌机制的研究中发现, EB阳性的胃癌标本中RASSF1A甲基化是阴性标本中的3倍. 可见, 肿瘤发生过程中病毒感染和RASSF1A甲基化有密切的关系. RASSF1A表达缺失参与了胃癌的发生、发展并促进胃癌的浸润和转移[26]. Zhong等[27]对肝细胞癌和正常组织中RASSF1A启动子甲基化对比性研究发现: 正常肝组织和正常组织外周血单核细胞标本中均未发现RASSF1A启动子CpG岛甲基化, 4个肝癌细胞系中: CpG岛完全甲基化且RASSF1A转录停止. 经甲基化抑制剂处理后可使其中两个细胞系(Hep3B和HepG2)重新表达RASSF1A. Wagner等[28]发现80%的结直肠癌细胞系和45%的原发性结直肠癌中存在RASSF1A启动子的甲基化. 周岩等[29]对膀胱细胞癌的研究发现: 在正常膀胱组织中RASSF1A呈高表达而膀胱移行细胞癌组织中RASSF1A的表达缺失, 提示RASSF1A的表达缺失在膀胱移行细胞癌的发生过程中发挥一定的作用.
本研究结果显示TIMP-3和RASSF1A在大肠癌组织、癌旁组织和大肠正常组织中的阳性表达率有上升趋势. 说明RASSF1A和TIMP-3可能促进大肠癌的进展和恶化. 因此了解两种蛋白的表达情况可能成为早期诊断和判断病人预后的一个重要辅助手段. 本研究还通过等级相关分析的方法对TIMP-3和RASSF1A在大肠癌中表达的相互关系进行分析, 结果显示两者的阳性表达率明显相关且具有统计学意义. 因此通过联合检测TIMP-3和RASSF1A的表达能提高对大肠癌的检测准确性并有利于判断病人的预后, 从而更好的指导临床.
RASSF1和TIMP-3是新近发现的2种抑癌基因. RASSF1A可能通过对Rb家族细胞周期检查点的作用而诱导细胞周期的停滞. RASSF1A可以抑制Cyclin D1的积聚而控制细胞周期G1期向S期转变, 从而调控细胞的增殖. 此外活化的RAS癌蛋白在细胞中可能起到双重作用, 一方面促进细胞生长和转化, 另一方面他又促进细胞的凋亡、衰老、坏死和终末分化. TIMP-3具有抑制血管生成的作用, 其通过特异性的抑制MMPS, 进而有效的阻止了内皮细胞的增殖和迁移.
关晓辉, 主任医师, 吉林北华大学附属医院; 刘宝林, 教授, 中国医科大学附属盛京医院
本文通过免疫组织化学方法检测TIMP-3和RASSFI在大肠癌组织、癌旁组织及正常组织中的表达情况, 分析其与肿瘤临床病理的关系及两者在各组中表达的相互关系, 为大肠癌的早期诊断及治疗提供理论依据.
本研究结果显示TIMP-3和RASSF1A在大肠癌组织、癌旁组织和大肠正常组织中的阳性表达率有上升的趋势. 说明RASSF1A和TIMP-3可能促进大肠癌的进展和恶化. 因此了解两种蛋白的表达情况可能成为早期诊断和判断患者预后的一个重要的辅助手段. 通过联合检测TIMP-3和RASSF1A的表达能提高对大肠癌检测的准确率并有助于判断患者的预后, 从而更好的指导临床.
本文选题新颖, 密切关注研究热点, 为临床发现、诊断和治疗大肠癌提供了新的思路和方法.
编辑: 田滢 电编:鲁亚静
| 1. | Shivakumar L, Minna J, Sakamaki T, Pestell R, White MA. The RASSF1A tumor suppressor blocks cell cycle progression and inhibits cyclin D1 accumulation. Mol Cell Biol. 2002;22:4309-4318. [PubMed] [DOI] |
| 2. | Vos MD, Ellis CA, Bell A, Birrer MJ, Clark GJ. Ras uses the novel tumor suppressor RASSF1 as an effector to mediate apoptosis. J Biol Chem. 2000;275:35669-35672. [PubMed] [DOI] |
| 3. | Deryugina EI, Soroceanu L, Strongin AY. Up-regulation of vascular endothelial growth factor by membrane-type 1 matrix metalloproteinase stimulates human glioma xenograft growth and angiogenesis. Cancer Res. 2002;62:580-588. [PubMed] |
| 4. | DeClerck YA, Mercurio AM, Stack MS, Chapman HA, Zutter MM, Muschel RJ, Raz A, Matrisian LM, Sloane BF, Noel A. Proteases, extracellular matrix, and cancer: a workshop of the path B study section. Am J Pathol. 2004;164:1131-1139. [PubMed] [DOI] |
| 5. | Qi JH, Anand-Apte B. Tissue inhibitor of metalloproteinase-3 (TIMP-3) suppresses VEGF receptor-2 mediated signaling independent of metalloproteinase inhibition. Invest Ophthalmol Vis Sci. 2002;43:2753-2761. |
| 6. | Takahashi T, Nakamura T, Hayashi A, Kamei M, Nakabayashi M, Okada AA, Tomita N, Kaneda Y, Tano Y. Inhibition of experimental choroidal neovascularization by overexpression of tissue inhibitor of metalloproteinases-3 in retinal pigment epithelium cells. Am J Ophthalmol. 2000;130:774-781. [PubMed] [DOI] |
| 7. | Murata T, Cui J, Taba KE, Oh JY, Spee C, Hinton DR, Ryan SJ. The possibility of gene therapy for the treatment of choroidal neovascularization. Ophthalmology. 2000;107:1364-1373. [PubMed] [DOI] |
| 8. | Mino N, Takenaka K, Sonobe M, Miyahara R, Yanagihara K, Otake Y, Wada H, Tanaka F. Expression of tissue inhibitor of metalloproteinase-3 (TIMP-3) and its prognostic significance in resected non-small cell lung cancer. J Surg Oncol. 2007;95:250-257. [PubMed] [DOI] |
| 9. | Mylona E, Magkou C, Giannopoulou I, Agrogiannis G, Markaki S, Keramopoulos A, Nakopoulou L. Expression of tissue inhibitor of matrix metalloproteinases (TIMP)-3 protein in invasive breast carcinoma: relation to tumor phenotype and clinical outcome. Breast Cancer Res. 2006;8:R57. [PubMed] [DOI] |
| 11. | Jones PA, Baylin SB. The fundamental role of epigenetic events in cancer. Nat Rev Genet. 2002;3:415-428. [PubMed] |
| 14. | 杨 杨, 赵 正东, 陈 楠楠, 李 岩, 张 开立, 孔 庆友, 孙 媛, 吴 茉莉, 刘 佳, 李 宏. 胃癌中TIMP3基因的甲基化与表达间的相关性分析. 临床军医杂志. 2009;37:878-881. |
| 16. | Burbee DG, Forgacs E, Zöchbauer-Müller S, Shivakumar L, Fong K, Gao B, Randle D, Kondo M, Virmani A, Bader S. Epigenetic inactivation of RASSF1A in lung and breast cancers and malignant phenotype suppression. J Natl Cancer Inst. 2001;93:691-699. [PubMed] [DOI] |
| 17. | Lo PH, Xie D, Chan KC, Xu FP, Kuzmin I, Lerman MI, Law S, Chua D, Sham J, Lung ML. Reduced expression of RASSF1A in esophageal and nasopharyngeal carcinomas significantly correlates with tumor stage. Cancer Lett. 2007;257:199-205. [PubMed] [DOI] |
| 18. | Li Y, Wei Q, Cao F, Cao X. Expression and promoter methylation of the RASSF1A gene in sporadic breast cancers in Chinese women. Oncol Rep. 2008;19:1149-1153. [PubMed] |
| 19. | Ortiz-Vega S, Khokhlatchev A, Nedwidek M, Zhang XF, Dammann R, Pfeifer GP, Avruch J. The putative tumor suppressor RASSF1A homodimerizes and heterodimerizes with the Ras-GTP binding protein Nore1. Oncogene. 2002;21:1381-1390. [PubMed] [DOI] |
| 21. | Dammann R, Li C, Yoon JH, Chin PL, Bates S, Pfeifer GP. Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus 3p21.3. Nat Genet. 2000;25:315-319. [PubMed] [DOI] |
| 22. | Toyooka S, Pass HI, Shivapurkar N, Fukuyama Y, Maruyama R, Toyooka KO, Gilcrease M, Farinas A, Minna JD, Gazdar AF. Aberrant methylation and simian virus 40 tag sequences in malignant mesothelioma. Cancer Res. 2001;61:5727-5730. [PubMed] |
| 23. | Kang GH, Lee S, Kim WH, Lee HW, Kim JC, Rhyu MG, Ro JY. Epstein-barr virus-positive gastric carcinoma demonstrates frequent aberrant methylation of multiple genes and constitutes CpG island methylator phenotype-positive gastric carcinoma. Am J Pathol. 2002;160:787-794. [PubMed] [DOI] |
| 24. | Dammann R, Schagdarsurengin U, Strunnikova M, Rastetter M, Seidel C, Liu L, Tommasi S, Pfeifer GP. Epigenetic inactivation of the Ras-association domain family 1 (RASSF1A) gene and its function in human carcinogenesis. Histol Histopathol. 2003;18:665-677. [PubMed] |
| 25. | Byun DS, Lee MG, Chae KS, Ryu BG, Chi SG. Frequent epigenetic inactivation of RASSF1A by aberrant promoter hypermethylation in human gastric adenocarcinoma. Cancer Res. 2001;61:7034-7038. [PubMed] |
| 27. | Zhong S, Yeo W, Tang MW, Wong N, Lai PB, Johnson PJ. Intensive hypermethylation of the CpG island of Ras association domain family 1A in hepatitis B virus-associated hepatocellular carcinomas. Clin Cancer Res. 2003;9:3376-3382. [PubMed] |