修回日期: 2012-08-17
接受日期: 2012-09-04
在线出版日期: 2012-09-28
目的: 探讨PDK1在胰腺癌中的表达及其与临床病理特征的关系.
方法: 对44例胰腺癌及其癌旁正常组织标本, 分别应用RT-PCR方法和Western blot方法检测其PDK1的mRNA和蛋白表达, 并和临床病理指标进行统计学分析.
结果: 经RT-PCR检测胰腺癌组织中PDK1表达水平明显高于癌旁正常组织(0.352006 vs 0.074887, P<0.01); Western blot检测发现72.727%(32/44)PDK1蛋白的表达癌组织中高于癌旁组织, 有统计学差异(P<0.01). PDK1在胰腺癌组织中的表达与患者性别、年龄、肿瘤大小和分化程度均无相关性(P>0.05), 而与T分期、淋巴结转移和TNM分期密切相关(P<0.05).
结论: PDK1在胰腺癌中表达上调, 可能与胰腺癌发生、发展及转移有关.
引文著录: 宋世铎, 周健, 朱东明, 赵华, 张子祥, 李德春. PDK1在胰腺癌中的表达及其临床意义. 世界华人消化杂志 2012; 20(27): 2632-2637
Revised: August 17, 2012
Accepted: September 4, 2012
Published online: September 28, 2012
AIM: To investigate the expression of PDK1 in human pancreatic cancer and to analyze its correlation with clinicopathological features of this pancreatic malignancy.
METHODS: The mRNA and protein expression of PDK1 was detected in 44 pancreatic cancer tissue samples and matched tumor-adjacent normal tissue samples by real-time quantitative PCR and Western blot, respectively. Then, the relationship between expression of PDK1 and clinicopathological features of pancreatic cancer was analyzed.
RESULTS: Real-time quantitative PCR revealed that PDK1 expression level in pancreatic cancer tissue was higher than that in the tumor-adjacent pancreatic tissue (0.352006 vs 0.074887, P < 0.05). Western blot analysis showed a higher positive rate of PDK1 protein expression in cancer tissue than in adjacent tissue. Expression of PDK1 had no significant correlation with gender, age, tumor size or differentiate type (all P > 0.05), but was related to T stage, lymph nodes metastasis and TNM stage (all P < 0.05).
CONCLUSION: Up-regulation of PDK1 expression in pancreatic cancer suggests that PDK1 may be involved in the carcinogenesis, development and metastasis of pancreatic cancer.
- Citation: Song SD, Zhou J, Zhu DM, Zhao H, Zhang ZX, Li DC. Clinical significance of expression of PDK1 in human pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(27): 2632-2637
- URL: https://www.wjgnet.com/1009-3079/full/v20/i27/2632.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i27.2632
在美国, 由癌症导致死亡的所有疾病中, 胰腺癌高居第4位. 2011年美国胰腺癌的新发病例为43 920人, 估计约33 390人死于胰腺癌, 每年发病人数和死亡人数几乎相等[1]. 进入21世纪, 我国胰腺癌的发病率逐年上升, 尤其在大城市中, 发病率上升明显[2], 上海是我国胰腺癌发病率最高的城市, 在2002-2006年间胰腺癌的标化发病率为6.22/10万, 已居世界中等发病水平, 尤其是65岁以上老年人的发病率已达到高发国家水平. 其中男性发病率为7.39/10万, 女性为5.14/10万, 占上海市男性发病的第8位, 女性的第7位, 男、女性发病率比为1.18:1已成为我国人口死亡的十大恶性肿瘤之一[3].
肿瘤的侵袭转移是导致肿瘤患者死亡的主要原因, 他是一个多步骤过程. 在肿瘤的发生和发展过程中, 常伴有多种细胞信号通路的异常改变, 如PI3K/Akt信号通路, 他影响一系列细胞过程和反应, 包括基因表达调控、细胞周期调控、细胞增殖及分化等[4-6]. 因此, 这条信号通路往往成为分子治疗的靶标. 3-磷酸肌醇依赖的激酶-1(3-phosphoinositide-dependent kinase 1, PDK1)作为Akt的上游基因, 对Akt和其他PI3K/Akt下游激酶的活性进行调节, 也就是说, PDK1可以通过PI3K/Akt信号通路, 调节细胞的一系列生物学反应[7].
目前关于PDK1在胰腺癌中作用的报道不多[8], 本文通过检测胰腺癌中PDK1的表达, 分析其与临床病理特征之间的联系, 探讨其在胰腺癌发生、发展和转移中的作用, 以评价PDK1在胰腺癌中的作用.
收集2008-01/2011-03我院普外科接受手术治疗的胰腺癌临床标本, 经术后病理确诊为胰腺癌的组织学标本共44例, 其中男30例, 女14例, 年龄41-80岁, 中位年龄61.5岁. 术前均未行放疗、化疗等治疗. 肿瘤位于胰头部33例, 胰体尾部11例. 组织病理类型的判断标准均参照2010年胰腺癌UICC/AJCC TNM分期系统, 其中低分化9例, 中分化34例, 高分化1例, 每例标本取距离癌组织2 cm以上组织定为癌旁组织. 手术切除标本立即置于液氮保存. RNA抽提试剂TRIzol购自美国Invitrogen公司. PDK1和β-actin引物购自生工生物工程(上海)有限公司, PDK1一抗购自Santa Cruz公司.
1.2.1 RNA的提取: 胰腺癌组织及癌旁组织总RNA的提取采用TRIzol试剂, 具体步骤严格参照试剂盒说明书进行. 提取的总RNA用焦碳酸二乙酯(diethylpyrocarbonate, DEPC)水溶解. 使用紫外分光光度仪(美国Beckman公司)测定RNA 260 nm及280 nm处的吸光度(A)值, 测定其浓度和纯度, 置于-80 ℃下冻存.
1.2.2 反转录反应: 以β-actin为内参, 逆转录反应分2步进行. (1)15 μL反应体系: 6随机引物2 μL, DEPC水9 μL, RNA 4 μL, 反应条件为: 70 ℃ 5 min, 4 ℃保存; (2)25 μL反应体系: 5×Buffer 8 μL, MMLV 1 μL, Rnasin 0.5 μL, dNTP 1.5 μL, DEPC水14 μL, 将(1)中产物加入(2)中, 总计40 μL反应体系, 反应条件: 37 ℃ 1 h, 95 ℃ 5 min, 4 ℃保存, 进行反转录反应.
1.2.3 实时荧光定量PCR反应: 25 μL反应体系: 10×Buffer(含Mg2+)2.5 μL, Mg2+ 0.5 μL, dNTP(2.5 μmol/L)2 μL, 上下游引物各0.5 μL, Taqman酶0.2 μL, 双蒸水14.8 μL, cDNA 4 μL, 总计25 μL; 扩增条件: 94 ℃变性5 min, 94 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸1 min, 35 cycles, 72 ℃ 7min, 4 ℃保存; 所有反应均设3个复孔. 记录每个反应管中的荧光信号到达所设定的阈值时所经历的循环数即CT值, 以β-actin为内参, 采用定量PCR中的相对定量法(RQ, relative quantitative)表示PDK1的表达量. RQ = 2-∆CT, 其中∆CT = CT目的-CT内参. 引物序列见表1.
| 基因名称 | 引物(5'→3') | 扩增片段(bp) | |
| PDK1 | 正向 | GTG TAG ATT AGA GGG ATG | 153 |
| NM_002610.3 | 反向 | AAG GAA TAG TGG GTT AGG | |
| β-actin | 正向 | CTC CAT CCT GGT CTC GCT GT | 268 |
| NM_001101.3 | 反向 | GCT GTC ACC TTC ACC GTT CC | |
1.2.4 Western blot检测PDK1蛋白表达: 提取总蛋白, 应用Bradford蛋白浓度试剂盒(碧云天)测定总蛋白浓度, 将定量后的蛋白质样品以每孔20 μg点样于SDS-PAGE凝胶上样孔中, 200 V电泳至溴酚蓝迁移到距分离胶底部0.5 cm处, 300 mA转膜70 min, 将转好的硝酸纤维素膜至于5%的脱脂奶粉中, 室温振荡封闭2 h, 然加入1:400 PDK1一抗, 4 ℃孵育过夜, TBS缓冲液漂洗3次, 每次10 min, 再加入二抗, 37 ℃于摇床孵育1 h, TBS缓冲液漂洗3次, 每次10 min, 化学发光显影, 胶片曝光, 结果用UVP扫描仪扫描成像.
统计学处理 由于不同组织标本PDK1表达呈非正态分布, 故本实验采用SPSS17.0统计软件的非参数Wilcoxon符号秩和检验(2组相关数据), Mann-Whiteney U检验(2组独立数据)和Kruskal-Wallis H(≥3组独立数据)进行统计学处理. PDK1的表达量以中位数和四分位间距表示, P<0.05为差异有统计学意义.
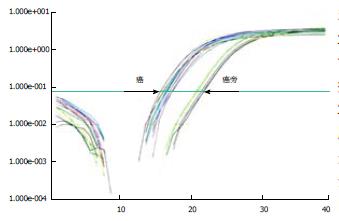
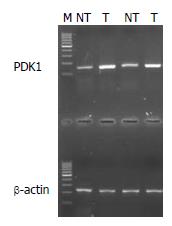
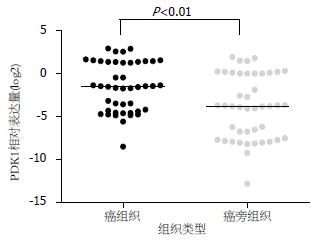
由PDK1的扩增曲线可见, 胰腺癌组织的CT值明显低于癌旁组织的CT值, 说明PDK1在胰腺癌中的表达高于癌旁组织, PDK1在癌组织中表达上调(图1). 通过PCR产物测序表明, PCR扩增产物与引物设计相吻合, 确为PDK1基因片段(图2). 随机选取PCR产物进行电泳, 无论是正常胰腺组织, 还是癌组织的cDNA中, 都扩增出大小为268 bp的β-actin片段, 而PDK1的扩增片段大小约为153 bp, 可见胰腺癌组织电泳条带灰度值高于癌旁组织(图3). 在44例胰腺癌组织中, 81.818%(36/44)PDK1 mRNA的表达癌组织中高于癌旁组织, 中位数分别为0.352 006和0.074 887, 两者比较有显著差异(P<0.01, 图4).
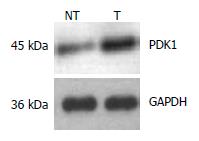
在44例胰腺癌组织中, 72.727%(32/44)PDK1蛋白的表达癌组织中高于癌旁组织, 有统计学差异(P<0.01, 图5).
PDK1的表达与年龄、性别、肿瘤大小及分化程度无关, 而与T分期、淋巴结是否转移和TNM分期有关. PDK1在不同TNM分期中表达差异具有统计学意义(P<0.01), 在不同T分期中, 其表达值分别为T1 0.002 817, T2 0.069 511, T3 0.386 436, 呈增高趋势; 在不同TNM分期中, 其表达值分别为ⅠA 0.002 817, ⅠB 0.052 584, ⅡA 0.374 724, ⅡB 2.691 481, 呈增高趋势(表2).
| 临床病理参数 | n | PDK1的相对表达量(中位数、四分位间距) | P值 |
| 年龄(岁) | 0.850 | ||
| ≤60 | 20 | 0.360 570(0.043 882-2.790 060) | |
| >60 | 24 | 0.324 094(0.049 525-2.499 176) | |
| 性别 | 0.364 | ||
| 男 | 30 | 0.360 570(0.041 515-2.506 862) | |
| 女 | 14 | 0.339 923(0.088 831-2.926 543) | |
| T分期 | <0.01 | ||
| T1 | 1 | 0.002 817 | |
| T2 | 22 | 0.069 511(0.040 094-2.545 810) | |
| T3 | 21 | 0.386 436(0.330 213-2.791 116) | |
| T4 | 0 | - | |
| 淋巴结转移 | <0.01 | ||
| 无 | 28 | 0.052 584(0.037 814-0.302 171) | |
| 有 | 16 | 2.691 481(2.506 862-5.099 311) | |
| TNM分期 | <0.01 | ||
| I | 16 | 0.052 584(0.037 814-0.302 171) | |
| IA | 1 | 0.002 817 | |
| IB | 15 | 0.052 584(0.037 814-0.30 2171) | |
| II | 28 | 2.375449(0.361215-2.826582) | |
| IIA | 12 | 0.374 724(0.338 144-1.950 012) | |
| IIB | 16 | 2.691 481(2.506 862-5.099 311) | |
| III | 0 | - | |
| IV | 0 | - | |
| 分化程度 | 0.078 | ||
| 低 | 9 | 0.723 417(0.090 277-6.535 805) | |
| 中 | 34 | 0.352 006(0.042 744-2.506 862) | |
| 高 | 1 | 0.021 027 |
由于胰腺癌早期症状不明显, 大多数病人诊断明确时已属于进展期或已出现远处转移, 预后极差. 大多数病人在确诊后12 mo内死亡, 很少有患者能存活5年以上.
研究发现, 胰腺癌的发生与基因突变的积累有关, 如癌基因KRAS2和抑癌基因INK4A、TP53、DPC4/Smad4和PTEN等[9-13]. PTEN是P13K信号传导途径一个重要的负性调控因子, PI3K/Akt/mTOR信号通路是目前最热门的癌症研究方向之一. 在肿瘤的发生和发展过程中, 常伴有多种细胞信号通路的异常改变, 如PI3K/Akt信号通路, 他影响一系列细胞过程和反应, 包括基因表达调控、细胞周期调控、细胞增殖及分化等[14]. 因此, 这条信号通路往往被作为分子治疗的靶标. Akt又称PKB, 即蛋白激酶B, 他是一种丝氨酸/苏氨酸蛋白激酶, 胰岛素等生长和存活因子都可以激活Akt信号途径. 活化的Akt参与调节其下游的多条路径, 包括MMP-2、IKK、Mdm2、P21和mTOR等, 从而促进细胞增殖、生长、抗凋亡以及迁移. Akt的Ser473可以被PDK1磷酸化. PI3K即磷脂酰肌醇-3激酶, PI3K-Akt信号途径是一条经典的信号途径, LY294002等PI3K的抑制剂抑制PI3K时, 即可抑制PIP3的生成, 阻断了Akt的活化. 另外, PDK1作为Akt的上游基因, 对Akt和其他PI3K/Akt下游激酶的活性进行调节, 也就是说, PDK1可以通过PI3K/Akt信号通路, 调节细胞的一系列生物学反应[15].
PDK1是一种63 kDa的丝氨酸/苏氨酸蛋白激酶, 包括N端的激酶结构域和C端的血小板-白细胞C激酶底物同源性结构域(PH domain). PDK1的PH域可以结合PI3K的产物三磷酸肌醇(PIP3), 使PDK1可以靶向胞膜并激活Akt[15]; 而其他不含有PH域或是不能靶向细胞膜的PDK1的底物也可以直接与PDK1结合并被活化. 另外, PDK1自身也可以通过二价聚合和交叉磷酸化被激活[16]. PDK1是一个63 kDa的丝氨酸/苏氨酸(Ser/Thr)蛋白激酶, 他是Akt的上游活化激酶[17]. PDK1可在磷酸化的Akt的Thr308位点使Akt的活性增加30倍以上. 但这种活化依赖PIP3或PIP2, PDK1也就因此而得名[18]. 作为细胞中很多重要信号通路的中心枢纽, PDK1广泛存在于人的很多组织中. 他在肿瘤细胞生长、细胞调亡的保护、刺激上皮细胞向间质转化(epithelial-mesenchymal transition, EMT)和肿瘤血管再生术等进程中起着关键的作用[8].
研究发现, 由PDK1介导的PI3K/Akt信号通路与多种癌症相关, 包括黑色素瘤、乳腺癌、肺癌、胃癌、前列腺癌、卵巢癌和胰腺癌[19], 大部分癌细胞中PDK1都是高表达的[20], 这与本研究的结果胰腺癌中PDK1表达高于配对的癌旁组织一致, 而抑制PDK1的活性可以促使癌细胞凋亡或抑制其增殖. 目前关于PDK1在胰腺癌中的相关研究较少. 本研究发现, PDK1在胰腺癌中的表达明显上调, 提示其在胰腺癌发生、发展中起到了癌基因的作用. 进一步深入研究发现, PDK1的表达水平与T分期有关, 由于本组病理均取自手术切除标本, 结合2010年胰腺癌UICC/AJCC TNM分期系统, 无T4期病例, 而T1期病例仅有1例, 考虑PDK1与T分期相关即与T2、T3有关, 即与肿瘤是否侵及周围组织密切相关; 而与淋巴结转移相关, 说明PDK1在胰腺癌转移中可能起作用; PDK1在不同TNM分期中表达差异有统计学意义, 且随着分期的增高, 其表达呈不断增高趋势, 说明PDK1可能与胰腺癌进展和转移有关.
总之, 胰腺癌组织中PDK1的表达上调, 通过PI3K/Akt/mTOR信号通路对胰腺癌的发生、发展及转移发生作用, 有可能成为胰腺癌治疗的新靶点, 但其在胰腺癌发生、发展、转移中的详细机制尚有待于进一步研究.
感谢岑建农、姚利、陈艳同志在本试验中给予的大力帮助.
3-磷酸肌醇依赖的激酶-1(PDK1)是Akt的上游活化激酶, 通过PI3K/Akt信号通路影响一系列细胞过程和反应, 包括基因表达调控、细胞周期调控、细胞增殖及分化等.
李淑德, 教授, 中国人民解放军第二军医大学长海医院消化内科
PI3K/Akt/mTOR信号通路是目前热门的癌症研究话题之一, PDK1是其中重要激酶, 但关于PDK1在胰腺癌中的研究报道较少.
Westmoreland等报道了PDK1在胰腺癌细胞增殖、生长中的作用; Raimondi做了关于PDK1在肿瘤中作用的综述.
本文探讨PDK1在胰腺癌组织中的表达情况及其与胰腺癌临床病理特征的关系, 为胰腺癌治疗提供新的潜在靶点.
关于PDK1和胰腺癌的相互关系研究, 探讨PDK1可能通过PI3K/Akt信号通路起作用, 而未来可能应用PDK1抑制剂对胰腺癌治疗产生一定作用.
本文探讨PDK1在胰腺癌中的表达, 并分析该表达与临床生物学行为的关系, 有一定临床意义.
编辑: 田滢 电编:鲁亚静
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 3. | 顾 凯, 吴 春晓, 鲍 萍萍, 王 春芳, 彭 鹏, 龚 杨明, 向 詠梅, 黄 哲宙, 金 凡, 郑 莹. 上海市胰腺癌流行现况、回顾与比较分析. 外科理论与实践. 2009;14:510-515. |
| 4. | Haga S, Ozaki M, Inoue H, Okamoto Y, Ogawa W, Takeda K, Akira S, Todo S. The survival pathways phosphatidylinositol-3 kinase (PI3-K)/phosphoinositide-dependent protein kinase 1 (PDK1)/Akt modulate liver regeneration through hepatocyte size rather than proliferation. Hepatology. 2009;49:204-214. [PubMed] [DOI] |
| 5. | Patsoukis N, Brown J, Petkova V, Liu F, Li L, Boussiotis VA. Selective effects of PD-1 on Akt and Ras pathways regulate molecular components of the cell cycle and inhibit T cell proliferation. Sci Signal. 2012;5:ra46. [PubMed] [DOI] |
| 6. | Limon JJ, Fruman DA. Akt and mTOR in B Cell Activation and Differentiation. Front Immunol. 2012;3:228. [PubMed] |
| 7. | Matheny RW, Adamo ML. Current perspectives on Akt Akt-ivation and Akt-ions. Exp Biol Med (Maywood). 2009;234:1264-1270. [PubMed] [DOI] |
| 8. | Westmoreland JJ, Wang Q, Bouzaffour M, Baker SJ, Sosa-Pineda B. Pdk1 activity controls proliferation, survival, and growth of developing pancreatic cells. Dev Biol. 2009;334:285-298. [PubMed] [DOI] |
| 9. | Shi C, Hong SM, Lim P, Kamiyama H, Khan M, Anders RA, Goggins M, Hruban RH, Eshleman JR. KRAS2 mutations in human pancreatic acinar-ductal metaplastic lesions are limited to those with PanIN: implications for the human pancreatic cancer cell of origin. Mol Cancer Res. 2009;7:230-236. [PubMed] [DOI] |
| 10. | Ali S, Banerjee S, Logna F, Bao B, Philip PA, Korc M, Sarkar FH. Inactivation of Ink4a/Arf leads to deregulated expression of miRNAs in K-Ras transgenic mouse model of pancreatic cancer. J Cell Physiol. 2012;227:3373-3380. [PubMed] [DOI] |
| 12. | Hao J, Zhang S, Zhou Y, Liu C, Hu X, Shao C. MicroRNA 421 suppresses DPC4/Smad4 in pancreatic cancer. Biochem Biophys Res Commun. 2011;406:552-557. [PubMed] [DOI] |
| 13. | Ma J, Sawai H, Ochi N, Matsuo Y, Xu D, Yasuda A, Takahashi H, Wakasugi T, Takeyama H. PTEN regulates angiogenesis through PI3K/Akt/VEGF signaling pathway in human pancreatic cancer cells. Mol Cell Biochem. 2009;331:161-171. [PubMed] [DOI] |
| 14. | 于 婧, 陈 奎生, 李 亚南, 杨 娟, 赵 路. RNA干扰抑制食管癌EC9706细胞中3-磷酸肌醇依赖性蛋白激酶1基因的表达及其对肿瘤细胞恶性生物学行为的影响. 中华肿瘤杂志. 2011;33:410-414. |
| 15. | Bayascas JR. PDK1: the major transducer of PI 3-kinase actions. Curr Top Microbiol Immunol. 2010;346:9-29. [PubMed] [DOI] |
| 16. | Ding Z, Liang J, Li J, Lu Y, Ariyaratna V, Lu Z, Davies MA, Westwick JK, Mills GB. Physical association of PDK1 with AKT1 is sufficient for pathway activation independent of membrane localization and phosphatidylinositol 3 kinase. PLoS One. 2010;5:e9910. [PubMed] [DOI] |
| 17. | Poulsen A, Blanchard S, Soh CK, Lee C, Williams M, Wang H, Dymock B. Structure-based design of PDK1 inhibitors. Bioorg Med Chem Lett. 2012;22:305-307. [PubMed] [DOI] |
| 18. | Vanhaesebroeck B, Alessi DR. The PI3K-PDK1 connection: more than just a road to PKB. Biochem J. 2000;346 Pt 3:561-576. [PubMed] [DOI] |
| 19. | Raimondi C, Falasca M. Targeting PDK1 in cancer. Curr Med Chem. 2011;18:2763-2769. [PubMed] [DOI] |
| 20. | AbdulHameed MD, Hamza A, Liu J, Zhan CG. Combined 3D-QSAR modeling and molecular docking study on indolinone derivatives as inhibitors of 3-phosphoinositide-dependent protein kinase-1. J Chem Inf Model. 2008;48:1760-1772. [PubMed] [DOI] |