修回日期: 2012-08-08
接受日期: 2012-09-04
在线出版日期: 2012-09-28
目的: 探讨血清腹水白蛋白梯度(serum-ascites albumin gradient, SAAG)与肝硬化食管静脉曲张程度之间的相关性.
方法: 收集诊断明确的肝硬化合并腹水患者, 根据食管静脉曲张程度分为无或轻度组、中度组和重度组, 采用单因素方差分析、相关分析、构建受试者工作特征曲线(receiver operating characteristic, ROC)曲线等方法进行统计学分析.
结果: 共纳入43例患者, 单因素方差分析显示3组之间存在显著差异(F = 26.317, P<0.001), Spearman相关系数r = 0.759,P<0.001, 提示SAAG与食管静脉曲张具有正向相关性. 构建ROC曲线得到曲线下面积为0.926, 当SAAG取值为20.5 g/L时是诊断中重度食管静脉曲张的最佳界值, 此时敏感度为87.1%, 特异度为83.3%.
结论: SAAG与食管静脉曲张具有较好的相关关系, 该指标对于中重度食管静脉曲张具有诊断价值.
引文著录: 张辉, 高春, 房龙, 赵洪川, 姚树坤. 血清腹水白蛋白梯度与肝硬化食管静脉曲张程度的相关性. 世界华人消化杂志 2012; 20(27): 2608-2612
Revised: August 8, 2012
Accepted: September 4, 2012
Published online: September 28, 2012
AIM: To explore the correlation between serum-ascites albumin gradient (SAAG) and the degree of esophageal varices in patients with liver cirrhosis.
METHODS: Cirrhotic patients with ascites were collected and divided into three groups according to the degree of esophageal varices: mild group, moderate group and severe group. One-way ANOVA, correlation analysis and receiver operating characteristic (ROC) curve were used for statistical analysis.
RESULTS: A total of 43 cirrhotic patients were included in our study. One-way ANOVA indicated a significant difference in SAAG among the three groups (F = 26.317, P < 0.001). Spearman correlation analysis suggested a positive correlation between SAAG and esophageal varices (r = 0.759, P < 0. 001). ROC curve analysis indicated that the area under the ROC curve was 0.926, and the best cut-off value for diagnosis of moderate and severe esophageal varices was 20.5 g/L, with a sensitivity of 87.1% and a specificity of 83.3%.
CONCLUSION: SAAG is correlated well with the degree of esophageal varices in cirrhotic patients, and this parameter has appreciable value in diagnosis of moderate and severe esophageal varices.
- Citation: Zhang H, Gao C, Fang L, Zhao HC, Yao SK. Correlation between serum-ascites albumin gradient and degree of esophageal varices in patients with hepatic cirrhosis. Shijie Huaren Xiaohua Zazhi 2012; 20(27): 2608-2612
- URL: https://www.wjgnet.com/1009-3079/full/v20/i27/2608.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i27.2608
食管胃静脉曲张破裂出血是肝硬化最常见的致命性并发症, 近期死亡率超过20%[1,2]. 食管胃静脉曲张可见于50%的肝硬化患者, 其引起出血的年发生率为5%-15%[3], 其中大的静脉曲张出血风险最高[4]. 国内外相关指南推荐采用胃镜对食管胃静脉曲张进行筛查[3,5], 并根据静脉曲张的严重程度采取不同的预防措施. 但是内镜检查费用相对昂贵, 且为侵入性检查, 常造成患者各种不适, 甚至有的患者因为恐惧心理而拒绝检查. 因此, 有学者尝试采用其他替代指标来诊断或预测食管胃静脉曲张的程度或出血风险, 如血小板计数、脾脏大小、门脉内径、血小板计数/脾长径比值等[6,7], 但是这些指标的价值存在争议. 本研究通过分析血清腹水白蛋白梯度(serum ascites albumin gradient, SAAG)与肝硬化食管静脉曲张严重程度的关系, 评价SAAG对食管静脉曲张的诊断价值.
收集2007-01/2011-12就诊于卫生部中日友好医院的住院患者, 按下列纳入及排除标准选择研究对象. 纳入标准: (1)明确诊断为肝硬化并且合并腹水; (2)住院期间行腹腔穿刺术并行腹水白蛋白及同日血清白蛋白检查; (3)住院期间行胃镜和/或上消化道造影检查. 排除标准: (1)既往曾接受内镜下套扎或硬化治疗; (2)正在服用β受体阻滞剂; (3)处于食管胃底静脉曲张破裂出血活动期; (4)临床资料不完整.
1.2.1 诊断及分级标准: 肝硬化主要基于临床诊断: 至少两种影像学检查具有典型的肝硬化征象(包括超声、增强CT和核磁共振)或一种影像学检查具有典型的肝硬化征象并伴有肝功能失代偿及门脉高压表[8]. 按照Child-Pugh分级标准将肝硬化分为A级、B级和C级. 食管静脉曲张主要诊断依据为胃镜检查, 少部分采取上消化道造影检查. 按照我国2003年发布的《食管胃静脉曲张内镜下诊断和治疗规范试行方案》对食管静脉曲张程度进行分级. 轻度: 食管静脉曲张呈直线形或略有迂曲, 无红色征; 中度: 食管静脉曲张呈直线形或略有迂曲, 有红色征或食管静脉曲张呈蛇形迂曲隆起但无红色征; 重度: 食管静脉曲张呈蛇形迂曲隆起且有红色征或食管静脉曲张呈串珠状、结节状或瘤状(不论是否有红色征)[9]. 上消化道造影仅用于诊断无静脉曲张和重度静脉曲张(静脉曲张呈串珠状、结节状改变), 以保证诊断的准确性.
1.2.2 资料收集与分组: 收集纳入患者的性别、年龄、肝硬化病因、是否合并肝癌、是否合并高血压病和糖尿病、Child-Pugh分级、SAAG值及胃镜和/或上消化道造影等资料并整理成表格. SAAG值为血清白蛋白浓度减去同日腹水白蛋白浓度. 根据食管静脉曲张程度将所有患者分为无或轻度组、中度组和重度组.
统计学处理 对3组患者的SAAG值进行正态性检验, 以mean±SD表示. 采用Levene检验进行方差齐性检验, 在各组方差齐的情况下进行单因素方差分析(one-way ANOVA), 采用Hochberg's GT2法对各组数据进行两两比较, 并进行趋势检验; 采用Spearman相关分析估计SAAG与食管静脉曲张严重程度的相关性及方向; 最后根据2008年《肝硬化门静脉高压食管胃静脉曲张出血的防治共识》(以下简称"杭州共识")中对食管胃静脉曲张一级预防的建议, 将上述3组数据合并为无或轻度组和中重度组两组, 构建受试者工作特征(receiver operating characteristic, ROC)曲线, 并获取诊断中重度食管静脉曲张的SAAG的最佳界值. 本研究中如未特殊说明均认为P<0.05具有统计学差异, 统计学分析采用SPSS17.0软件包(SPSS, 芝加哥, 伊利诺伊州, 美国).
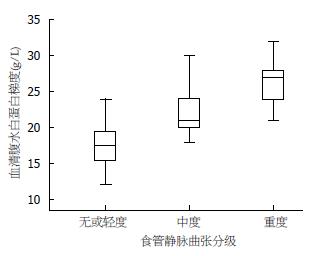
共纳入肝硬化伴腹水患者43例, 其中男31例, 女12例, 年龄59.6岁±11.8岁; 乙肝肝硬化18例, 丙肝肝硬化2例, 酒精性肝硬化9例, 其他原因肝硬化14例; 7例患者合并原发性肝癌, 14例患者合并高血压病, 17例患者合并糖尿病; Child-Pugh A级1例, Child-Pugh B级24例, Child-Pugh C级18例; 33例通过胃镜诊断, 10例通过上消化道造影诊断. 无或轻度组12例, 年龄62.42岁±9.6岁, SAAG为17.7 g/L±3.3 g/L; 中度组9例, 年龄61.1岁±13.2岁, SAAG为21.9 g/L±3.7 g/L; 重度组为22例, 年龄57.4岁±12.5岁, SAAG为26.2 g/L±3.2g/L(表1, 图1).
| 全部(n = 43) | 无或轻度组(n = 12) | 中度组(n = 9) | 重度组(n = 22) | |
| 男性n(%) | 31(72.1) | 7(58.3) | 7(77.8) | 17(77.3) |
| 年龄(岁) | 59.6±11.8 | 62.42±9.6 | 61.1±13.2 | 57.4±12.5 |
| 肝硬化病因n(%) | ||||
| 乙肝肝硬化 | 18(41.9) | 0(0) | 5(55.6) | 13(59.1) |
| 丙肝肝硬化 | 2(4.7) | 1(8.3) | 0(0) | 1(4.5) |
| 酒精性肝硬化 | 9(20.9) | 4(33.3) | 3(33.3) | 2(9.1) |
| 其他原因 | 14(32.6) | 7(58.3) | 1(11.1) | 6(27.3) |
| 合并原发性肝癌 | 7(16.3) | 0(0) | 3(33.3) | 4(18.2) |
| 合并高血压病 | 14(32.6) | 5(41.7) | 2(22.2) | 7(31.8) |
| 合并糖尿病 | 17(39.5) | 4(33.3) | 2(22.2) | 11(50) |
| Child-Pugh分级n(%) | ||||
| A级 | 1(2.3) | 0(0) | 0(0) | 1(4.5) |
| B级 | 24(55.8) | 8(66.7) | 5(55.6) | 11(50) |
| C级 | 18(41.9) | 4(33.3) | 4(44.4) | 10(45.5) |
| 血清腹水白蛋白梯度(g/L) | 22.9±4.9 | 17.7±3.3 | 21.9±3.7 | 26.2±3.2 |
正态性检验提示3组数据均符合正态分布, 方差齐性检验提示3组数据方差齐(P = 0.959). 单因素方差分析得出F = 26.317, P<0.001, 因此可认为3组间SAAG存在差异. 各组数据间的两两比较, 提示SAAG在各组之间的差异均具有统计学意义(表2). 趋势检验的线性部分F = 51.554, P<0.001, 有统计学意义.
| 食管静脉曲张分级(1) | 食管静脉曲张分级(2) | 均值差(1-2) | 标准误 | P值 |
| 中度 | 无或轻度 | 4.222 | 1.457 | 0.018 |
| 重度 | 中度 | 4.293 | 1.308 | 0.006 |
| 重度 | 无或轻度 | 8.515 | 1.186 | <0.001 |
采用Spearman相关系数分析SAAG与食管静脉曲张是否存在线性关系及方向. 结果显示Spearman相关系数r = 0.759, P<0.001(P为0.01时认为相关性为显著的), 提示两者存在正向线性相关关系.
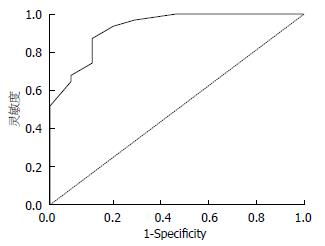
将上述3组数据合并为无或轻度组和中重度组两组. 以1-特异度为横坐标, 以敏感度为纵坐标构建ROC曲线(图2), 所得曲线下面积为0.926, 按>0.9为标准, 提示SAAG对于中重度食管静脉曲张的诊断价值较高. 当取值为20.5 g/L时具有最佳的敏感度和特异度, 此时SAAG诊断中重度食管静脉曲张的敏感度为87.1%, 特异度为83.3%, 阳性预测值为93.1%, 阴性预测值为71.4%, 正确率为86%. 如果SAAG取值为17.5 g/L, 敏感度为100%, 但特异度降为50%; 如果SAAG取值为24.5 g/L, 特异度为100%, 但敏感度降为51.6%.
门脉高压是肝硬化患者发生食管胃静脉曲张的直接原因, 临床上常通过测量肝静脉压力梯度(hepatic venous pressure gradient, HVPG)来反映门静脉压力, HVPG>10 mmHg是是否发生静脉曲张的最强预测因子[10]. 决定食管胃静脉曲张发生破裂出血的主要因素是曲张静脉的管壁张力, 管壁张力主要与血管管径和HVPG有关[3]. HVPG的测量技术要求高且为有创性, 临床应用受限. 因此胃镜下观察静脉曲张的大小和反映管壁张力的红色征是预测食管胃静脉曲张出血的重要手段. 但是胃镜也有费用高和耐受性差等缺点, 部分患者存在胃镜检查的禁忌症, 因此寻找其他相对便宜、创伤性小、方便的诊断指标具有重要的意义, 可以避免不必要的胃镜检查. 近年来在多种无创性的预测指标中, 血小板计数/脾长径比值被认为是最有价值的[11,12], 但是脾长径的测量准确性受超声医生技术的影响, 血小板计数和脾脏大小又受多种因素影响, 其预测价值也受到质疑[13].
SAAG是Hoefs于1978年首先提出的一个概念并逐渐得到医学界的认可, 以11 g/L为界值, 其预测门脉高压的准确性高达97%[14]. 根据Starling理论, 门脉高压导致的流体静水压的升高需要由血浆胶体渗透压来平衡, 而血浆胶体渗透压主要是由白蛋白提供的. 因此, SAAG的大小反映了门静脉压力的高低并有可能成为预测食管胃静脉曲张严重程度的理想指标, 已有研究显示其对食管静脉曲张的出血风险具有较好的预测价值[15].
我们的研究显示在3组不同严重程度的食管静脉曲张中, SAAG在各组之间具有显著差异, 静脉曲张越严重的组的SAAG越高. 趋势检验和进一步的相关分析得出SAAG与静脉曲张的严重程度呈正向线性相关关系, 提示SAAG可能对食管静脉曲张程度具有一定的诊断价值.
我国的"杭州标准"建议在食管静脉曲张出血的一级预防中根据胃镜下表现将静脉曲张分为无或轻度静脉曲张和中度、重度的静脉曲张或出血风险较大的轻度静脉曲张两种情况, 对于前者建议每2-3年进行一次胃镜检查, 而对于后者需要采取预防性治疗措施, 如非选择性β受体阻滞剂或内镜套扎. 因此我们将静脉曲张分为无或轻度组和中重度组来构建ROC曲线并获取最佳界值, 以利于指导临床. 本研究得出ROC曲线下面积>0.9, 提示该指标对中重度食管静脉曲张具有较好的诊断价值, 当SAAG取值20.5 g/L时具有最佳的敏感度和特异度. Demirel等[16]的研究提示SAAG>20 g/L的酒精性肝硬化患者均出现食管静脉曲张, 与我们的结论相似.
作为临床研究, 本研究存在部分局限性. 首先, 纳入的病例数偏少, 可能会降低统计学上的把握度, 同时也可能使基线资料不能完全反映出患者的临床特点. 表面上看, 本研究中食管静脉曲张程度(肝硬化)越重的组, 患者越年轻, 这似乎与我们的认识存在矛盾. 但我们对3组患者的年龄进行了单因素方差分析, 发现3组数据在统计学上并无差异(F = 0.765, P = 0.472), 3组数据两两比较也无统计学差异. 因此, 上述年龄的相关问题可能不会对最终的结果产生过多的影响. 同样, 我们也希望研究结果能够在更多的人群中得到进一步的验证; 其次, 本研究中部分病例的诊断采用的是上消化道造影, 这在一定程度上影响诊断的准确性. 上消化造影无法确定是否存在红色征, 因此我们舍弃了部分病例以尽量保证诊断准确, 这也是本研究纳入样本量较少的重要原因; 最后, 本研究是一项横断面研究, 虽然结果提示食管静脉曲张程度与SAAG具有较好的相关性, 但二者之间的因果关系尚难确定.
总之, 我们的研究提示SAAG是诊断食管静脉曲张较好的替代指标, 对于SAAG>20.5 g/L的肝硬化合并腹水的患者应引起临床重视, 及早采取预防性治疗措施. 当然, 本研究的结论尚需要更多大样本的研究尤其是前瞻性的研究进一步证实.
食管胃静脉曲张破裂出血是肝硬化最常见的致命性并发症. 国内外相关指南推荐采用胃镜对食管胃静脉曲张进行筛查. 但是内镜检查费用相对昂贵, 且为侵入性检查, 常造成患者各种不适, 部分患者不适合胃镜检查.
竺亚斌, 研究员, 宁波大学医学院人体解剖与组胚学系
有学者尝试采用其他替代指标来诊断或预测食管胃静脉曲张的程度或出血风险, 如血小板数、脾脏大小、门脉内径、血小板计数/脾长径比值等. 但是这些指标的价值存在争议.
部分国内外学者尝试利用血清腹水白蛋白梯度(SAAG)来预测食管静脉曲张的出现或发生出血的风险.
本研究分析SAAG与肝硬化食管静脉曲张严重程度的关系, 得出通过SAAG诊断中重度的食管静脉曲张的最佳界值. 该研究结合国内相关指南, 符合我国的国情, 可操作性强, 具有一定的临床应用价值.
本研究得出的结论提示, SAAG与食管静脉曲张程度有较好的相关性, 对中重度静脉曲张诊断价值较高. SAAG检查便宜, 创伤性小, 技术要求不高, 对部分患者可以避免不必要的胃镜检查. 本研究的结论尚需要大样本前瞻性研究证实.
受试者工作特征曲线(ROC曲线): 在诊断试验评价中, 以1-特异度为横坐标, 灵敏度为纵坐标, 将坐标为(1-特异度, 灵敏度)的数据点描绘于平面直角坐标系所得到的曲线. ROC曲线及ROC曲线下面积可作为某一诊断方法准确性评价的指标.
本研究具有一定的科学性、创新性和可读性, 全文条理较清楚, 论点较明确.
编辑: 田滢 电编:鲁亚静
| 1. | D'Amico G, De Franchis R. Upper digestive bleeding in cirrhosis. Post-therapeutic outcome and prognostic indicators. Hepatology. 2003;38:599-612. [PubMed] [DOI] |
| 2. | Carbonell N, Pauwels A, Serfaty L, Fourdan O, Lévy VG, Poupon R. Improved survival after variceal bleeding in patients with cirrhosis over the past two decades. Hepatology. 2004;40:652-659. [PubMed] [DOI] |
| 3. | Garcia-Tsao G, Sanyal AJ, Grace ND, Carey W. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology. 2007;46:922-938. [PubMed] [DOI] |
| 4. | The North Italian Endoscopic Club for the Study and Treatment of Esophageal Varices. Prediction of the first variceal hemorrhage in patients with cirrhosis of the liver and esophageal varices. A prospective multicenter study. N Engl J Med. 1988;319:983-989. [PubMed] [DOI] |
| 6. | Sharma SK, Aggarwal R. Prediction of large esophageal varices in patients with cirrhosis of the liver using clinical, laboratory and imaging parameters. J Gastroenterol Hepatol. 2007;22:1909-1915. [PubMed] [DOI] |
| 7. | Sarangapani A, Shanmugam C, Kalyanasundaram M, Rangachari B, Thangavelu P, Subbarayan JK. Noninvasive prediction of large esophageal varices in chronic liver disease patients. Saudi J Gastroenterol. 2010;16:38-42. [PubMed] [DOI] |
| 10. | Groszmann RJ, Garcia-Tsao G, Bosch J, Grace ND, Burroughs AK, Planas R, Escorsell A, Garcia-Pagan JC, Patch D, Matloff DS. Beta-blockers to prevent gastroesophageal varices in patients with cirrhosis. N Engl J Med. 2005;353:2254-2261. [PubMed] [DOI] |
| 11. | Giannini E, Botta F, Borro P, Risso D, Romagnoli P, Fasoli A, Mele MR, Testa E, Mansi C, Savarino V. Platelet count/spleen diameter ratio: proposal and validation of a non-invasive parameter to predict the presence of oesophageal varices in patients with liver cirrhosis. Gut. 2003;52:1200-1205. [PubMed] [DOI] |
| 12. | Testa R, Testa E, Giannini E, Borro P, Milazzo S, Isola L, Ceppa P, Lantieri PB, Risso D. Noninvasive ratio indexes to evaluate fibrosis staging in chronic hepatitis C: role of platelet count/spleen diameter ratio index. J Intern Med. 2006;260:142-150. [PubMed] [DOI] |
| 13. | Mangone M, Moretti A, Alivernini F, Papi C, Orefice R, Dezi A, Amadei E, Aratari A, Bianchi M, Tornatore V. Platelet count/spleen diameter ratio for non-invasive diagnosis of oesophageal varices: is it useful in compensated cirrhosis? Dig Liver Dis. 2012;44:504-507. [PubMed] [DOI] |
| 14. | Runyon BA, Montano AA, Akriviadis EA, Antillon MR, Irving MA, McHutchison JG. The serum-ascites albumin gradient is superior to the exudate-transudate concept in the differential diagnosis of ascites. Ann Intern Med. 1992;117:215-220. [PubMed] |
| 16. | Demirel U, Karincaoğlu M, Harputluoğlu M, Ateş M, Seçkin Y, Yildirim B, Hilmioğlu F. Two findings of portal hypertension: evaluation of correlation between serum-ascites albumin gradient and esophageal varices in non-alcoholic cirrhosis. Turk J Gastroenterol. 2003;14:219-222. [PubMed] |