修回日期: 2012-08-16
接受日期: 2012-09-03
在线出版日期: 2012-09-28
目的: 探讨HLA-DRB1*09/12/15等位基因频率与广西乙型肝炎病毒(hepatitis B virus, HBV)相关性肝病病情的关系.
方法: 应用聚合酶链反应-序列特异性引物(polymerase chain reaction-sequence specific primer, PCR-SSP)技术对64例慢性无症状HBV携带者(asymptomatic chronic hepatitis B, ASC)组、80例慢性乙型肝炎(chronic hepatitis B, CHB)组、65例乙肝肝硬化(liver cirrhosis, LC)组、56例乙肝肝细胞癌(hepatocellular carcinoma, HCC)组以及75例正常对照(NC)组的HLA-DRB1*09/12/15等位基因进行检测, 分析其表达频率与慢乙肝病情的相关性.
结果: 乙肝肝硬化组HLA-DRB1*15等位基因的携带率(10.8%), 较NC组(34.7%)、ASC组(39.1%)、HCC组(33.9%)、CHB组(33.8%)明显减低, 差异具有统计学意义(P<0.01), 其余各组两两比较均无统计学差异; HLA-DRB1*09/12在各组间的分布均无统计学差异.
结论: HLA-DRB1*15等位基因携带者感染HBV后可能降低乙肝肝硬化发生的风险, HLA-DRB1*15可能是广西乙肝肝硬化的抵抗基因.
引文著录: 韦柯利, 陈务卿, 吴继周, 吴健林, 宁秋月, 李红玉. HLA-DRB1*09/12/15与广西HBV相关性肝病的关系. 世界华人消化杂志 2012; 20(27): 2570-2575
Revised: August 16, 2012
Accepted: September 3, 2012
Published online: September 28, 2012
AIM: To assess the relationship between leukocyte antigen (HLA)-DRB1 alleles and HBV-related hepatic diseases in Guangxi.
METHODS: Polymerase chain reaction-sequence specific primer (PCR-SSP) method was used to determine the frequencies of HLA-DRB1* 09/12/15 alleles in 64 patients with asymptomatic chronic hepatitis B (ASC), 80 patients with chronic hepatitis B (CHB), 65 patients with liver cirrhosis (LC), 56 patients with hepatocellular carcinoma (HCC), and 75 healthy controls from Guangxi Province, China.
RESULTS: The frequency of the HLA-DRB1* 15 allele differed significantly among the five groups of subjects (P < 0.05), while the frequencies of the other alleles showed no significant differences (all P > 0.05). The frequency of the HLA-DRB1* 15 allele in patients with LC (10.8%) was significantly lower than those in patients with NC (34.7%), ASC (39.1%), HCC (33.9%), or CHB (33.8%) (all P < 0.01), but showed no significant difference between patients in the other four groups (all P > 0.05).
CONCLUSION: The lack of the expression of HLA-DRB1*15 gene might associate with a higher risk for the development of LC in patients with HBV infection.
- Citation: Wei KL, Chen WQ, Wu JZ, Wu JL, Ning QY, Li HY. Association between HLA-DRB1* 09/12/15 alleles and HBV-related hepatic diseases. Shijie Huaren Xiaohua Zazhi 2012; 20(27): 2570-2575
- URL: https://www.wjgnet.com/1009-3079/full/v20/i27/2570.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i27.2570
人类对乙型肝炎病毒(hepatitis B virus, HBV)普遍易感, 目前我国至少有9 300万HBV携带者, 约2 000万乙肝患者, 每年死于与乙肝相关肝病的约30万例, 严重威胁人们的健康[1]. HBV慢性感染者有不同的临床转归, 如慢性无症状携带者、慢性肝炎、肝硬化甚至肝癌, 虽与感染年龄、宿主性别年龄、HBV基因型等有关, 但主要取决于个体的免疫反应状况, 而人类白细胞抗原(human leukocyte antigen, HLA)复合体的基因多态性是决定宿主免疫应答能力最重要的遗传因素, 其中HLA-DRB1基因多态性最复杂, 与机体免疫应答紧密关联[2,3]. 广西地区是我国乙型病毒性肝炎的高发区[4], 而且广西是以壮、汉族为主的少数民族杂居地区, 其独特的遗传背景可能影响乙肝易感性及病情转归, 我们的前期研究已发现肝癌的家庭聚集性与HBV感染及遗传易感因素密切相关[5-7], 但尚未系统性研究HLA-DRB1*09/12/15等位基因对乙肝相关性系列肝病的影响. 本研究应用聚合酶链反应-序列特异性引物(polymerase chain reaction-sequence specific primer, PCR-SSP)技术检测广西地区HBV感染相关性肝病患者HLA-DRB1*09/12/15等位基因的表达, 以分析其与广西地区慢乙肝病情转归的相关性.
选择2009-10/2011-11在广西医科大学第一附属医院感染性疾病科及肿瘤医院肝胆外科诊治的HBV慢性感染者265例(壮族196例, 汉族65例, 瑶族4例), 包括慢性无症状乙肝病毒携带者(asymptomatic chronic hepatitis B, ASC)64例, 男42例, 女22例, 平均年龄33.1岁±12.2岁; 慢性乙型肝炎(chronic hepatitis B, CHB)80例, 男55例, 女25例, 平均年龄34.7岁±13.1岁; 乙肝肝硬化(liver cirrhosis, LC)65例, 男51例, 女14例, 平均年龄42.2岁±14.6岁, 其中失代偿肝硬化31例; 乙肝肝细胞癌(hepatocellular carcinoma, HCC)56例, 男43例, 女13例, 平均年龄44.9岁±12.1岁. 所有病例诊断均符合2005年中华医学会慢性乙型肝炎防治指南的诊断标准[8], 肝癌病人均经病理证实且HBsAg阳性; 排除标准: 筛选前曾抗病毒治疗患者, 其他肝炎病毒、血吸虫或HIV感染者, 自身免疫性疾病及酒精性、药物性肝病患者. 随机选取我院体检健康者75例为正常对照组(NC), 壮族55例, 汉族18例, 瑶族2例, 男48例, 女27例, 平均年龄38.0岁±16.3岁, 既往无肝脏疾病、肝炎病毒标志物均为阴性、肝功能和肝脏B超检查均无异常. 所有研究对象均为广西原籍人口, 且无血缘关系, 各组间年龄、性别及民族差异经均衡性检验无统计学差异, 具可比性.
1.2.1 外周血细胞DNA提取: 抽取受检者外周静脉血2 mL置于EDTA抗凝管中, 使用天根TIANGEN生化科技有限公司血液基因组DNA提取试剂盒, 按步骤提取全血DNA, 经NanoDrop 2000(美国Thermo)和电泳检测所提取的DNA, 选取纯度A260/A280值在1.6-1.8之间, 同时电泳条带单一、清晰, 无杂质的DNA样品, 调整DNA浓度为30-50 mg/L, 保存于-20 ℃备用.
1.2.2 引物制备: 参照Bunce等[9]的文献设计HLA-DRB1*09/12/15等位基因的特异性引物序列(表1), 以人生长因子(human growth hormone, HGH)基因片段作为内参照来检测PCR反应体系是否正常, 引物序列由上海生工生物工程技术公司合成.
| 基因 | 引物序列(上游/下游, 5'-3') | 引物长度(bp) | 目的片段(bp) |
| HLA-DRB1*09 | GTTTCTTGAAGCAGGATAAGTT | 22 | 236 |
| CCCGTAGTTGTGTCTGCACAC | 21 | ||
| HLA-DRB1*12 | AGTACTCTACGGGTGAGTGTT | 21 | 248 |
| CACTGTGAAGCTCTCCACAGG | 21 | ||
| HLA-DRB1*15 | TCCTGTGGCAGCCTAAGAG | 19 | 197 |
| CCGCGCCTGCTCCAGGAT | 18 | ||
| HGH | TCATTGACCTCAACTACATG | 20 | 437 |
| GCAGTGATGGCATGGACTGT | 20 |
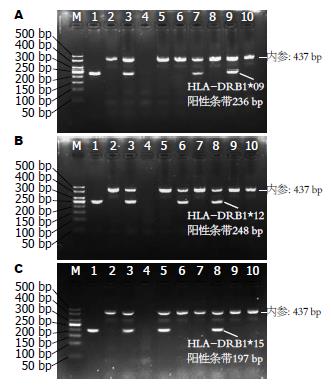
1.2.3 PCR-SSP检测及质量控制: 配制25 μL反应体系: Premix Taq酶(TaKaRa公司)12.5 μL, 10 μmol/L的上下游目的基因引物各0.5 μL, 10 μmol/L的上下游内参引物各0.4 μL, 8.7 μL ddH2O, 2.0 μL DNA模板. 反应条件: 预变性95 ℃ 4 min→变性94 ℃ 40 s, 退火59 ℃ 35 s, 延伸72 ℃ 60 s (循环35次)→修复延伸72 ℃ 10 min. PCR产物确定: 在2%琼脂糖凝胶进行电泳, 凝胶成像系统观察相应泳道出现清晰的DNA条带为阳性. 阳性产物送上海捷瑞公司测序, 测序结果与NCBI Gene-Bank的HLA-DRB1等位基因核苷酸序列进行比对(BLAST), 相似性达95%-99%, 结合电泳结果确定产物为目的基因片段(图1).
统计学处理 直接计数各组每个基因的阳性例数, 用统计软件SPSS13.0对各个基因携带率在五组间的差异行R×C表χ2检验, 然后对差异显著的基因用χ2分割法检验, 关联强度采用比值比(odds ratio, OR)及其95%可信区间分析; 统计学显著性检验均为双侧, 检验水准α = 0.05.
HLA-DRB1*15基因携带率在LC组最低(10.8%), 分别与对照组(34.7%, χ2 = 11.038, P = 0.0008, OR = 0.227, 95%CI: 0.091-0.569)、ASC组(39.1%, χ2 = 13.840, P = 0.0001, OR = 0.188, 95%CI: 0.074-0.478)、HCC组(33.9%, χ2 = 9.564, P = 0.002, OR = 0.235, 95%CI: 0.090-0.613)、CHB组(33.8%, χ2 = 10.551, P = 0.001, OR = 0.237, 95%CI: 0.095-0.589)对比均具显著差异, 其余各组两两比较均无统计学差异; HLA-DRB1*09/12的组间分布及两两比较均无统计学差异(表2).
| 分组 | n | HLA-DRB1*09(%) | HLA-DRB1*12(%) | HLA-DRB1*15(%) |
| NC | 75 | 14.7(11/75) | 17.3(13/75) | 34.7(26/75) |
| ASC | 64 | 26.6(17/64) | 23.4(15/64) | 39.1(25/64) |
| CHB | 80 | 22.5(18/80) | 26.3(21/80) | 33.8(27/80) |
| LC | 65 | 18.5(12/65) | 30.8(20/65) | 10.8(7 /65) |
| HCC | 56 | 14.3(8 /56) | 19.6(11/56) | 33.9(19/56) |
| χ2值 | 4.637 | 4.293 | 15.448 | |
| P值 | 0.327 | 0.368 | 0.004 |
HLA基因复合体位于人第6染色体短臂6p21.31区, 依据编码分子的不同特性而分成Ⅰ、Ⅱ、Ⅲ类基因区域, 与机体免疫调控密切相关. HLA-Ⅱ类分子主要表达在专职抗原提呈细胞表面, 识别和提呈外源性抗原肽并与CD4结合, 对辅助性T细胞(Th)的识别起限制作用, 发挥免疫调控效应而影响疾病的转归. Ⅱ类分子的α链和β链远膜区有个抗原结合槽, 与疾病相关的关键性氨基酸分布其中, 氨基酸的序列是由每个等位基因编码的, 由于HLA-Ⅱ类等位基因的多态性, 导致了抗原结合槽结合及提呈抗原肽给T细胞的效率不同而决定着不同个体对抗原免疫应答的差异. 在Ⅱ类区域中又以HLA-DRB1等位基因多态性最复杂, 且是机体免疫基因(Ir)所在区域, 故其与免疫应答关系最为密切[10,11]. 乙型肝炎肝细胞损伤主要通过机体一系列免疫反应造成, 因而HLA等位基因是影响HBV感染临床转归的重要因素.
国内外对HLA-DRB1*09的研究报道大多一致[12-15], DRB1*09在HBsAg阳性组(慢性乙型肝炎患者或单纯携带者)中的频率较HBsAg阴性组(感染后恢复者或正常人)的频率高, 可能是HBV感染及慢性化的易感基因, 但法国Bronowicki等[16]的研究认为DRB1*09对HBsAb的产生起促进作用. 本文对广西人群的研究结果显示HLA-DRB1*09基因在ASC组携带率相对于其他各组较高(26.6%), 但与频率较低的对照组(14.7%, P = 0.08)及HCC组(14.3%, P = 0.09)比较均无统计学差异(P>0.05), 因此尚不能认为HLA-DRB1*09是慢乙肝携带者的易感基因或HCC的抵抗基因, 有待加大样本量后进一步证实该基因位点是否有助于乙肝慢性感染者保持携带状态而免于发展至乙肝肝细胞癌.
任利等[17]对青海藏族人群研究发现HLA-DRB1*12可能是藏族人群乙型肝炎易感基因, 同时也可能是该人群乙型肝炎进展为肝硬化的关键位点, Wu[18]、张淑云[19]及袁俊华等[20]分别对台湾、哈尔滨及山东地区人群研究HLA-DRB1*12有相同报道. Li等[21]对中国东北部人群HLA-DRB1与乙肝感染结局关系的Meta分析结果显示DRB1*12可能是HBV持续感染的易感基因. 然而, 其他学者对浙江[22]、山东[23]等地区人群研究认为DRB1*12可能对机体免受HBV长期感染有保护性意义. 本研究结果显示HLA-DRB1*12基因在HBV携带者组(23.4%)、慢乙肝(26.3%)及乙肝肝硬化组(30.8%)中携带率较高, 但与对照组(17.3%)对比无统计学差异(P>0.05), 该基因是否可能是广西地区乙肝病毒感染及乙肝肝硬化高发的易感因素呢? 有待加大样本量并纳入民族、年龄等因素行多因素分层分析进一步证实.
Amarapurpar等[24]对印度西部人群研究发现HLA-DRB1*15与HBV感染慢性化显著相关; 而国内对中国北方汉族人群研究[25]中发现DRB1*15可能有助于宿主对HBV的清除, 对HBV感染的慢性化有抑制作用; 骆峻等[26]对中国人群HLA-DRB1基因多态性与慢性乙型肝炎关系的Meta分析结果也认为DRB1*15可能是我国人群慢性乙型肝炎的抵抗基因. 大量研究表明, 肝癌的发生与HBV感染及遗传因素密切相关, HLA的影响是目前研究的热点. Donaldson等[27]对123例HBsAg阳性的香港人群(其中有84例HCC患者)以及124例健康人研究结果显示, DRBl*15在肝癌病人中携带率与正常对照组比较为36% vs 19%, 推测他可能是肝癌的易感基因; 吉林地区的研究[28]也发现HLA-DRB1*15可能是原发性肝癌的易感基因; 而黄爱春等[5]对广西地区人群研究认为DRB1*15与原发性肝癌无明显关系. 本研究发现HLA-DRB1*15基因在LC组显著低于其他各组, 而其他各组间比较均无显著差异, 表明DRB1*15基因可能是广西人群乙肝肝硬化的抵抗基因, 其他研究者也有相同报道[29-31]. HLA-DRB1*15虽然在ASC组、CHB组及HCC组都有较高的携带率, 但与对照组比较及两两比较均无显著差异, 因此尚不能认为DRB1*15是ASC、CHB及HCC的易感基因, 其原因可能是DRB1*15基因在广西一般人群中, 与其他地区相比携带率较高[32,33], 广西是以壮、汉族为主的少数民族地区, 尤其在广西西部地区以壮族人群居多, 各民族相互交融, 其独特的遗传背景可能亦是广西地区人群慢性乙型肝炎高发并进展为肝癌的遗传易感因素. 临床观察发现部分乙肝肝细胞癌可经肝硬化结节演变, 本研究及各地研究结果[27-31]均显示携带HLA-DRB1*15可能降低慢乙肝患者进展为肝硬化的风险却不能降低肝癌发生的风险, 由此考虑慢乙肝患者进展为LC或HCC的内在机制存在本质差异, 更表明虽然肝硬化是肝癌的前奏, 但并不是必经阶段, DRB1*15基因在其中的作用机制有待深入研究.
各地区研究结果不尽一致, 分析原因及对策有以下几点: (1)HLA等位基因多态性依不同种族、地域人群分布而异, 在后续研究中, 我们可对比广西壮族与汉族人群的HLA-DRB1分布特征, 并展开多因素统计分析基因多态性、民族与乙肝病情的关系; (2)对照者的选择差异, 有尚未暴露于HBV者和HBV自限性感染者, 选择自限性感染者作为对照更严谨, 原因是未被HBV感染的健康人群只能提供正常的基因频率, 而不能直接提供是否易感或拮抗的信息; (3)研究的样本量不够大, 尽可能多中心协作进行大范围样本的研究; (4)研究对象混杂因素的影响, 乙肝感染者临床转归与感染年龄、患者年龄、性别、HBV基因型以及抗病毒治疗等因素有关[34], 本研究由于信息缺失和回忆偏倚未能确定患者感染年龄及HBV基因型并对其进行分层分析, 但对研究对象的年龄、性别作了均衡性检验, 并排除了筛选前曾抗病毒治疗的病例, 这样在一定程度上减少了混杂因素的干扰; (5)由于HLA同一等位基因存在不同的亚型, 分型的不同可能会影响结果的一致性; 另外, 与HBV相关的HLA某等位基因可能只是和真正的致病基因形成紧密连锁不平衡的单元型, 而不是真正的致病基因, 因此在此基础上进行单元型研究更具意义. 总之, HLA-DRB1遗传特征与乙肝病情转归密切相关, 后续研究有必要针对HLA等位基因及其编码相关细胞表面分子的生物学功能进行深入探讨, 以明确其对乙肝免疫格局的影响机制, 并为临床评估乙肝病情风险及个体化治疗提供理论和实验依据.
乙型肝炎病毒(HBV)严重威胁着人类的健康, 全球约3.5亿慢性HBV感染者, 每年约100万人死于HBV感染所致的严重肝病. 乙肝的病理损害过程, 主要由宿主对HBV的免疫应答介导, 而人类白细胞抗原(HLA)是影响宿主免疫应答能力的重要遗传因素.
张锦生, 教授, 复旦大学上海医学院病理学系
与HBV疫苗注射反应性, 乙肝相关肝病易感性 以及抗病毒治疗反应性等相关的HLA等位基因、连锁基因、单元型及HLA编码的细胞表面分子的发现是目前研究的热点.
林菊生等在研究湖北汉族人群乙肝肝硬化患者中, 发现HLA-DRB1*15等位基因可能是乙肝肝硬化的抵抗基因, 并得到许多研究的支持.
本文把乙肝相关性肝病(包括慢乙肝携带者、慢性乙型肝炎、肝硬化、肝细胞癌)纳入研究对象, 并对年龄进行均衡性检验, 全面系统的分析了HLA-DRB1对乙肝持续感染者疾病进展不同阶段的影响.
本文发现在以壮、汉族为主的广西地区人群中, HLA-DRB1*15等位基因可能是HBV持续感染者进展为乙肝肝硬化的抵抗基因.
连锁不平衡: 分属两个或两个以上基因座的等位基因, 同时出现在一条染色体上的机率高于随机出现的频率. 单元型: 染色体上MHC不同座位等位基因的特定组合.
HLA-DRB1基因频率分布与种族及地域有关, 该文首次系统研究以壮、汉族为主的广西人群HLA-DRB1与乙肝相关肝病的关系, 实验设计严谨、分析全面, 对临床研究及应用有较好的借鉴意义.
编辑: 李军亮 电编:闫晋利
| 1. | Lu FM, Zhuang H. Management of hepatitis B in China. Chin Med J (Engl). 2009;122:3-4. [PubMed] |
| 2. | Jung MC, Pape GR. Immunology of hepatitis B infection. Lancet Infect Dis. 2002;2:43-50. [PubMed] [DOI] |
| 3. | Rehermann B. Immune responses in hepatitis B virus infection. Semin Liver Dis. 2003;23:21-38. [PubMed] [DOI] |
| 4. | 沈 立萍, 杨 进业, 莫 兆军, 谭 毅, 李 荣成, 吴 秀玲, 韦 增良, 董 邕辉. 广西壮族自治区1996-2005年乙型肝炎发病状况监测分析. 疾病控制杂志. 2007;11:210-211. |
| 5. | 黄 爱春, 吴 继周, 吴 健林, 陈 务卿, 韦 颖华, 罗 双艳, 宁 秋悦, 李 兰兰. HLA-DRB1*14和*15等位基因与肝癌的相关性. 临床肝胆病杂志. 2010;26:420-422. |
| 6. | 陈 务卿, 吴 继周, 李 国坚, 吴 健林, 邓 一鸣, 韦 颖华, 胡 蝶飞, 宁 秋月, 李 兰兰, 黄 爱春. 广西新发现肝癌高发点HBV, HCV感染与HCC家庭聚集性的研究. 实用医学杂志. 2011;24:4494-4496. |
| 7. | 覃 玲, 吴 继周, 吴 健林, 万 裴琦, 韦 颖华, 宁 秋悦, 庞 裕. TGF-β1rs1800469基因多态性与HBV感染及肝癌家族聚集的相关性. 世界华人消化杂志. 2012;20:514-518. [DOI] |
| 9. | Bunce M, O'Neill CM, Barnardo MC, Krausa P, Browning MJ, Morris PJ, Welsh KI. Phototyping: comprehensive DNA typing for HLA-A, B, C, DRB1, DRB3, DRB4, DRB5 & amp; DQB1 by PCR with 144 primer mixes utilizing sequence-specific primers (PCR-SSP). Tissue Antigens. 1995;46:355-367. [PubMed] [DOI] |
| 10. | Wang FS. Current status and prospects of studies on human genetic alleles associated with hepatitis B virus infection. World J Gastroenterol. 2003;9:641-644. [PubMed] |
| 11. | Thio CL, Thomas DL, Karacki P, Gao X, Marti D, Kaslow RA, Goedert JJ, Hilgartner M, Strathdee SA, Duggal P. Comprehensive analysis of class I and class II HLA antigens and chronic hepatitis B virus infection. J Virol. 2003;77:12083-12087. [PubMed] [DOI] |
| 12. | Ahn SH, Han KH, Park JY, Lee CK, Kang SW, Chon CY, Kim YS, Park K, Kim DK, Moon YM. Association between hepatitis B virus infection and HLA-DR type in Korea. Hepatology. 2000;31:1371-1373. [PubMed] [DOI] |
| 13. | Meng XQ, Chen HG, Ma YL, Liu KZ. Influence of HLA class II molecules on the outcome of hepatitis B virus infection in population of Zhejiang Province in China. Hepatobiliary Pancreat Dis Int. 2003;2:230-233. [PubMed] |
| 16. | Bronowicki JP, Abdelmouttaleb I, Peyrin-Biroulet L, Venard V, Khiri H, Chabi N, Amouzou EK, Barraud H, Halfon P, Sanni A. Methylenetetrahydrofolate reductase 677 T allele protects against persistent HBV infection in West Africa. J Hepatol. 2008;48:532-539. [PubMed] [DOI] |
| 17. | 任 利, 邓 勇, 王 海久, 任 宾, 牛 晓尧, 樊 海宁. 青海藏族人群HLA-DRB1基因与乙型肝炎预后的相关性. 世界华人消化杂志. 2011;19:1899-1903. [DOI] |
| 18. | Wu YF, Wang LY, Lee TD, Lin HH, Hu CT, Cheng ML, Lo SY. HLA phenotypes and outcomes of hepatitis B virus infection in Taiwan. J Med Virol. 2004;72:17-25. [PubMed] [DOI] |
| 19. | 张 淑云, 李 迪, 谷 鸿喜, 李 兴库, 金 茜, 刘 伟, 杜 博, 卢 滨. HBV感染者人类白细胞Ⅰ,Ⅱ类抗原等位基因多态性分析. 世界华人消化杂. 2006;14:963-968. [DOI] |
| 21. | Li X, Liu W, Wang H, Jin X, Fang S, Shi Y, Liu Z, Zhang S, Yang S. The influence of HLA alleles and HBV subgenotyes on the outcomes of HBV infections in Northeast China. Virus Res. 2012;163:328-333. [PubMed] [DOI] |
| 23. | Chu RH, Ma LX, Wang G, Shao LH. Influence of HLA-DRB1 alleles and HBV genotypes on interferon-alpha therapy for chronic hepatitis B. World J Gastroenterol. 2005;11:4753-4757. [PubMed] |
| 24. | Amarapurpar DN, Patel ND, Kankonkar SR. HLA class II genotyping in chronic hepatitis B infection. J Assoc Physicians India. 2003;51:779-781. [PubMed] |
| 25. | Yang G, Liu J, Han S, Xie H, Du R, Yan Y, Xu D, Fan D. Association between hepatitis B virus infection and HLA-DRB1 genotyping in Shaanxi Han patients in northwestern China. Tissue Antigens. 2007;69:170-175. [PubMed] [DOI] |
| 27. | Donaldson PT, Ho S, Williams R, Johnson PJ. HLA class II alleles in Chinese patients with hepatocellular carcinoma. Liver. 2001;21:143-148. [PubMed] [DOI] |
| 29. | 熊 伍军, 刘 菲, 刘 雁冰. 慢性乙型肝炎后肝硬化与HLA-II类抗原等位基因相关性研究. 中华微生物学和免疫学杂志. 2006;26:904-905. |
| 30. | 林 菊生, 程 元桥, 田 德英, 廖 家志, 刘 南植, 熊 平, 梁 扩寰. HLA-DRB1和肿瘤坏死因子α基因多态性与肝硬化的遗传易感性. 中华内科杂志. 2002;41:818-821. |
| 31. | Cheng YQ, Lin JS, Huang LH, Tian DY, Xiong P. [The association of HLA-DRB1 allele polymorphism with the genetic susceptibility to liver cirrhosis due to hepatitis B virus]. Zhonghua Yixue Yichuanxue Zazhi. 2003;20:247-249. [PubMed] |
| 32. | 潘 尚领, 刘 承武, 龙 桂芳, 袁 志刚, 石 文, 林 伟雄, 陈 萍, 陈 晶, 陈 文成, 周 小玲. 广西壮族HLA-DRB1基因的多态性及其与主要周边民族的比较. 中华微生物学和免疫学杂志. 2005;25:48-51. |
| 33. | 冯 明亮, 杨 剑豪, 季 芸, 陆 剑文, 陆 琼, 嵇 月华, 谢 军华, 杨 颖. 江浙沪汉族人群HLA-DRB1基因座遗传特征及不同人群频率分布比较. 中华医学遗传学杂志. 2003;20:365-367. |
| 34. | Singh R, Kaul R, Kaul A, Khan K. A comparative review of HLA associations with hepatitis B and C viral infections across global populations. World J Gastroenterol. 2007;13:1770-1787. [PubMed] |