修回日期: 2012-08-10
接受日期: 2012-08-21
在线出版日期: 2012-09-18
目的: 探讨人端粒酶逆转录酶(human Telomerase reverse transcriptase, hTERT)及黏蛋白4(mucin4, MUC4)基因在胰腺癌患者外周血中的表达及临床意义.
方法: 采用实时荧光定量PCR方法检测hTERT mRNA和MUC4 mRNA在胰腺癌患者及正常人外周血中的表达, 对hTERT mRNA和MUC4 mRNA的检测结果进行评价分析.
结果: 胰腺癌组外周血中hTERT mRNA, MUC4mRNA表达水平分别为(7.95±5.46, 38.25±25.07)显著高于对照组(0.92±1.07, 4.37±5.96). 差异具有显著统计学意义(均P<0.05). hTERT mRNA和MUC4 mRNA均与肿瘤的淋巴结转移、周围器官或远处转移及TNM分期相关(hP分别为0.036、0.027、0.019, 均P<0.05; MP分别为0.041、0.022、0.017, 均P<0.05).
结论: 外周血中hTERT mRNA和MUC4 mRNA的表达与胰腺癌侵袭及转移密切相关, 可作为诊断胰腺癌的标志物.
引文著录: 孙大伟, 何俊闯, 邱法波, 张晓峰, 黄飞龙. 外周血中hTERT及MUC4基因的表达在胰腺癌诊断中的意义. 世界华人消化杂志 2012; 20(26): 2500-2505
Revised: August 10, 2012
Accepted: August 21, 2012
Published online: September 18, 2012
AIM: To analyze the clinical significance of expression of human telomerase reverse transcriptase (hTERT) and mucin 4 (MUC4) mRNAs in peripheral blood of patients with pancreatic cancer.
METHODS: Real-time fluorescence quantitative RT-PCR was applied to investigate the quantitative expression of hTERT and MUC4 mRNAs in peripheral blood of patients with pancreatic cancer and healthy controls.
RESULTS: The expression levels of hTERT and MUC4 mRNAs in peripheral blood of patients with pancreatic cancer were significantly higher than those in normal controls (7.95 ± 5.46 vs 0.92 ± 1.07, P < 0.01; 38.25 ± 25.07 vs 4.37 ± 5.96, P < 0.05). The expression of both hTERT and MUC4 mRNAs was associated with lymph node metastasis, surrounding organ infiltration, distant metastasis, and TNM stage (hP = 0.036, 0.027, 0.019; MP = 0.041, 0.022, 0.017).
CONCLUSION: Abnormal expression of hTERT and MUC4 mRNAs closely correlates with invasion and metastasis of pancreatic cancer, and hTERT and MUC4 mRNAs in peripheral blood cells might be useful markers for pancreatic caner.
- Citation: Sun DW, He JC, Qiu FB, Zhang XF, Huang FL. Clinical significance of expression of hTERT and MUC4 mRNAs in peripheral blood of patients with pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(26): 2500-2505
- URL: https://www.wjgnet.com/1009-3079/full/v20/i26/2500.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i26.2500
胰腺癌(pancreatic carcinoma)是一种恶性程度很高的恶性肿瘤, 早期便可有胰周组织浸润和远处组织的微转移, 由于胰腺癌临床表现较为隐匿, 早期缺乏特异性的症状和体征, 导致早期诊断率不高, 80%-90%的胰腺癌患者就诊时, 病变已经到了晚期, 手术切除率只有15%左右, 5年生存率为1%-5%[1], 而且胰腺癌对目前的治疗方法如放射治疗、化疗、免疫治疗和内分泌治疗都不敏感, 疗效差. 因此, 如何提高胰腺癌的早期诊断率是改善本病预后的重要课题. 端粒酶是目前已知最具特异性和普遍性的恶性肿瘤标志物. 近年来, 端粒酶活性的检测在组织标本、分泌物、病理性体液和外周血标本中均得到了广泛的应用. 有研究证实, 黏蛋白4(mucin4, MUC4)在胰腺癌组织中高表达, 而在慢性胰腺炎及正常胰腺组织中不表达[2], 因此通过研究MUC4 mRNA在胰腺癌外周血中的表达情况, 可为胰腺癌的诊断和鉴别诊断及预后评价提供帮助. 通过检测胰腺癌患者术前外周血中端粒酶逆转录酶(human Telomerase reverse transcriptase, hTERT)mRNA和MUC4 mRNA的表达水平, 有望为胰腺癌的诊断及预后判断提供一个可靠的指标.
所有外周血标本均来自2010-10/2011-08青岛大学医学院附属医院肝胆外科胰腺癌患者及非肿瘤住院患者. 肿瘤组28例, 男16例, 女12例, 平均年龄56.5岁. 所有病例均经术后病理学证实, 并根据术中探查和术后病理结果按UICC(2009)分期系统对其进行TNM分期. 对照组选取同期18例该院非肿瘤住院患者, 男7例, 女11例, 平均年龄48.3岁, 胆囊结石14例﹑胆总管结石3例、胆囊息肉1例.
1.2.1 总RNA提取: 本研究通过医院伦理委员会批准, 并经患者同意, 在患者未进行手术、化疗及放疗前抽取外周静脉血5 mL, EDTA-Na抗凝, 血液采集后立即送往实验室进行总RNA提取, 3 h内经淋巴细胞分离液分离出外周血单个核细胞后置-70 ℃冰箱保存待测. 总RNA提取按照说明书(TaKaRa Code: D9108A大连宝生物公司)进行. 通过紫外分光光度计分别检测RNA的R值(A260/A280). 计算RNA浓度. 获取合格样本冻存-80 ℃冰箱中.
1.2.2 cDNA合成: 按照实时荧光定量RT reagent kit(TaKaRa Code: DRR037S大连宝生物公司)要求的条件对提取的总RNA进行逆转录cDNA, 反应体系为10 µL. 逆转录的反应条件为: 37 ℃ 15 min(反转录反应), 85 ℃ 5 s(反转录酶的失活反应). 逆转录所得的反应液即为下一步实时荧光定量PCR反应所需的cDNA模板, -20 ℃冰箱保存备用.
1.2.3 FQ-PCR: 引物序列(生工生物工程(上海)有限公司设计合成): hTERT-F1(5'-CtC CCA TTT CAT CAG CAA GTT T-3'), hTERT-R1(5'-CtT GGC TTT CAG GAT GGA GTA G-3'); MUC4-F1(5'-CAC AAC TCt CCC AAA AAC AAC A-3'), MUC4-R1(5'-TGT GAT GTG TGT CtA TCC AGC A-3'), 内参基因GAPDH序列: F1: 5'-TCA TGG GTG TGA ACC ATG AGA A-3', R1: 5'-GGC ATG GAC TGT GGT CAT GAG-3'. 荧光定量检测, 反应体系为10 µL, 反应条件为: 95 ℃预变性30 s, 然后循环40次(95 ℃变性5 s、57 ℃退火15 s、72 ℃延伸20 s), 溶解条件: 95 ℃ 60 s、57 ℃ 30 s、95 ℃ 30 s.
统计学处理 结果分析及数据处理; 相对定量值计算公式: 2-△△Ct. △Ct = 样本Ct均值-内参Ct均值, △△Ct = △Ct-(随机对照样品Ct均值-该样品内参Ct均值). 以2-△△Ct来表示被测样本初始cDNA中目的基因的相对表达量. 每个组织样本设为3组进行检测. 采用SPSS13.0统计软件对数据结果进行处理分析, 实验结果均用mean±SD来表示, 组间的计量资料比较采用t'值检验, 计数资料比较采用Fisher's Exact Test检验. 以P<0.05为差异有统计学意义.
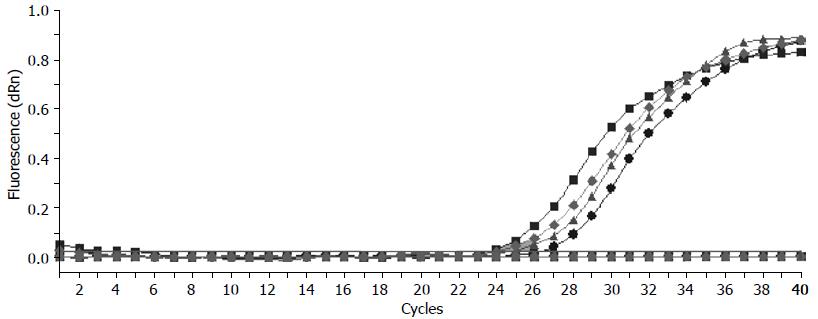
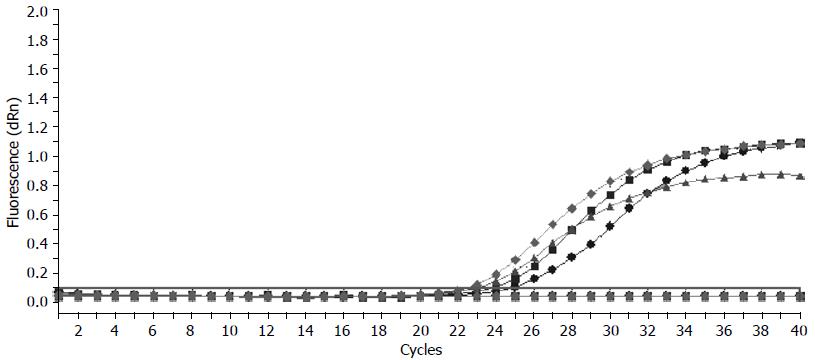
胰腺癌患者外周血中hTERT mRNA, MUC4 mRNA实时荧光定量检测当Ct水平≤34时, 其荧光定量的扩增曲线呈典型的S型曲线, 溶解曲线也只会呈现为单峰相, 而阴性标本, Ct水平>34时也未见典型S型波形, 即使扩增40个循环也没有典型S型曲线出现, 多为略有翘起的不规则波浪线. 胰腺癌外周血hTERT mRNA, MUC4 mRNA阳性标本的荧光定量扩增曲线表现为典型的S型曲线(图1, 2).
mRNA, MUC4 mRNA表达量 胰腺癌组外周血中hTERT mRNA, MUC4 mRNA表达水平分别为7.95±5.46和38.25±25.07, 对照组外周血中hTERT mRNA, MUC4 mRNA表达水平分别为0.92±1.07和4.37±5.96, 差异显著具有统计学意义(均P<0.05, 表1).
| 基因 | 胰腺癌组(n = 28) | 对照组(n = 18) | t '值 | P值 |
| hTERT mRNA | 7.95±5.46 | 0.92±1.07 | 5.63 | <0.05 |
| MUC4 mRNA | 38.25±25.07 | 4.37±5.96 | 5.78 | <0.05 |
mRNA, MUC4 mRNA的表达水平与临床生物学特征的关系 28例胰腺癌患者根据临床资料分别按照患者的性别、年龄、肿瘤直径大小、肿瘤分化程度、有无淋巴结转移、有无周围器官浸润或远处转移以及临床TNM分期进行分组, 观察hTERT mRNA与MUC4 mRNA在胰腺癌患者外周血中的表达情况. 研究结果发现, hTERT mRNA和MUC4 mRNA在胰腺癌患者外周血中的表达量均与肿瘤的淋巴结转移、周围器官或远处转移及临床TNM分期相关, 差异具有统计学意义(hP = 0.036, 0.027, 0.019; MP = 0.041, 0.022, 0.017). 而两者均与胰腺癌患者的性别、年龄、肿瘤直径大小及肿瘤分化程度无明显相关性(均P>0.05, 表2).
| 分组 | n | hTERT mRNA | MUC4 mRNA | ||
| 表达水平 | P值 | 表达水平 | P值 | ||
| 性别 | |||||
| 男 | 16 | 7.76±5.23 | 37.24±25.30 | ||
| 女 | 12 | 8.13±5.86 | 0.813 | 39.02±24.87 | 0.974 |
| 年龄(岁) | |||||
| ≥50 | 19 | 9.05±6.23 | 40.53±27.43 | ||
| <50 | 9 | 6.89±4.73 | 0.714 | 34.13±24.05 | 0.433 |
| 肿瘤直径(cm) | |||||
| ≥3 | 17 | 7.85±5.43 | 39.63±25.71 | ||
| <3 | 11 | 8.03±5.74 | 0.734 | 37.25±24.83 | 0.695 |
| 分化程度 | |||||
| 低分化 | 16 | 8.69±6.23 | 41.56±26.73 | ||
| 高中分化 | 12 | 6.93±5.12 | 0.437 | 37.25±24.83 | 0.36 |
| 淋巴转移 | |||||
| 有转移 | 9 | 9.43±4.97 | 47.38±27.54 | ||
| 无转移 | 19 | 6.05±6.74 | 0.036 | 30.17±24.53 | 0.041 |
| 周围器官浸润或远处转移 | |||||
| 有 | 7 | 9.53±5.26 | 48.13±26.53 | ||
| 无 | 21 | 6.14±6.43 | 0.027 | 29.54±27.13 | 0.022 |
| TNM分期 | |||||
| Ⅰ-Ⅱ | 13 | 4.34±5.94 | 28.48±25.56 | ||
| Ⅲ-Ⅳ | 15 | 12.74±6.38 | 0.019 | 49.87±25.83 | 0.017 |
mRNA, MUC4 mRNA临床诊断分界值、敏感性及特异性 hTERT mRNA定量检测胰腺癌组28例Ct水平≤34者21例, Ct水平>34者7例; 而对照组Ct水平≤34者3例, Ct水平>34者15例. MUC4 mRNA定量检测胰腺癌组28例Ct水平≤34者17例, Ct水平>34者11例; 而对照组Ct水平≤34者2例; Ct水平>34者16例. 两个指标在Ct水平≤34作为第三截割点时敏感性及特异性较高, 该水平hTERT mRNA的诊断敏感性为75%; 特异性为83.3%, MUC4 mRNA的诊断敏感性为60.7%; 特异性为88.9%, 两者联合检测的诊断敏感性为82.1%, 特异性为83.3%. 两种检测指标对胰腺癌的诊断未见差异(P>0.05).
人端粒酶是由人端粒酶RNA(human telomerase RNA component, hTR/hTRC)、人端粒酶相关蛋白(human telomerase protein, hTEP)和hTERT共同构成, 是一种逆转录酶, 在端粒合成的过程中, 端粒酶以其自身携带的富含胞嘧啶的RNA模板为互补链, 故端粒酶可看做是一种特殊的携带模板的逆转录酶, 其RNA组分约含450个核苷酸, 模板区为5'-CUAACCCUAAC-3, 能指导端粒末端TTAGGG的重复合成, 编码基因定位于3q26.3[3,4]. 端粒酶的催化亚单位hTERT是人端粒酶的限速酶, 其表达量随端粒酶活性的增加而相应呈比例增加, 在多数恶性肿瘤以及具有再生能力和分化潜能的细胞中处于激活状态, 而在大多数终末分化的正常体细胞中处于抑制状态[5]. 因此, 对hTERT的研究对肿瘤的诊断具有重要的意义.
目前研究证实hTERT可在胰腺肿瘤组织中表达, 周家华等[6]检测到hTERT mRNA在胰腺癌组织中表达阳性率为83.3%, 癌旁组织为12.5%, 证实了端粒酶参与了胰腺癌的发生过程. 许逸卿等[7]采用TRAP-SYBR Gree染色法检测胰腺癌组织及癌旁组织的端粒酶活性发现, 端粒酶活性在癌组织中的表达率为80.9%, 而癌旁组织的表达率为7.1%, 具有显著差异, 认为端粒酶在胰腺癌的发生、发展及演变过程中发挥着重要的作用. 而Hashimoto等[8]通过实验研究认为尽管众多研究证实胰腺癌组织当中端粒酶活性增高, 而肿瘤细胞与其前体正常细胞相比端粒的长度异常缩短, 也就认为恶性肿瘤细胞为修复其缩短的端粒导致端粒酶活性的增加, 而非是TTAGGG重复序列的延长.
由于胰腺癌恶性程度较高, 临床表现较为隐匿, 早期又缺乏特异性的症状和体征, 相当比例的患者诊断时即为中晚期, 便可能伴有有胰周组织浸润和远处组织的微转移. 许多患者早期血液循环中可能就有肿瘤细胞的存在, 因数量较少或被机体免疫系统攻击术前常规的血液检测方法难以检测, 而肿瘤的微转移是胰腺癌复发和转移的主要原因之一. 但由于缺乏一种足够敏感和特异的生物学指标用以术前诊断及预后的评价, 令临床医生深感困扰. 我们研究发现, 外周血中hTERT mRNA的表达水平及阳性表达率胰腺癌组(7.95±5.46; 75%)均显著高于正常对照组(0.92±1.07; 16.7%), 具有统计学意义(P<0.05). 胰腺癌患者外周血中hTERT mRNA的表达水平及阳性表达率与患者淋巴结转移、有无周围组织器官浸润及临床TNM分期呈正相关(P<0.05), 与患者的性别、年龄、分化程度、肿瘤直径大小等临床特征无统计学差异(P>0.05). 通过实验说明, 患者外周血中hTERT mRNA的表达水平越高, 外周血循环中存在的肿瘤细胞就越多, 说明机体抗肿瘤免疫能力减弱, 使得肿瘤的转移及术后的复发成为可能. 因此我们认为, 胰腺癌患者外周血中hTERT mRNA的表达水平可以作为术前评估及术后判断治疗效果及预后的有效指标.
黏蛋白是一种高分子量、高度糖基化的蛋白, 可由多种分泌上皮分泌, 正常情况能够促进分泌上皮细胞的更新和分化, 对上皮组织有着重要的润滑和保护作用, 同时, 参与细胞间信号转导, 调节细胞黏附及肿瘤的侵袭转移[9]. 一旦分泌上皮发生癌变或瘤变, 其表达的质和量就出现异常. 多项研究证实, 上皮细胞的恶变过程中多伴有MUC的异常糖基化, 表明其在肿瘤的发生、发展中发挥着重要的作用. MUC家族根据功能特点大致分为两类: 分泌型黏蛋白和膜结合蛋白. 其重要成员之一MUC4与乳腺癌、食管癌、胰腺癌、结肠癌等多种类型肿瘤关系密切[10]. MUC4基因定位于3q29, 编码的跨膜蛋白型黏蛋白在人体中分布广泛. MUC4蛋白由MUC4α和MUC4β组成, 其中MUC4α为胞外结构, 能够干扰整合素和钙粘蛋白介导的细胞与细胞、细胞与基质之间的黏附作用, 使得肿瘤细胞在组织中的黏附性迅速下降, 甚至消失, 并通过遮蔽细胞表面的抗原蛋白, 干扰细胞毒细胞等免疫细胞对肿瘤细胞的识别和杀伤作用, 从而促进肿瘤细胞的转移. MUC4β为跨膜部分, 含有3个EGF样结构域, 可结合并激活ErbB2, 从而抑制细胞凋亡, 促进其生长[11-13]. ErbB2基因编码的细胞膜受体糖蛋白的序列和结构与表皮生长因子受体(epidermal growth factor receptor, EGFR)非常相似, 且具有酪氨酸激酶活性. ErbB2与配体结合后, 通过自身磷酸化激活胞内的磷酸酶C-r、磷酯酰肌醇-3激酶和Ras GTP酶激活蛋白, 催化相应的底物, 调节细胞的生长及分化. 国内外研究证实[14,15], 在胰腺癌中MUC4的过度表达可诱导极化细胞中ErbB2/HER2由基底侧向顶端表达增加, 更易于两者的结合, 后者又可使AKT信号传导通路激活增加, 从而增加肿瘤细胞的抗凋亡作用. 80%-90%的胰腺外分泌肿瘤来源于导管细胞, 从上皮细胞的增生、发育不良, 发展至侵袭性导管癌的病变过程与结肠腺癌相似[16]. 研究证实, MUC4在所有胰腺导管上皮内瘤(pancreatic intraepithelial neoplasia, PanlN)病变及侵袭性胰腺导管腺癌中均有表达, 且随着不典型程度增加, 其表达率也逐渐增高[17].
MUC具有伴随癌细胞进入外周循环的作用, 研究显示, 在乳腺癌患者外周血单个核细胞中可检测到上皮源性的细胞角蛋白及MUC1的表达[18]. 有研究在乳腺癌患者外周血单个核细胞中检测到MUC4 mRNA的表达, 而在乳腺炎患者及正常健康人中没有检测到MUC4 mRNA的表达, 提示在临床工作中可通过对胰腺癌或疑似胰腺癌的患者进行术前抽血, 检查其外周血中有无MUC4 mRNA表达, 早期鉴别诊断胰腺癌.
我们研究发现, 外周血中MUC4 mRNA的表达水平及阳性表达率胰腺癌组均显著高于正常对照组. 胰腺癌患者外周血中MUC4 mRNA的表达水平及阳性表达率与患者淋巴结转移、有无周围组织器官浸润及临床TNM分期呈正相关, 与患者的性别、年龄、分化程度、肿瘤直径大小等临床特征无统计学差异. 提示外周血MUC4 mRNA的定量检测可作为胰腺癌微转移有效地标志物.
实验证明, 癌基因MUC4的表达可促进胰腺肿瘤细胞的生长及转移, 并且增加了肿瘤细胞的抗凋亡的能力[19]. 转化生长因子-α(transforming growth factor, TGF-α)、表皮细胞生长因子(epidermal growth factor, EGF)、干扰素(interferon γ, IFN-γ)等多种转录因子调控MUC4的表达, 此外, Ets蛋白PEA3上调MUC4下调ErbB-2表达在调节胰腺癌细胞系分化和增值平衡中发挥关键作用[20]. 随着研究的深入进展, 如何从转录水平调控MUC4基因的表达意境成为新的分子治疗发展新方向. MUC4启动子是转录调控相对集中的靶向区, 因涉及许多信号通路, 其调控过程较为复杂, 这些信号通路对于MUC4在胰腺癌和肝胆系统中的表达均有作用, 目前已经发现SP1和SP3是MUC4表达的重要调控因子. SP1上调MUC4的表达, SP3抑制MUC4启动子的转录活性. 同时发现EGF和TGF-α可以增强启动子活性. 这些转录因子主要通过PKC、PKA信号途径调控着MUC4基因的表达[21]. 对这些信号通路的认识可对进一步研究如何抑制肿瘤生长和转移提供可能.
胰腺癌是一种恶性程度很高的恶性肿瘤, 早期便可有胰周组织浸润和远处组织的微转移, 由于胰腺癌临床表现较为隐匿, 早期缺乏特异性的症状和体征, 导致早期诊断率不高, 80%-90%的胰腺癌患者就诊时, 病变已经到了晚期, 手术切除率只有15%左右, 5年生存率为1%-5%, 而且其对目前的治疗方法如放射治疗、化疗、免疫治疗和内分泌治疗都不敏感, 疗效差.
周国雄, 主任医师, 南通大学附属医院消化内科
如何提高胰腺癌的早期诊断率是改善本病预后的重要课题.
周家华等检测到hTERT mRNA在胰腺癌组织中表达阳性率为83.3%, 癌旁组织为12.5%, 证实了端粒酶参与了胰腺癌的发生过程.
本研究方法合理, 结果可信, 有较好的临床应用价值.
编辑: 李军亮 电编:闫晋利
| 1. | Lemoine NR, Jain S, Hughes CM, Staddon SL, Maillet B, Hall PA, Klöppel G. Ki-ras oncogene activation in preinvasive pancreatic cancer. Gastroenterology. 1992;102:230-236. [PubMed] |
| 2. | Andrianifahanana M, Moniaux N, Schmied BM, Ringel J, Friess H, Hollingsworth MA, Büchler MW, Aubert JP, Batra SK. Mucin (MUC) gene expression in human pancreatic adenocarcinoma and chronic pancreatitis: a potential role of MUC4 as a tumor marker of diagnostic significance. Clin Cancer Res. 2001;7:4033-4040. [PubMed] |
| 3. | Vaziri H, Benchimol S. Reconstitution of telomerase activity in normal human cells leads to elongation of telomeres and extended replicative life span. Curr Biol. 1998;8:279-282. [PubMed] [DOI] |
| 4. | Harley CB, Futcher AB, Greider CW. Telomeres shorten during ageing of human fibroblasts. Nature. 1990;345:458-460. [PubMed] [DOI] |
| 5. | Miura M, Zhu H, Rotello R, Hartwieg EA, Yuan J. Induction of apoptosis in fibroblasts by IL-1 beta-converting enzyme, a mammalian homolog of the C. elegans cell death gene ced-3. Cell. 1993;75:653-660. [PubMed] [DOI] |
| 8. | Hashimoto Y, Murakami Y, Uemura K, Hayashidani Y, Sudo T, Ohge H, Fukuda E, Shimamoto F, Sueda T, Hiyama E. Telomere shortening and telomerase expression during multistage carcinogenesis of intraductal papillary mucinous neoplasms of the pancreas. J Gastrointest Surg. 2008;12:17-28; discussion 28-29. [PubMed] [DOI] |
| 9. | Julian J, Carson DD. Formation of MUC1 metabolic complex is conserved in tumor-derived and normal epithelial cells. Biochem Biophys Res Commun. 2002;293:1183-1190. [PubMed] [DOI] |
| 10. | Hanaoka J, Kontani K, Sawai S, Ichinose M, Tezuka N, Inoue S, Fujino S, Ohkubo I. Analysis of MUC4 mucin expression in lung carcinoma cells and its immunogenicity. Cancer. 2001;92:2148-2157. [PubMed] [DOI] |
| 11. | Moniaux N, Escande F, Batra SK, Porchet N, Laine A, Aubert JP. Alternative splicing generates a family of putative secreted and membrane-associated MUC4 mucins. Eur J Biochem. 2000;267:4536-4544. [PubMed] [DOI] |
| 12. | Komatsu M, Carraway CA, Fregien NL, Carraway KL. Reversible disruption of cell-matrix and cell-cell interactions by overexpression of sialomucin complex. J Biol Chem. 1997;272:33245-33254. [PubMed] [DOI] |
| 13. | Komatsu M, Yee L, Carraway KL. Overexpression of sialomucin complex, a rat homologue of MUC4, inhibits tumor killing by lymphokine-activated killer cells. Cancer Res. 1999;59:2229-2236. [PubMed] |
| 15. | Schlieman MG, Fahy BN, Ramsamooj R, Beckett L, Bold RJ. Incidence, mechanism and prognostic value of activated AKT in pancreas cancer. Br J Cancer. 2003;89:2110-2115. [PubMed] [DOI] |
| 17. | Swartz MJ, Batra SK, Varshney GC, Hollingsworth MA, Yeo CJ, Cameron JL, Wilentz RE, Hruban RH, Argani P. MUC4 expression increases progressively in pancreatic intraepithelial neoplasia. Am J Clin Pathol. 2002;117:791-796. [PubMed] [DOI] |
| 18. | Méhes G, Witt A, Kubista E, Ambros PF. Circulating breast cancer cells are frequently apoptotic. Am J Pathol. 2001;159:17-20. [PubMed] [DOI] |
| 20. | Fauquette V, Perrais M, Cerulis S, Jonckheere N, Ducourouble MP, Aubert JP, Pigny P, Van Seuningen I. The antagonistic regulation of human MUC4 and ErbB-2 genes by the Ets protein PEA3 in pancreatic cancer cells: implications for the proliferation/differentiation balance in the cells. Biochem J. 2005;386:35-45. [PubMed] [DOI] |
| 21. | Perrais M, Pigny P, Ducourouble MP, Petitprez D, Porchet N, Aubert JP, Van Seuningen I. Characterization of human mucin gene MUC4 promoter: importance of growth factors and proinflammatory cytokines for its regulation in pancreatic cancer cells. J Biol Chem. 2001;276:30923-30933. [PubMed] [DOI] |