修回日期: 2012-07-30
接受日期: 2012-08-06
在线出版日期: 2012-09-08
目的: 评价肝细胞癌(hepatocellular carcinoma, HCC)根治性治疗后口服维生素K2(vitamin K2, VK2)类似物预防肿瘤复发及提高总生存率的疗效.
方法: 计算机检索中国知网、Medline、Embase和Cochrane图书馆数据库中的相关文献. 检索所有关于HCC根治性术后VK2类似物治疗的研究. 对纳入文献进行资料提取及质量评价. 采用相对危险度(risk ratio, RR)及其95%可信区间(confidence interval, CI)表示统计效应量.
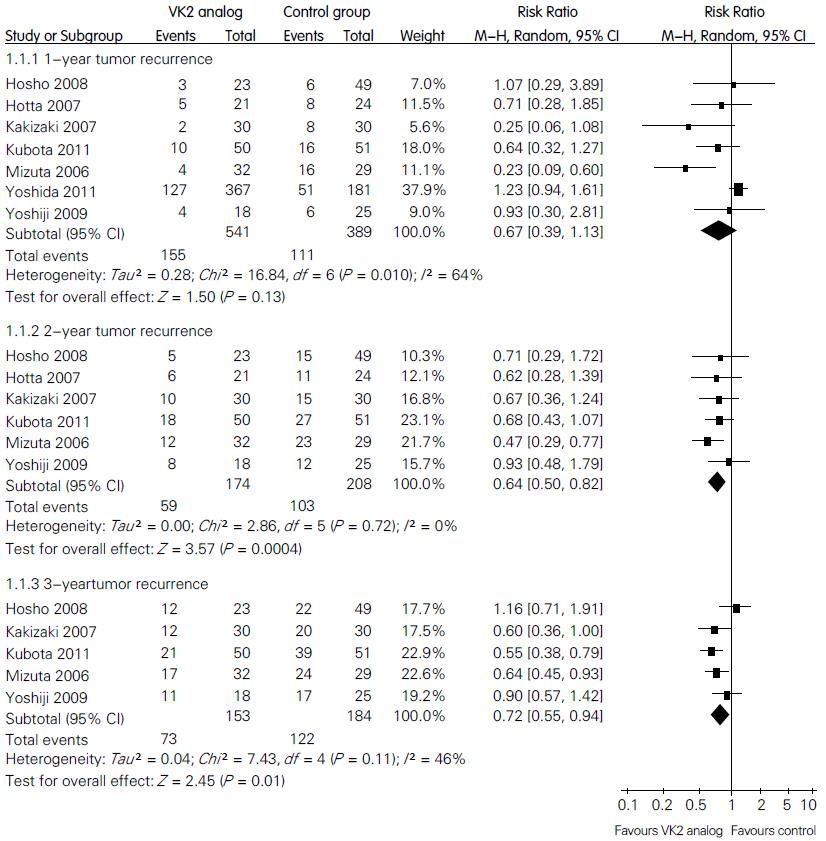
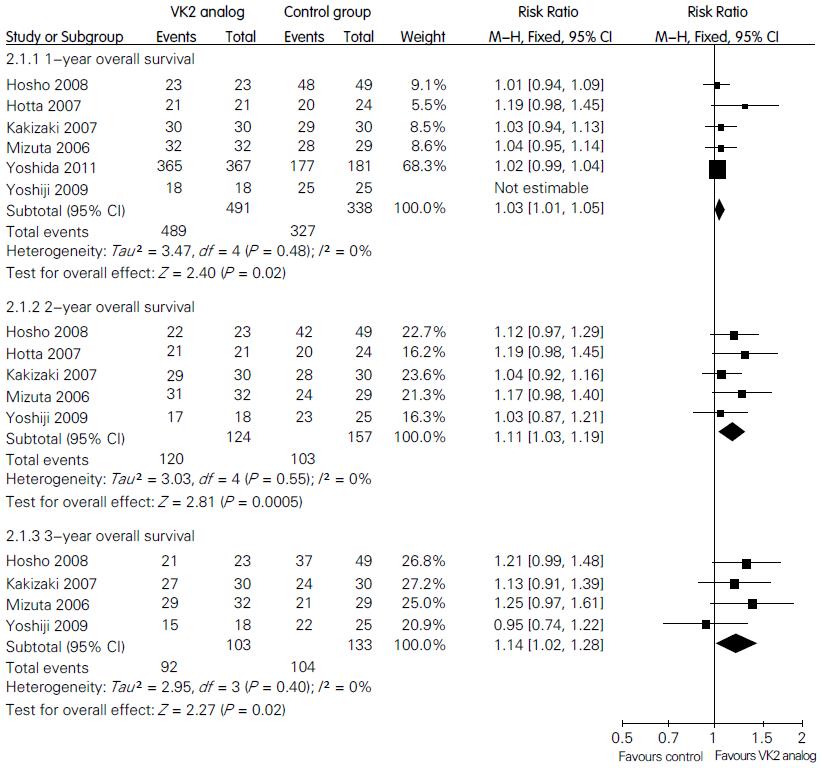
结果: 共纳入6个随机对照试验和1个队列研究, 合计930例患者. Meta分析结果显示: (1)HCC根治性术后口服VK2类似物不能降低术后1年复发率(RR = 0.67, 95%CI: 0.39-1.13, P = 0.13), 但术后2年及3年复发率显著降低(RR = 0.65, 95%CI: 0.51-0.83, P<0.001; RR = 0.70, 95%CI: 0.58-0.85, P<0.001); (2)1、2、3年总生存率: 口服VK2类似物治疗组与单纯手术治疗组比较, 2组差异有统计学意义(RR = 1.03, 95%CI: 1.01-1.05, P = 0.02; RR = 1.11, 95%CI: 1.03-1.19, P = 0.005; RR = 1.14, 95%CI: 1.02-1.28, P = 0.02); (3)口服VK2类似物安全, 无不良反应报道.
结论: 目前证据显示辅助VK2类似物治疗对降低HCC患者根治性术后复发率及提高总生存率有一定的疗效. 由于纳入研究的随访时间较短和存在的局限性, 有必要开展多中心大样本的随机对照试验长期随访观察进一步证实其疗效.
引文著录: 钟鉴宏, 黎乐群, 游雪梅, 向邦德, 马良, 龚文锋. 肝细胞癌根治性治疗后口服维生素K2类似物的Meta分析. 世界华人消化杂志 2012; 20(25): 2420-2426
Revised: July 30, 2012
Accepted: August 6, 2012
Published online: September 8, 2012
AIM: To evaluate the efficacy and safety of oral vitamin K2 (VK2) analogs for patients with hepatocellular carcinoma (HCC) after surgery.
METHODS: Sources such as Chinese National Knowledge Infrastructure, Medline, Embase and Cochrane library were systematically searched. All clinical trials comparing curative treatments alone with curative treatments plus VK2 analogs for HCC patients were identified. Meta-analysis was performed to estimate the effects of VK2 analogs on tumor recurrence and overall survival (OS). Risk ratios (RR) and 95% confidence intervals (95% CI) were calculated.
RESULTS: Six randomized clinical trials and one cohort study involving 930 patients were included. VK2 analogs did not statistically reduced the 1-year tumor recurrence rate, with a pooled RR of 0.67 (95% CI: 0.39-1.13, P = 0.13). However, hepatic resection plus VK2 analogs were associated with significantly lower 2- and 3-year tumor recurrence rates, with pooled RRs of 0.65 (95% CI: 0.51-0.83, P < 0.001) and 0.70 (95% CI: 0.58-0.85, P < 0.001). Moreover, for the 1-, 2-, and 3-year OS, VK2 analogs also demonstrated statistically significant results (RR = 1.03, 95% CI: 1.01-1.05, P = 0.02; RR = 1.11, 95% CI: 1.03-1.19, P = 0.005; RR = 1.14, 95% CI: 1.02-1.28, P = 0.02). Oral VK2 analogs were safe and were not associated with adverse events.
CONCLUSION: Current evidence suggests that postoperative VK2 analogs have appreciable efficacy in patients with HCC after curative treatment.
- Citation: Zhong JH, Li LQ, You XM, Xiang BD, Ma L, Gong WF. Oral vitamin K2 analogs for hepatocellular carcinoma after surgery: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2012; 20(25): 2420-2426
- URL: https://www.wjgnet.com/1009-3079/full/v20/i25/2420.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i25.2420
肝细胞癌(hepatocellular carcinoma, HCC)恶性程度高, 其导致的死亡率位列恶性肿瘤第3位. 手术切除或射频消融(radiofrequency ablation, RFA)治疗肿瘤是目前临床上最常用的根治性治疗方法. 然而, 即使是早期HCC, 根治性术后其复发率仍高达80%[1]. 因此, 术后合理、有效的预防复发的治疗措施是必要的. 目前, 临床上预防HCC术后复发的治疗药物及方法主要有干扰素、经肝动脉化疗栓塞、过继免疫治疗、核苷酸类抗病毒治疗等. 但这些治疗却有很多的局限性, 如不良反应多、只适合存在高危复发因素的患者、不能提高总生存率和缺少高级别循证证据的支持等. 故有必要探讨更安全、有效的治疗方法. 维生素K2类似物(vitamin K2, VK2), 又名四烯甲萘醌, 临床上用于治疗骨质疏松症[2], 但在2004年却被发现有预防合并肝炎肝硬化女性HCC患者的肿瘤复发[3]. 自此, 陆续多个随机对照试验(randomized clinical trials, RCT)报道了VK2类似物预防HCC复发的疗效. 但研究间的结论并不统一, 甚至相反. 本文使用Meta分析的方法将临床同质的多个研究合并分析, 以求统一结论.
检索数据库中国知网、Medline、Embase和Cochrane图书馆, 截止日期到2012-05; 同时对检索到文献的参考文献再进行筛选检索. 英文和中文检索都采用主题词和自由词结合的方式. 英文检索词为liver neoplasms, hepatocellular carcinoma, liver tumor, resectable, operative, resection, hepatectomy, vitamin K, analog和menatetrenone. 中文检索词为肝肿瘤、肝癌、肝切除、手术、维生素K和四烯甲萘醌. 排除重复发表的文献. 按照制定的检索策略进行检索, 最初检索到可能符合纳入标准的文献共344篇. 经阅读题名及摘要后, 排除个案报道、回顾性分析和综述, 剩余18文献.
1.2.1 文献纳入和排除标准: (1)研究类型. HCC根治性切除或RFA术后VK2治疗的RCT, 队列研究及病例对照研究, 发表语种为英文和中文. 对于重复发表或病例有重叠的研究, 将其整合为一个研究; (2)研究对象. 纳入标准: 经病理学或多个影像学证实为原发性HCC的患者; 试验组和对照组患者HCC被根治性治疗(切缘无肉眼癌灶残留; RFA治疗后1 mo复查CT无肿瘤残存). 排除标准: 转移性肝癌或已有肝外转移的患者, 服用VK2前使用过华法林的患者; (3)干预措施. 试验组患者在HCC根治性治疗后接受VK2类似物口服治疗, 对照组为单纯HCC根治性治疗, 排除肿瘤被姑息性切除或切除不完整的研究; (4)结局测量指标: 生存率、复发率.
1.2.2 文献质量评价: 两名评价员参考QUOROM声明[4], 分别独立评价纳入研究偏倚的高低, 分别评价随机分配方法、隐蔽分组、盲法和是否使用意向性分析. 研究中详细描述了3个以上项目的为高质量, 1个都没有描述则为低质量, 其余为中等质量. 非RCT研究的质量被认为低质量.
1.2.3 统计学方法: 两名评价员分别检索、阅读、筛选符合纳入标准的文献, 对文献进行质量评价, 提取相关资料. 计数资料采用相对危险度(risk ratio, RR)及其95%可信区间(confidence interval, CI)表示统计效应量. 采用χ2检验来分析各个研究间的异质性. 以P<0.1为显著性水准, 异质性大小以I2值表示. 采用固定效应模型进行数据分析, 当存在明显异质性时则采用随机效应模型分析. 数据统计学处理采用Cochrane协作网提供的RevMan5.0统计软件进行.
通过阅读全文来筛选, 最终纳入6个RCT[5-10]和1个队列研究[11]进行Meta分析. 纳入的各个研究试验组和对照组基线具有可比性, 共930例患者. 各纳入的研究对于肿瘤复发的标准一致, 肝内复发和肝外转移均视为复发. 各研究的一般资料见表1. 所有研究对象均为日本人. 所有患者均接受根治性HCC切除术或RFA治疗, 在出现复发前均未接受其他针对复发的辅助治疗. 治疗组患者接受口服45 mg或90 mg VK2类似物治疗. Yoshida等[5]的研究只报道了1年的生存数据. Hosho等[11]的队列研究中23例患者接受口服45 mg VK2类似物治疗, 49例配对患者为对照组.
| 文献样本量 | 肿瘤数量 | 平均肿瘤直径(mm) | Child-Pugh 评分(A/B) | HBV(n) | HCV(n) | PIVKA-II (mAU/mL) | AFP (ng/mL) |
| Yoshiji等[6] | |||||||
| 18 | 1.62 | 17.9 | 16/2 | 0 | 15 | 60.2 | 79.8 |
| 25 | 1.59 | 18.7 | 20/5 | 3 | 11 | 41.3 | 88.5 |
| Mizuta等[7] | |||||||
| 32 | 1.50 | 17.7 | 26/6 | 4 | 29 | 41.8 | 102.2 |
| 29 | 1.48 | 19.4 | 22/7 | 3 | 27 | 70.3 | 508 |
| Kakizaki等[8] | |||||||
| 30 | 单个: 19; 多个: 11 | 20.4 | 22/8 | 0 | 30 | ≤40: 10; >40: 20 | ≤20: 15; ≥20: 15 |
| 30 | 单个: 22; 多个: 8 | 25.0 | 22/8 | 0 | 30 | ≤40: 8; >40: 22 | ≤20: 16; ≥20: 14 |
| Hotta等[9] | |||||||
| 21 | 单个: 11; 多个: 10 | 11-30: 18; 31-50: 3 | 15/6 | 6 | 14 | <40: 14; ≥40: 7 | <20: 6; ≥20: 15 |
| 24 | 单个: 9; 多个: 15 | 11-30: 18; 31-50: 6 | 12/12 | 3 | 19 | <40: 9; ≥40: 15 | <20: 9; ≥20: 15 |
| Yoshida等[5] | |||||||
| 367 | 单个: 260; 多个: 107 | 20 | 323/44 | 38 | 305 | <40: 328; ≥40: 36 | <100: 344; ≥100: 22 |
| 181 | 单个: 127; 多个: 54 | 20.3 | 154/27 | 20 | 150 | <40: 155; ≥40: 25 | <100: 164; ≥100: 17 |
| Kubota等[10] | |||||||
| 50 | - | 最大: 41 | - | 14 | 46 | 66 | - |
| 51 | - | 最大: 36 | - | 17 | 45 | 106 | - |
| Hosho等[11] | |||||||
| 23 | 1.3 | 最大: 23 | - | 8 | 16 | 1182.9 | 382.6 |
| 49 | 1.4 | 最大: 28 | - | 15 | 33 | 2421.3 | 226.8 |
依据QUOROM文献的评价标准, 对纳入试验的方法学质量进行评价(表2).
各个研究的生存数据见表3. 对照组患者的术后3年复发率为67.6%-91.6%, 总生存率为56.5%-88.0%.
| 文献干预措施 | 治疗(手术切除/射频消融) | 随访时间(mo) | 复发率(%) | 总生存率(%) | ||||
| 1年 | 2年 | 3年 | 1年 | 2年 | 3年 | |||
| Yoshiji等[6] | ||||||||
| VK2(45 mg) | 0/18 | 48.0 | 22.2 | 44 | 61.1 | 100 | 94.4 | 88.9 |
| 对照组 | 0/25 | 48.0 | 24.0 | 48.0 | 68.0 | 100 | 92.0 | 88.0 |
| 培哚普利+VK2(45 mg) | 0/25 | 48.0 | 12.0 | 28.0 | 32.0 | 100 | 100 | 96.0 |
| 培哚普利 | 0/19 | 48.0 | 15.8 | 36.8 | 52.6 | 100 | 94.7 | 89.5 |
| Mizuta等[7] | ||||||||
| VK2(45 mg) | 1/31 | 28.9 | 12.5 | 39.0 | 64.3 | 100 | 96.6 | 87.0 |
| 对照组 | 3/26 | 27.7 | 55.2 | 83.2 | 91.6 | 96.4 | 80.9 | 64.0 |
| Kakizaki等[8] | ||||||||
| VK2(45 mg) | 4/26 | - | 7.7 | 51.4 | 61.2 | 100 | 95.0 | 77.5 |
| 对照组 | 7/23 | - | 28.3 | 64.1 | 90.1 | 95.8 | 90.2 | 66.4 |
| Hotta等[9] | ||||||||
| VK2(45 mg) | 2/19 | 19.5 | 23.8 | 28.6 | - | 100 | 100 | - |
| 对照组 | 2/22 | 16.5 | 33.3 | 46.5 | 73.3 | 87.5 | 81.7 | 81.7 |
| Yoshida等[5] | ||||||||
| VK2(45 mg) | 9/173 | 36 | 31.2 | - | - | 99.2 | - | - |
| VK2(90 mg) | 5/180 | 36 | 37.7 | - | - | 98.7 | - | - |
| 对照组 | 7/174 | 36 | 28.2 | - | - | 97.2 | - | - |
| Kubota等[10] | ||||||||
| VK2(45 mg) | 50/0 | - | 20.6 | 36.9 | 43.6 | - | - | - |
| 对照组 | 51/0 | - | 30.0 | 52.0 | 76.1 | - | - | - |
| Hosho等[11] | ||||||||
| VK2(45 mg) | 2/21 | 23.8 | 26.1 | 32.8 | 78.1 | 100 | 93.3 | 85.6 |
| 对照组 | 7/42 | 26.9 | 49.0 | 61.7 | 67.6 | 93.3 | 79.1 | 56.5 |
2.3.1 肿瘤复发率: 7个研究均报道了术后1年的复发率. 异质性检验发现各研究间存在一定的统计学异质性(P = 0.01, I2 = 64%), 故使用随机效应模型进行统计. 结果显示, HCC根治性术后患者口服VK2类似物并不能降低术后1年复发率(RR = 0.67, 95%CI: 0.39-1.13, P = 0.13). 然而, 固定效应模型显示, 术后2年及3年复发率显著降低(RR = 0.65, 95%CI: 0.51-0.83, P<0.001; RR = 0.70, 95%CI: 0.58-0.85, P<0.001), 见图1.
2.3.2 总生存率: 研究间同质性较好(P = 0.48, I2 = 0%), 使用固定效应模型, 统计分析发现, HCC根治性术后患者口服VK2类似物提高了术后1年总生存率(RR = 1.03, 95%CI: 1.01-1.05, P = 0.02). 统计术后2年及3年总生存率时, 研究间同质性较好(P = 0.55, I2 = 0%; P = 0.40, I2 = 0%), 统计结果显示治疗组患者总生存率显著高于对照组(RR = 1.11, 95%CI: 1.03-1.19, P = 0.005; RR = 1.14, 95%CI: 1.02-1.28, P = 0.02, 图2).
为了检验非RCT研究对合并结果的可靠性, 排除队列研究重新合并分析, 发现在复发率和1年、2年总生存率方面, 结果并没有改变. 但是术后3年总生存率无统计学意义(RR = 0.12, 95%CI: 0.97-1.28, P = 0.12).
所有7个研究均报道口服VK2类似物安全, 无明显不良反应及血液生化异常改变.
Chu等[12]曾报道认为口服VK2类似物对根治性手术切除或射频消融治疗的HCC患者有一定的预防复发作用, 然而, 最近的一个大样本多中心RCT[5]却否定这一结论. 为了进一步明确VK2类似物在HCC术后应用的价值, 本文纳入所有RCT和队列研究进行Meta分析, 结果显示, VK2类似物显著降低术后2年和3年复发率, 同时提高术后1、2和3年总生存率. 口服VK2类似物安全.
VK2是一种γ-羧基酶的辅酶. VK缺乏或拮抗剂Ⅱ(PIVKA-Ⅱ)诱导了右旋-γ-羧基-凝血酶原的产生, 他是肝脏合成的无凝血活性的异常凝血酶原, 在HCC患者的血清中异常升高. 很多研究认为术前血清中PIVKA-Ⅱ滴度升高是HCC患者预后不良的因素之一[13-15], 主要原因为PIVKA-Ⅱ刺激了人类血管内皮细胞的生长和转移[16]. 因此, VK2抑制HCC细胞系生长的机制为通过抑制或激活某些信号通路的调节[17-20]. 虽然VK2诱导细胞周期停止和抑制生长的准确机制尚未完全明确, VK2类似物治疗的基本原理是为了预防HCC根治性治疗后余肝发生新的肿瘤. 而术后辅助治疗(如经肝动脉化疗栓塞)的目的是为了杀灭术前影像学未能发现的肿瘤及术中脱落的肿瘤细胞, 术后辅助治疗并不能预防余肝在长期生存中发生新的肿瘤. 因此, 为了达到术后长期的无瘤状态, 使用VK2类似物化学预防余肝新发肿瘤是有必要的.
本文共纳入了7个研究, 所有患者均接受HCC根治性手术切除或RFA治疗, 肿瘤均被根治性治疗. 其中, 接受RFA治疗的HCC患者占84%(780/930). RFA治疗通过多个途径激活自然杀伤细胞的活性[21]. 大多数患者为单个肿瘤, 肿瘤直径为1.1-5.0 cm, 多<2 cm. 因此, 这些患者的早期复发不良因素(如血管侵犯、多个肿瘤结节、肿瘤直径>5 cm等)较少. 也就是说, 理论上本文纳入的患者的肿瘤复发时间应该多发生于术后2年之后; 另一方面, VK2类似物主要为了预防肿瘤多中心复发. 这两方面因素应该是本文不能得出VK2类似物降低术后1年复发率的原因. 理论上, 低复发率患者的总生存率应该更高, 生存时间应该更长, 但由于纳入研究的观察随访时间较短(<36 mo), 目前资料尚不能得出VK2类似物的长期疗效.
所有7个研究均在日本进行, 纳入的患者多合并丙型肝炎(83%), 因此, VK2类似物应用于其他人群或乙型肝炎患者的疗效尚未明确. 基于中国人群和日本人群肝癌标本的基础研究认为, VK2类似物通过抑制或激活某些信号通路来预防余肝发生新的肿瘤[18-20]. 因此, 在中国人群开展类似临床研究的临床疗效可能与Meta分析结果相似.
Meta分析结果显示, VK2类似物较对症支持治疗显著提高术后总生存率. 然而, 纳入的7个研究和纳入4个研究的系统综述[12]均未观察到相似结果. 早期RCT结果[7,8]显示VK2类似物显著降低HCC术后复发率, 但最近的RCT[5]却认为治疗组和对照组的无瘤生存率相似. 这些相互矛盾的结果说明, 大样本的临床研究或Meta分析是有必要开展的.
本文为二次研究, 存在一定的局限性. 如并非所有研究均详细报道了随机分配方法和使用隐蔽分组, 故不能排除选择性和实施偏倚的可能. 只有一个研究在设计阶段使用了样本量估算, 使用意向性分析的研究也只有两个. 更重要的是, VK2类似物的主要目的是预防余肝发生新的肿瘤, 而新生肿瘤发生时间多>2年, 因此, 足够长的随访时间是必须的, 但纳入文献的随访时间均较短; 另一方面, 纳入的研究中存在手术切除与RFA两种方法进行HCC的根治. 这两种治疗方法本身可能对肿瘤复发有不同的影响. 因此, 对本文的结果和结论的解释尚需保持一定的慎重. 长期的随访也许能观察到VK2类似物的显著疗效.
Meta分析结果显示, VK2类似物应用于HCC根治性治疗后对降低复发率和提高总生存率均有一定的疗效. 另外, 口服VK2类似物是安全的. 由于不同患者的复发因素不同, 复发类型和复发时间亦有差异, 针对不同患者的不同方案联合治疗模式是未来研究的方向和热点.
肝细胞癌根治性治疗术后复发率高. 目前尚无标准、具有明确疗效的预防术后肿瘤复发的辅助治疗措施. 肝癌术后口服维生素K2类似物预防复发的报道较多, 但各研究间报道的疗效存在一定的争议. 故本研究使用Meta分析的方法对其疗效进行进一步的评估.
孙星, 副教授, 副主任医师, 上海交通大学附属第一人民医院普外科
目前尚无Meta分析专门评估维生素K2类似物预防肝细胞性肝癌术后复发的疗效.
维生素K2类似物临床上用于治疗骨质疏松症, 2004年被发现有预防合并肝炎肝硬化女性HCC患者的肿瘤复发的作用.
本文检索了维生素K2类似物预防肝细胞癌根治性术后肿瘤复发疗效的相关文章, 纳入所有临床对照研究, 运用Meta分析的方法评估其疗效. 较之前的系统评价扩大了样本量, 得出的结论更可靠.
本研究表明, 辅助VK2类似物治疗对降低肝细胞癌患者根治性术后复发率及提高总生存率有一定的疗效. 但由于纳入研究的随访时间较短, 有必要开展大样本长期随访的随机对照试验进一步证实其疗效.
该研究具有一定的新颖性和临床意义, 对于肝细胞癌根治术后的肿瘤复发和术后生存进行了较为细致的分层分析, 具有一定的临床价值.
编辑: 张姗姗 电编:鲁亚静
| 1. | Lang H, Sotiropoulos GC, Brokalaki EI, Schmitz KJ, Bertona C, Meyer G, Frilling A, Paul A, Malagó M, Broelsch CE. Survival and recurrence rates after resection for hepatocellular carcinoma in noncirrhotic livers. J Am Coll Surg. 2007;205:27-36. [PubMed] [DOI] |
| 2. | Prabhoo R, Prabhoo TR. Vitamin K2: a novel therapy for osteoporosis. J Indian Med Assoc. 2010;108:253-254. [PubMed] |
| 3. | Habu D, Shiomi S, Tamori A, Takeda T, Tanaka T, Kubo S, Nishiguchi S. Role of vitamin K2 in the development of hepatocellular carcinoma in women with viral cirrhosis of the liver. JAMA. 2004;292:358-361. [PubMed] [DOI] |
| 4. | Moher D, Cook DJ, Eastwood S, Olkin I, Rennie D, Stroup DF. Improving the quality of reports of meta-analyses of randomised controlled trials: the QUOROM statement. QUOROM Group. Br J Surg. 2000;87:1448-1454. [PubMed] [DOI] |
| 5. | Yoshida H, Shiratori Y, Kudo M, Shiina S, Mizuta T, Kojiro M, Yamamoto K, Koike Y, Saito K, Koyanagi N. Effect of vitamin K2 on the recurrence of hepatocellular carcinoma. Hepatology. 2011;54:532-540. [PubMed] [DOI] |
| 6. | Yoshiji H, Noguchi R, Toyohara M, Ikenaka Y, Kitade M, Kaji K, Yamazaki M, Yamao J, Mitoro A, Sawai M. Combination of vitamin K2 and angiotensin-converting enzyme inhibitor ameliorates cumulative recurrence of hepatocellular carcinoma. J Hepatol. 2009;51:315-321. [PubMed] [DOI] |
| 7. | Mizuta T, Ozaki I, Eguchi Y, Yasutake T, Kawazoe S, Fujimoto K, Yamamoto K. The effect of menatetrenone, a vitamin K2 analog, on disease recurrence and survival in patients with hepatocellular carcinoma after curative treatment: a pilot study. Cancer. 2006;106:867-872. [PubMed] [DOI] |
| 8. | Kakizaki S, Sohara N, Sato K, Suzuki H, Yanagisawa M, Nakajima H, Takagi H, Naganuma A, Otsuka T, Takahashi H. Preventive effects of vitamin K on recurrent disease in patients with hepatocellular carcinoma arising from hepatitis C viral infection. J Gastroenterol Hepatol. 2007;22:518-522. [PubMed] [DOI] |
| 9. | Hotta N, Ayada M, Sato K, Ishikawa T, Okumura A, Matsumoto E, Ohashi T, Kakumu S. Effect of vitamin K2 on the recurrence in patients with hepatocellular carcinoma. Hepatogastroenterology. 2007;54:2073-2077. [PubMed] |
| 10. | Kubota K, Sawada T, Kita J, Shimoda M, M K. Effect of menatetrenone, a vitamin K2 analog, on recurrence of hepatocellular carcinoma after surgical resection Final results of randomized controlled study. Eur J Cancer. 2011;47 Supple 1:S470. [DOI] |
| 11. | Hosho K, Okano J, Koda M, Murawaki Y. Vitamin K2 has no preventive effect on recurrence of hepatocellular carcinoma after effective treatment. Yonago Acta medica. 2008;51:95-99. |
| 12. | Chu KJ, Lai EC, Yao XP, Zhang HW, Lau WY, Fu XH, Lu CD, Shi J, Cheng SQ. Vitamin analogues in chemoprevention of hepatocellular carcinoma after resection or ablation--a systematic review and meta-analysis. Asian J Surg. 2010;33:120-126. [PubMed] [DOI] |
| 13. | Sakaguchi T, Suzuki S, Morita Y, Oishi K, Suzuki A, Fukumoto K, Inaba K, Nakamura S, Konno H. Impact of the preoperative des-gamma-carboxy prothrombin level on prognosis after hepatectomy for hepatocellular carcinoma meeting the Milan criteria. Surg Today. 2010;40:638-645. [PubMed] [DOI] |
| 14. | Takahashi S, Kudo M, Chung H, Inoue T, Ishikawa E, Kitai S, Tatsumi C, Ueda T, Nagai T, Minami Y. PIVKA-II is the best prognostic predictor in patients with hepatocellular carcinoma after radiofrequency ablation therapy. Oncology. 2008;75 Suppl 1:91-98. [PubMed] [DOI] |
| 15. | Kim HS, Park JW, Jang JS, Kim HJ, Shin WG, Kim KH, Lee JH, Kim HY, Jang MK. Prognostic values of alpha-fetoprotein and protein induced by vitamin K absence or antagonist-II in hepatitis B virus-related hepatocellular carcinoma: a prospective study. J Clin Gastroenterol. 2009;43:482-488. [PubMed] [DOI] |
| 16. | Bertino G, Ardiri AM, Calvagno GS, Bertino N, Boemi PM. Prognostic and diagnostic value of des-γ-carboxy prothrombin in liver cancer. Drug News Perspect. 2010;23:498-508. [PubMed] |
| 17. | Nakamura M, Nagano H, Noda T, Wada H, Ota H, Damdinsuren B, Marubashi S, Miyamoto A, Takeda Y, Doki Y. Vitamin K2 has growth inhibition effect against hepatocellular carcinoma cell lines but does not enhance anti-tumor effect of combination treatment of interferon-alpha and fluorouracil in vitro. Hepatol Res. 2006;35:289-295. [PubMed] [DOI] |
| 18. | Li L, Qi Z, Qian J, Bi F, Lv J, Xu L, Zhang L, Chen H, Jia R. Induction of apoptosis in hepatocellular carcinoma Smmc-7721 cells by vitamin K(2) is associated with p53 and independent of the intrinsic apoptotic pathway. Mol Cell Biochem. 2010;342:125-131. [PubMed] [DOI] |
| 19. | Azuma K, Urano T, Ouchi Y, Inoue S. Vitamin K2 suppresses proliferation and motility of hepatocellular carcinoma cells by activating steroid and xenobiotic receptor. Endocr J. 2009;56:843-849. [PubMed] [DOI] |
| 20. | Ozaki I, Zhang H, Mizuta T, Ide Y, Eguchi Y, Yasutake T, Sakamaki T, Pestell RG, Yamamoto K. Menatetrenone, a vitamin K2 analogue, inhibits hepatocellular carcinoma cell growth by suppressing cyclin D1 expression through inhibition of nuclear factor kappaB activation. Clin Cancer Res. 2007;13:2236-2245. [PubMed] [DOI] |
| 21. | Zerbini A, Pilli M, Laccabue D, Pelosi G, Molinari A, Negri E, Cerioni S, Fagnoni F, Soliani P, Ferrari C. Radiofrequency thermal ablation for hepatocellular carcinoma stimulates autologous NK-cell response. Gastroenterology. 2010;138:1931-1942. [PubMed] [DOI] |