修回日期: 2012-07-29
接受日期: 2012-08-06
在线出版日期: 2012-09-08
目的: 研究Cullin1在胃癌细胞及胃癌组织中的表达, 并分析Cullin1、临床分期与患者生存率之间的相关性.
方法: 采用Western blot法检测SGC-7901、BGC-823胃癌细胞与正常胃黏膜上皮细胞GES-1中、胃癌组织与癌旁组织中Cullin1蛋白表达差异. 我们利用已经构建的胃癌数据库, 采用免疫组织化学法检测792例胃癌组织中Cullin1表达.
结果: 我们研究发现, SGC-7901、BGC-823胃癌细胞中Cullin1表达水平均高于胃上皮细胞株GES-1(P<0.01). 胃癌组织中Cullin1蛋白表达水平均高于癌旁组织(P<0.01). Cullin1过表达与胃癌TNM分期(P = 0.011)、浸润深度(P = 0.035, T1-T3与T4)及淋巴结转移(P = 0.036)显著相关. 此外, 我们发现Cullin1的高表达与胃癌患者较差的总生存时间及3年生存率明显相关(P = 0.042, 0.026). Cox回归分析显示, Cullin1表达是胃癌患者3年生存率的一个独立的预后因子(P = 0.028).
结论: 我们的数据表明, Cullin1可作为胃癌淋巴结转移、预后以及潜在治疗的一个重要标志和研究目标.
引文著录: 王维民, 周苏君, 顾贤成, 谈永飞, 葛志军, 周建伟, 周炎. Cullin1蛋白在胃癌中的表达及临床意义. 世界华人消化杂志 2012; 20(25): 2388-2392
Revised: July 29, 2012
Accepted: August 6, 2012
Published online: September 8, 2012
AIM: To examine the expression of Cullin 1 protein in gastric cancer cells and tissues and to analyze the correlation between Cullin 1 protein expression and clinicopathologic variables and patient survival.
METHODS: Cullin 1 protein expression in BGC-823, SGC-7901, and GES-1 cells was determined by Western blot. In addition, we constructed a tissue microarray that included 792 primary gastric cancer tissues and evaluated Cullin 1 expression in tumor biopsies by immunohistochemistry.
RESULTS: Cullin 1 protein expression levels were higher in BGC-823 and SGC-7901 cells than in GES-1 cells (both P < 0.01), and in gastric cancer tissues than in adjacent tissues (P < 0.01). Cullin 1 overexpression was significantly correlated with TNM stage (P = 0.011), depth of invasion (P = 0.035, T1-T3 vs T4), and lymph node metastasis (P = 0.036). Furthermore, we found a strong correlation between high Cullin 1 expression and worse overall and 3-year survival rates in gastric cancer patients (P = 0.042, 0.026). Cox regression analysis revealed that Cullin 1 expression was an independent prognostic factor predicting 3-year outcome in patients with gastric cancer (P = 0.028).
CONCLUSION: Cullin 1 may be an important marker for lymph node metastasis and prognosis in gastric cancer, representing a potential treatment target for this malignancy.
- Citation: Wang WM, Zhou SJ, Gu XC, Tan YF, Ge ZJ, Zhou JW, Zhou Y. Clinical significance of Cullin 1 protein expression in gastric cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(25): 2388-2392
- URL: https://www.wjgnet.com/1009-3079/full/v20/i25/2388.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i25.2388
胃癌是世界上最常见的恶性肿瘤中之一. 虽然他的发病率一直缓慢下降, 但依然是全球第2大癌症死因[1]. 胃癌患者的5年生存率只有20%左右, 高死亡率与其转移密切相关[2]. 肿瘤的侵袭转移是几个连续的步骤, 包括增殖、侵袭、脱离, 进入淋巴结和血管移植, 粘附和外渗进入靶器官, 从而再增殖[3]. 细胞内各种功能蛋白如原癌蛋白、抑癌蛋白等动态影响到细胞周期进程. 这些蛋白在细胞内水平的高低, 机制之一是受泛素-蛋白酶体降解途径的精细调控[4,5]. 该酶系催化蛋白质水解过程包含泛素活化酶(E1)、泛素轭合酶(E2)和泛素连接酶(E3). 泛素连接酶主要有2个家族, 即HECT家族和RING家族, 其中后者以Cullin蛋白作为模板装配成. 作为Cullin蛋白代表性成员, Cullin1所组装的复合体具有典型的泛素连接酶活性, 介导许多细胞周期与相关的功能蛋白尤其是癌相关蛋白的降解过程, 有效地调节着细胞周期进程. Cullin1是细胞周期结束的必需调控因子, 其异常变化可能在肿瘤发生过程中起重要作用. 本课题组主要研究SGC-7901、BGC-823胃癌细胞与正常胃黏膜上皮细胞GES-1中、胃癌组织与癌旁组织中Cullin1蛋白表达差异; 利用已经构建的胃癌患者临床数据库测定Cullin1蛋白表达, 并分析与胃癌临床分期相关性, 以提供胃癌预后的可预测指标.
胃癌细胞株SGC-7901、BGC-823及胃上皮细胞株GES-1均由南京医科大学公共卫生学院分子毒理实验室提供. 胃癌组织及癌旁组织由江苏大学附属宜兴医院普外科提供. RPMI 1640细胞培养基(gibco公司), 胎牛血清(杭州四季春公司), 胰蛋白酶(sigma), RIPA裂解液、BCA试剂盒(碧云天), Cullin1单抗(epitomics公司), 二抗(碧云天), β-actin(碧云天), 电泳仪、转膜仪、酶标仪(美国伯乐).
1.2.1 细胞培养: 上述细胞株均于培养皿中贴壁生长, 用含100 mL/L胎牛血清、100 U/mL青霉素和100 mg/L链霉素的RPMI 1640(DMEM)培养基, 置37 ℃、50 mL/L CO2培养箱中培养. 待细胞长至约占80%培养皿时, 用胰酶消化贴壁细胞, 收集到离心管中, 3 000 r/min离心5 min, 弃去上清待用.
1.2.2 胃癌组织与癌旁组织标本收集: 胃癌患者手术切除的胃癌组织和癌旁组织. 癌组织取自肿瘤中心处, 癌旁组织取自距肿瘤边缘至少10 cm处. 所有病例均经组织病理学诊断确诊, 均无其他部位原发肿瘤, 术前无化疗、放疗和免疫治疗史. 标本取材后, 立即置于液氮中速冻, 然后转到-80 ℃冰箱内保存.
1.2.3 利用BCA法测定胃癌组织与癌旁组织、胃癌细胞与胃正常上皮细胞总蛋白浓度: 用RIPA裂解液并匀浆处理胃癌组织和癌旁组织, 提取组织中总蛋白, 操作均在冰上进行. 收集胃癌细胞SGC-7901、BGC-823及胃上皮细胞株GES-1, 用预冷的PBS洗2遍, 再加入RIPA裂解液, 充分混匀, 放入4 ℃冰箱半小时. 然后在4 ℃低温下离心15 min, 吸取上清. 将上述2种上清液根据BCA蛋白测量试剂盒说明书操作, 测出总蛋白浓度.
1.2.4 Western blot测定Cullin1蛋白表达: 取100 µg总蛋白进行7.5% SDS-PAGE凝胶电泳分析, 电泳结束后转移蛋白至PVDF膜上, 含5%脱脂奶粉的TBST液中室温封闭2 h, 用TBST清洗5遍, 每次5 min, 然后加入1:1 000稀释特异性一抗(兔抗人Cullin1), 4 ℃孵育过夜; 次日用TBST液洗膜5次, 每次5 min, 然后加入相应二抗(1:1 000), 室温孵育4 h, 再用TBST液洗膜10次, 每次5 min. DAB显色后, 再上机检测. 实验均重复3遍.
1.2.5 构建1 022例胃癌组织标本库: 1999-01-01/2006-12-31由我院收集1 022例胃癌组织标本库. 患者的基本信息[包括性别、年龄、病情、病理分期(TNM)及有无远处转移等]均能详细提供.
1.2.6 建立胃癌组织芯片检测Cullin1蛋白的表达: 胃癌组织芯片合同委托生物芯片上海国家工程研究中心构建, 从排序的石蜡瘤块中心和相对应的癌旁组织处取直径1.0 mm肿瘤组织. 作为组织对照, 正常胃黏膜上皮细胞活检组织被插入每张芯片的四角和中心. 用标准的操作程序, 检测胃癌组织芯片中Cullin1蛋白表达. 胃癌组织芯片在55 ℃下, 作用20 min, 然后用由二甲苯清洗脱蜡3次, 每次约5 min; 再分别用无水乙醇、950 mL/L、800 mL/L的乙醇和蒸馏水清洗, 每次约5 min; 样品在10 mmol/L的柠檬酸钠(pH 6.0)内, 95 ℃下加热30 min进行抗原修复; 在3%的过氧化氢孵化30 min, 以阻断内源性过氧化物酶活性; 用血清封闭30 min, 用鼠源性单克隆抗体Cullin1(1:50稀释)与样品切片孵育, 在4 ℃条件下过夜; 然后与相应的二抗结合30 min; 再通过3,3'-二氨基基板, 进行苏木红染色; 然后进行脱水的程序, 样品切片用盖玻片密封. 阴性对照组省略Cullin1抗体孵化. 在每个芯片的样品切片上, 正常胃黏膜上皮组织的染色被评定为染色的质量标准. 免疫组织染色结果判定: Cullin1染色等级采用免疫染色评分(IRS)[6], 以染色强度乘以阳性细胞百分比计算. 根据IRS, Cullin1染色被分为: 阴性(IRS: 0), 弱(IRS: 1-2), 中度(IRS: 3-6), 强(IRS: 8-12).
统计学处理 Fisher精确检验评价Cullin1与临床参数间的相关性. Kaplan-Meier方法绘制生存曲线, log-rank检验比较生存率. 单因素和多因素Cox比例风险模型分析患者生存率的相关影响因素. 所有统计检验均为双侧检验, 以P≤0.05为有统计学差异.
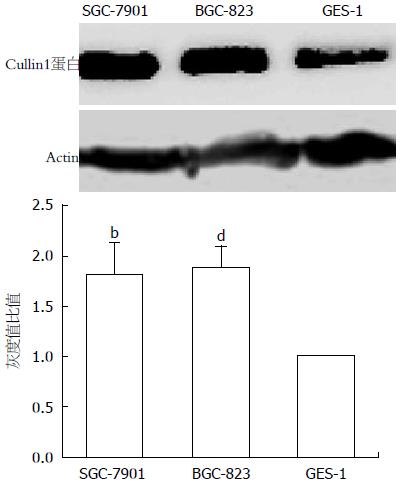
Cullin1蛋白在胃癌细胞SGC-7901、BGC-823中表达水平均高于胃上皮细胞株GES-1. 采用图像分析系统进行半定量分析, 与胃正常黏膜细胞GES-1相比, SGC-7901、BGC-823中Cullin1蛋白表达量分别上调71.18%、71.64%, 差异均具有统计学意义(P<0.01, 图1).
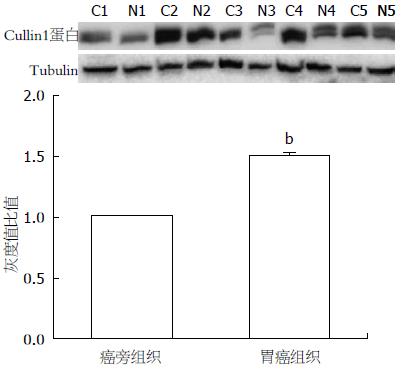
5例胃癌组织中Cullin1蛋白表达水平均高于癌旁组织. 采用图像分析系统进行半定量分析, C1-C5中Cullin1的表达量较N1-N5分别上调43.60%、47.16%、52.33%、34.84%、65.02%, 差异均具有统计学意义(P<0.01, 图2).
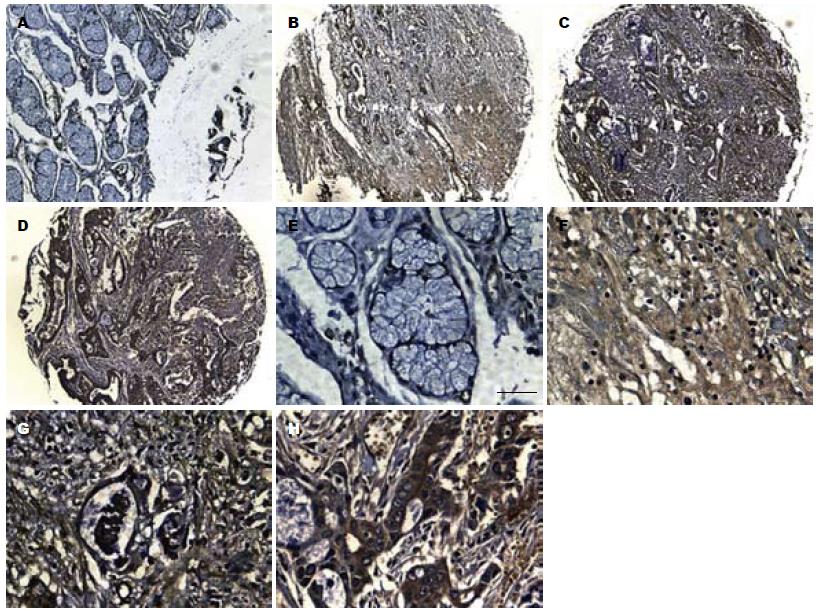
由于抗原修复过程丢失抗原或未夹对肿瘤组织, 1 022例胃癌组织芯片可供分析792例, 根据胃癌TNM分期,Ⅰ期182例、Ⅱ期180例、Ⅲ期397例、Ⅳ期23例. Ⅲ期和Ⅳ期胃癌组织Cullin1染色比Ⅰ、Ⅱ期胃癌组织明显加强(P = 0.011, 图3). 因为TNM分期与浸润程度、淋巴结转移均密切相关, 我们进一步分析Cullin1表达与两者的关系. 结果显示: Cullin1表达与浸润深度(P = 0.035)及淋巴结转移(P = 0.036). 根据随访数据分析: Cullin1高表达患者在总生存期及3年生存期均明显低于Cullin1低表达患者(P = 0.042和P = 0.026). Cox回归分析显示, Cullin1表达是胃癌患者3年生存的一个独立预后因子(P = 0.028).
Cullin1是Cullin基因组中的一个成员, 泛素连接酶复合体的核心成分, 对细胞周期起调控作用, 与多种恶性肿瘤的发生、发展密切相关. 人类Cullin1定位于3号染色体上, 具有6个外显子和5个内含子, 且包含780个氨基酸残基. Cullin1所组装的蛋白复合体称SCF(skp1-cul1-F box protein), 是一个多亚基蛋白复合物. SCF能泛素化多种蛋白因子如P27、P21、P57及细胞周期素等, Cullin1蛋白作为SCF复合体骨架蛋白可起到模板作用, 其结构的变化会引起泛素连接酶复合物活性的变化, 使许多细胞内的底物蛋白的降解水平发生改变.
近年来, 国内外学者研究发现, Cullin1蛋白表达水平与一些恶性肿瘤生物学行为及预后密切相关. Chen等[7]研究得出Cullin1蛋白表达与黑色素瘤细胞生长成正相关. 其机制是通过SCFSkp2下调P27蛋白, 促进黑色素瘤细胞增殖. 有报道认为Cullin1通过与泛素样小分子NEDD8共价连接而被修饰, 在哺乳动物细胞中一个完整的NEDD8通路需要Cullinl依赖的泛素化作用[8]. 丢失Cullinl可导致早期的胚胎死亡和cyclin E的调节异常[9]. 细胞核激素受体-雌激素受体ERα在乳腺癌具有广泛调节基因表达及增殖程序, 他的缺失导致乳腺癌内分泌治疗不敏感. ERα缺失主要被SCFSkp2介导的泛素化降
解[10]. 在食管鳞癌组织中SCFSkp2蛋白表达与肿瘤分期、淋巴结转移成正相关(P<0.05); 与接受放疗患者的总生存期成负相关(P<0.05), 其主要分子机制是SCFSkp2蛋白能提高食管鳞癌细胞对放疗的耐受性[11]. 另有研究证实NEDD8可通过抑制SCF复合物酶的活性, 从而阻滞细胞周期进程[12]. 在LNCaP前列腺癌细胞中, 研究雄激素敏感相关性miRNA, 发现miR-148a能降低Cullin1构建的CAND1复合物表达, 抑制SCF泛素酶活性, 从而抑制前列腺癌细胞生长[13]. Kong等[14]研究证实由Cullin1参与组成的CAC1蛋白, 能够提高细胞周期蛋白依赖性激酶CKD2活性, 促进细胞增殖. Chen等[15]发现由Cullin1组装SCF绑定的FBXL2蛋白, 其发生突变能通过泛素化作用于钙调蛋白, 从而使细胞周期素D3表达下降, 最终导致并诱导肺癌细胞凋亡. SCF(Fbw7)蛋白属于SKP1-CUL1-F-box构建的具有乏素酶功能的复合物, 具有抑癌基因功能. 他主要能影响细胞周期进程、细胞增殖、分化、DNA损伤反应等[16]. 相关研究表明[17], 在肿瘤细胞G1期向S期过渡时, miR-27a能抑制细胞中SCF(Fbw7)蛋白表达, 从而导致肿瘤细胞生长.
本研究显示, 胃癌细胞及胃黏膜上皮细胞内、胃癌及其癌旁组织中均可检测Cullin1蛋白的表达, 且胃癌细胞、胃癌组织中Cullin1蛋白的表达水平明显高于胃黏膜上皮细胞、癌旁组织(P<0.01). Cullin1蛋白表达与胃癌患者临床TNM分期、浸润程度及淋巴结转移均有明显相关(P<0.05). 这提示Cullin1蛋白与胃癌的恶性度密切相关. Cullin1蛋白可作为评估胃癌预后的参考指标. 但该蛋白在胃癌组织中表达的分子机制及其生物学特征, 以及他在其他肿瘤领域中的作用, 尚需进一步探讨.
Cullin1所组装的复合体具有典型的泛素连接酶活性, 介导许多与细胞周期相关的功能蛋白尤其是癌相关蛋白的降解过程, 有效地调节着细胞周期进程. 该蛋白是细胞周期结束的必需调控因子, 其异常变化可能在肿瘤发生过程中起重要作用.
欧希龙, 副教授, 东南大学中大医院消化科
Chen等研究得出Cullin1蛋白表达与黑色素瘤细胞生长正相关. 其机制是通过SCFSkp2下调P27蛋白, 促进黑色素瘤细胞增殖; 有报道认为Cullin1通过与泛素样小分子NEDD8共价连接而被修饰, 在哺乳动物细胞中一个完整的NEDD8通路需要Cullinl依赖的泛素化作用.
本文研究Cullin1在胃癌细胞及胃癌组织中的表达, 并分析Cullin1、临床分期与患者的生存率之间的相关性.
Cullin1蛋白与胃癌的恶性度密切相关, 该蛋白可作为评估胃癌预后的参考指标.
泛素链接酶: 一个能够将泛素分子连接到目的蛋白质某个赖氨酸上的酶. 通常情况下, 泛素链接酶可以将目的蛋白质多泛素化, 即加上多个泛素分子, 形成多泛素链; 而带有多泛素链的蛋白质就可以被蛋白酶体所识别, 从而被降解.
本文设计新颖, 实验科学, 标本数大, 结果有说服力.
编辑: 张姗姗 电编:鲁亚静
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 2. | Yoo CH, Noh SH, Shin DW, Choi SH, Min JS. Recurrence following curative resection for gastric carcinoma. Br J Surg. 2000;87:236-242. [PubMed] [DOI] |
| 3. | Hynes RO. Metastatic potential: generic predisposition of the primary tumor or rare, metastatic variants-or both? Cell. 2003;113:821-823. [PubMed] [DOI] |
| 4. | Bernassola F, Karin M, Ciechanover A, Melino G. The HECT family of E3 ubiquitin ligases: multiple players in cancer development. Cancer Cell. 2008;14:10-21. [PubMed] [DOI] |
| 5. | Yang H, Landis-Piwowar KR, Chen D, Milacic V, Dou QP. Natural compounds with proteasome inhibitory activity for cancer prevention and treatment. Curr Protein Pept Sci. 2008;9:227-239. [PubMed] [DOI] |
| 6. | Simon R, Richter J, Wagner U, Fijan A, Bruderer J, Schmid U, Ackermann D, Maurer R, Alund G, Knönagel H. High-throughput tissue microarray analysis of 3p25 (RAF1) and 8p12 (FGFR1) copy number alterations in urinary bladder cancer. Cancer Res. 2001;61:4514-4519. [PubMed] |
| 7. | Chen G, Li G. Increased Cul1 expression promotes melanoma cell proliferation through regulating p27 expression. Int J Oncol. 2010;37:1339-1344. [PubMed] |
| 8. | Ohh M, Kim WY, Moslehi JJ, Chen Y, Chau V, Read MA, Kaelin WG. An intact NEDD8 pathway is required for Cullin-dependent ubiquitylation in mammalian cells. EMBO Rep. 2002;3:177-182. [PubMed] [DOI] |
| 9. | Dealy MJ, Nguyen KV, Lo J, Gstaiger M, Krek W, Elson D, Arbeit J, Kipreos ET, Johnson RS. Loss of Cul1 results in early embryonic lethality and dysregulation of cyclin E. Nat Genet. 1999;23:245-248. [PubMed] [DOI] |
| 10. | Bhatt S, Xiao Z, Meng Z, Katzenellenbogen BS. Phosphorylation by p38 mitogen-activated protein kinase promotes estrogen receptor α turnover and functional activity via the SCF(Skp2) proteasomal complex. Mol Cell Biol. 2012;32:1928-1943. [PubMed] [DOI] |
| 11. | Wang XC, Tian LL, Tian J, Jiang XY. Overexpression of SKP2 promotes the radiation resistance of esophageal squamous cell carcinoma. Radiat Res. 2012;177:52-58. [PubMed] [DOI] |
| 12. | Tanaka T, Nakatani T, Kamitani T. Inhibition of NEDD8-conjugation pathway by novel molecules: potential approaches to anticancer therapy. Mol Oncol. 2012;6:267-275. [PubMed] [DOI] |
| 13. | Murata T, Takayama K, Katayama S, Urano T, Horie-Inoue K, Ikeda K, Takahashi S, Kawazu C, Hasegawa A, Ouchi Y. miR-148a is an androgen-responsive microRNA that promotes LNCaP prostate cell growth by repressing its target CAND1 expression. Prostate Cancer Prostatic Dis. 2010;13:356-361. [PubMed] [DOI] |
| 14. | Kong Y, Nan K, Yin Y. Identification and characterization of CAC1 as a novel CDK2-associated cullin. Cell Cycle. 2009;8:3544-3553. [PubMed] [DOI] |
| 15. | Chen BB, Glasser JR, Coon TA, Mallampalli RK. F-box protein FBXL2 exerts human lung tumor suppressor-like activity by ubiquitin-mediated degradation of cyclin D3 resulting in cell cycle arrest. Oncogene. 2012;31:2566-2579. [PubMed] [DOI] |
| 16. | Cheng Y, Li G. Role of the ubiquitin ligase Fbw7 in cancer progression. Cancer Metastasis Rev. 2012;31:75-87. [PubMed] [DOI] |
| 17. | Lerner M, Lundgren J, Akhoondi S, Jahn A, Ng HF, Moqadam FA, Oude Vrielink JA, Agami R, Den Boer ML, Grandér D. MiRNA-27a controls FBW7/hCDC4-dependent cyclin E degradation and cell cycle progression. Cell Cycle. 2011;10:2172-2183. [PubMed] [DOI] |