修回日期: 2012-07-29
接受日期: 2012-08-11
在线出版日期: 2012-09-08
目的: 研究Brg1(Brahma-related gene 1)基因在Peutz-Jeghers综合征(Peutz-Jeghers syndrome, PJS)息肉组织中蛋白表达及基因突变的意义, 探讨其与肿瘤发生的关系.
方法: 应用免疫组织化学技术分析72例PJS息肉组织Brg1蛋白的表达, 同时应用PCR-DNA技术检测39例PJS息肉和2例癌变组织中Brg1基因第4和10外显子的基因突变, 初步探讨其和PJS发生、发展及预后的关系.
结果: Brg1蛋白在PJS息肉中的表达率为54.17%(39/72), 与小肠腺癌的表达率(76.67%)相比明显降低, 与正常组织的表达率(16.67%)相比明显增高; PJS息肉组和正常小肠黏膜组Brg1蛋白阳性表达差异有统计学意义(P<0.05); PJS息肉组和小肠癌组Brg1蛋白阳性表达差异有统计学意义(P<0.05). 39例PJS息肉标本和2例癌变标本中, Brg1第4和10外显子的基因突变率为零.
结论: Brg1蛋白在PJS息肉中高表达并对PJS的发生发展起着重要作用, 但Brg1基因突变在PJS中少见, Brg1蛋白的表达可作为判断PJS息肉恶变及预后的重要指标.
引文著录: 刘金霞, 张凡, 周平, 夏廷毅, 毛高平. Brg1在Peutz-Jeghers综合征息肉组织中的蛋白表达及基因突变. 世界华人消化杂志 2012; 20(25): 2353-2357
Revised: July 29, 2012
Accepted: August 11, 2012
Published online: September 8, 2012
AIM: To investigate the protein expression and gene mutation of Brahma-related gene 1 (Brg1) in Peutz-Jeghers syndrome (PJS), and to analyze their relation with tumor development.
METHODS: The expression of Brg1 protein in 72 cases of PJS polyps was detected by immunohistochemistry. Mutations in exons 4 and 10 of the Brg1 gene was detected by means of polymerase chain reaction-direct sequencing (PCR-DNA) in 39 cases of PJS polyps and 2 cases of carcinoma.
RESULTS: The positive rate of Brg1 protein expression in PJS (54.17%) was lower than that in adenocarcinoma (76.67%) but higher than that in normal tissue (16.67%). There was a significant difference in the positive rate of Brg1 protein expression among the three groups (P < 0.05). No Brg1 gene mutations were detected in 39 cases of PJS polyps and 2 cases of carcinoma.
CONCLUSION: Increased expression of Brg1 protein in PJS may be associated with the development of this disease. Brg1 gene mutations might be rare in PJS. Brg1 expression can be used as an important parameter for differentiating malignancy and evaluating prognosis of PJS.
- Citation: Liu JX, Zhang F, Zhou P, Xia TY, Mao GP. Protein expression and gene mutation of Brg1 in Peutz-Jeghers syndrome. Shijie Huaren Xiaohua Zazhi 2012; 20(25): 2353-2357
- URL: https://www.wjgnet.com/1009-3079/full/v20/i25/2353.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i25.2353
Brgl(Brahma-related gene 1)是人类ATP依赖的染色质重构复合物SWI/SNF核心催化亚基的核心, 是20世纪90年代初在酿酒酵母中发现的一种抑癌基因, 位于人类染色体19p13上[1], 由35个外显子和34个内含子组成, 基因编码的蛋白质相对分子量为2.05×105 kDa, 其mRNA长约5 247 bp. 他在基因调控、细胞因子应答、肿瘤发生、发育和分化过程中起着非常重要的作用, 具有ATP依赖的解螺旋酶活性, 在SWI/SNF的核染色质改造功能中发挥着重要作用, 同时也是许多基因复制所必需的蛋白之一[2]. 在肺癌的发生中位于19p上的抑癌基因Brgl和STK11起着同样的作用[3]. Brg1基因在前列腺癌[4]、宫颈癌[5]及胃癌[6,7]组织中存在高表达, 而在肺癌组织[8,9]、喉鳞状细胞癌及多种肿瘤细胞系中表达下调或缺失[10], 由以上可推测Brg1可能在肿瘤的发生、发展中起着关键性的作用. 亦有报道在Peutz-Jeghers综合征(Peutz-Jeghers syndrome, PJS)息肉发生、发展中STK11和Brgl有着密切的联系[11], 但在PJS息肉中的表达及突变情况国内外尚未见阐述. 本研究采用过氧化物酶(S-P)免疫组织化学方法、PCR技术及DNA直接测序法(PCR-DNA)检测PJS息肉组织及正常组织和小肠癌组织中Brg1蛋白表达及基因突变情况, 旨在探讨Brg1在PJS息肉发生、发展及癌变过程中的作用, 为PJS患者的临床治疗提供参考价值.
选择中国人民解放军空军总医院病理科2004-04/2010-09归档的蜡块标本, 其中PJS息肉组织72例, 远离瘤体的小肠黏膜以及正常小肠黏膜组织12例, 小肠癌组织30例. 病理切片均经2位以上病理医师确诊. S-P试剂盒购自北京中杉金桥生物技术有限公司; Brg1抗体购自北京博奥森生物技术有限公司.
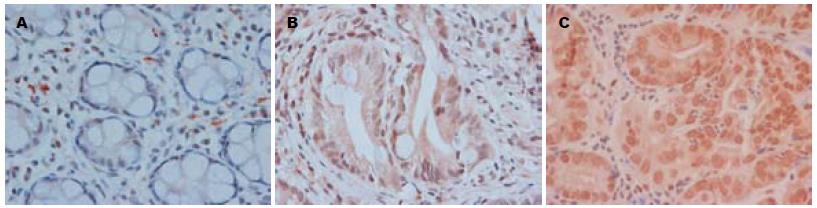
1.2.1 免疫组织化学S-P法: 将石蜡组织块脱蜡至水化后, 采用抗原修复处理的链霉素抗生物素蛋白S-P法染色, DAB显色. Brg1蛋白免疫组织化学检测技术实验步骤按说明书进行. 用已知阳性片作为阳性对照, 以磷酸盐缓冲液代替一抗作为阴性对照. 结果判断标准: 连续观察10个高倍视野(×400), 各计数1 000个细胞的阳性细胞数, 计算阳性细胞所占的百分率并取平均值. Brg1染色阳性细胞为细胞核呈棕黄色至深褐色, 部分细胞质同时为淡黄色和/或黄色. 其中阳性细胞<25%为(-), 25%-50%为阳性(+), 51%-75%为中等阳性(++), >75%为强阳性(+++).
1.2.2 PCR-DNA测序: (1)DNA模板的制备: 将石蜡包埋的组织切片10 μm厚2片, 放在加入1 mL二甲苯的1.5 mL Ep管中, 颠倒混匀, 使二甲苯与组织充分接触, 放置于48 ℃水浴锅中45 min, 用苯酚/氯仿抽提法常规提取人基因组DNA, 用作PCR模板; (2)PCR扩增: Brg1基因第4和10外显子引物经PubMed在线设计, 其序列合成均在中国人民解放军军事医学科学院分子生物学实验室完成, 引物序列为: 外显子4: sense 5'-TCTTCCAGTTCCAGCCAGTG-3', antisense 5'-CGAGGGTGTCGGTAGCGT-3', 产物大小为280 bp; 外显子10: sense 5'-CGACCAGAAGAAGGACAAG-3', antisense 5'-CTGAGGCAAGAGGTAGGC-3', 产物大小为158 bp. 对39例Brg1免疫组织化学染色阳性标本进行扩增, 反应体系包括DNA模板2 μL, 上、下游引物各1 μL, 2.5 mmol/L 4×dNTPs 4 μL, 10×Buffer 5 μL, TaqDNA聚合酶1 μL, 纯水36 μL, 总体积50 μL. 反应条件为95 ℃预变性5 min, 95 ℃ 30 s, 55 ℃或52.5 ℃ 30 s, 72 ℃ 1 min; 40个循环后72 ℃延伸7 min. 每组PCR反应均设无模板DNA的阴性对照; (3)DNA变性电泳: 制作2%琼脂糖凝胶, 将5 μL扩增产物与1 μL上样缓冲液混合, 用移液器将样品依次加入已配置好的凝胶样品槽的点样孔; 在5 V/cm的电压下电泳至溴酚蓝带跑到电泳槽中央; 电泳结束后取出凝胶, 在紫外灯下观察结果并拍片; (4)DNA回收: 将目的DNA片段切出, 称其重量; 回收步骤按试剂盒说明书进行, 将回收产物送去测序.
统计学处理 应用SPSS17.0软件进行统计分析, 组间差别采用四格表χ2检验. P≤0.05为差异有统计学意义.
Brg1蛋白在PJS息肉组织及正常小肠黏膜组织中均表达于细胞核, 呈棕黄色至深褐色, 多数部分细胞质同时为黄色. Brg1蛋白在小肠癌组织中为中等阳性或强阳性表达, 在PJS息肉组织中为中等阳性表达或弱阳性表达, 在正常小肠黏膜组织中为弱阳性表达或不表达(图1). Brg1蛋白的阳性表达在癌组织与PJS息肉组织之间差异有统计学意义(χ2 = 4.870, P<0.05); PJS息肉组织与正常小肠黏膜组织比较差异也具有统计学意义(χ2 = 4.497, P<0.05, 表1).
| 组织类型 | n | Brg1蛋白 | 阳性率(%) | |||
| - | + | ++ | +++ | |||
| PJS息肉组织 | 72 | 33 | 15 | 18 | 6 | 54.17 |
| 小肠癌组织 | 30 | 7 | 4 | 8 | 11 | 76.67 |
| 正常小肠黏膜组织 | 12 | 10 | 2 | 0 | 0 | 16.67 |
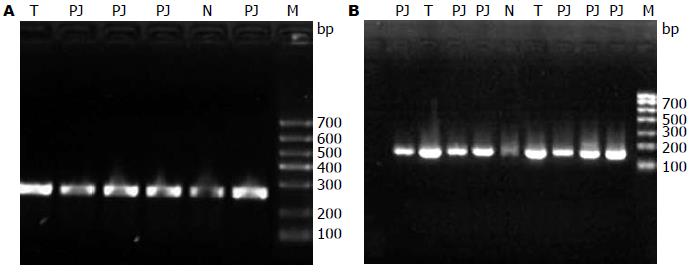
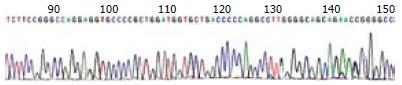
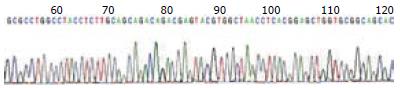
Brg1基因第4外显子PCR扩增产物大小为280 bp, 第10外显子PCR扩增产物为158 bp, 均符合扩增长度, 扩增成功. 经2%琼脂糖凝胶电泳后, 图像记录分析系统中可以看到单一且特异性好的目标条带(图2). 将Brg1基因第4、10外显子PCR产物纯化、回收、测序, 测序峰图(图3, 4), 读出图谱, 将图谱序列通过NCBI进行在线比对, 结果均未发现Brg1第4、10外显子突变.
在遗传性家族性疾病中, PJS是属于中等度癌变风险的一种综合征, 多器官系统易患癌症是本病的一个重要特点. 以前报道本病是一种良性病变, 恶变的几率极低, 仅为1%-3%. 随着研究的深入, 人们发现有的PJS息肉为腺瘤样改变, 可以发生癌变, 而且错构瘤本身也有可能演变为腺瘤和癌, 存在着由错构瘤-腺瘤-腺癌的演变过程[12]. 本综合征是患胃肠道和胃肠道外肿瘤及妇科癌症的高危因素[13], 治疗多以发现息肉内镜切除为主, 给患者和家属带来沉重的经济和精神负担[14], 因此近几年来本病引起医学界的高度重视.
目前PJS的发病机制尚不明确, 多数研究认为他的主要相关致病基因为STK11/LKB1基因, 位于人类染色体19p13.3, 编码丝氨酸/苏氨酸蛋白激酶, 在染色质重构、细胞周期、细胞极性以及能量代谢的应答调控等方面发挥着重要的作用. 1998年Jenne等[15]和Hemminki等[16]同时报道STK11/LKB1基因与PJS的发生、发展有着密切的关系. 在家族性PJS患者和散发性患者中, 已经鉴定出有144种STK11基因突变, 包括错义突变、缺失突变和插入突变等[17]. 在PJS家系患者中STK11/LKB1突变率仅为70%, 在散发病例中的突变率为30%-67%[14], 高度提示PJS存在着遗传异质性. 随着国内外学者的不断探索, 发现3p14是PJS脆性位点出现频率最高的位点, 该基因可能参与了PJS的发病[18]. 而Mehenni等[19]、Marneros等[20]在寻找PJS新的致病基因时发现位于19q13.4区带存在基因突变. 夏欧东等[21]发现Axin蛋白在PJS息肉中低表达. 马娅梅等[22]检测到IFITM1 mRNA及IFITM1蛋白水平在PJS患者中的表达有变化. 国外也有研究证明Wnt信号通路中的关键蛋白Beta-catenin可能是PJS息肉发生发展和癌变的蛋白之一[23]. 最近研究发现STRADαlphα、Brg1、MO25αlphα有可能参与PJS的发生发展[24].
最近文献报道, 无论PJS患者是否存在LKB1基因突变, 其患癌风险均明显较普通人群增高[25], 所以PJS的发病机制和临床治疗越来越受到人们的重视. Brg1作为最近发现的一种重要的抑癌基因, 他可以E/F非依赖方式抑制c-fos的转录[26,27]. 也有人研究发现, SWI/SNF家族与许多基因的激活有关, 也与转录的抑制有关, 他主要通过转录活化和抑制功能来控制肿瘤的生长[28]. 不同的研究发现Brg1基因在前列腺癌、宫颈癌及胃癌组织中高表达, 而在肺癌组织及多种肿瘤细胞系中表达下调或缺失.
本研究利用S-P法检测发现, Brg1蛋白在小肠癌组织和PJS息肉组织中高表达, 二者阳性表达率明显高于正常小肠黏膜组织, 且Brg1蛋白在小肠癌组织中的阳性率高于PJS息肉组织. Brg1蛋白在小肠癌中的表达以强阳性或中等阳性为主, 在PJS息肉组织中的表达以中等阳性或弱阳性为主, 而在正常小肠黏膜组织中以弱阳性表达或不表达为主.
我们进一步利用PCR-DNA直接测序法对Brg1是否在患者息肉组织中存在突变进行检测, 经查阅大量文献发现Brg1基因突变的位点50%以上发生在外显子4和10上[6], 因此我们选择了Brg1基因的第4、10外显子进行检测. 通过对39例PJ息肉标本和2例癌变标本以及12例正常小肠标本进行检测, 经PCR-DNA直接测序法扩增出Brg1第4和10外显子, 对扩增产物经凝胶电泳检测、纯化回收进行测序, 测序结果均未发现突变.
通过本研究可推测Brg1蛋白在PJS息肉组织中存在高表达, 很可能是PJS息肉发生发展和息肉癌变的一个关键性因素之一. 但Brg1基因作为一种抑癌基因, 在PJS息肉组织和小肠癌组织中却表现为癌基因的活性, 究其原因, 可能是Brg1基因在PJS息肉组织和小肠癌组织中发生了功能丢失或转录激活的作用, 从而失去了原本的抑癌作用, 进而在PJS息肉的发生发展及息肉癌变的过程中起着一定的作用.
魏学明等[29]在PJS的诊治和预防提出了分子靶向治疗, 为PJS胃肠道息肉带来预防性治疗的新途径, 其代表就是环氧合酶-2的选择性抑制剂. 而中药以"济生乌梅丸"为代表可能成为PJS息肉的预防性治疗提供另一个选择. 通过本研究我们推测BRG1也有可能成为PJS胃肠息肉治疗的靶向指标, 但其具体机制尚待进一步研究阐明.
Peutz-Jeghers综合征(PJS)是一种由LKB1/STK11突变而引起的常染色体显性遗传性疾病, 其主要临床特点是胃肠道多发息肉、皮肤黏膜色素斑和家族遗传性, 其具体的发病机制尚不完全明确, 因此有待于进一步研究阐明.
颜宏利, 教授, 中国人民解放军第二军医大学医学遗传学教研室
目前临床上对于PJS的治疗仍以发现息肉并摘除为主, 但息肉易复发, 所以研究探索抑制息肉再生长的治疗方法是目前迫切需要研究的新方向.
本文利用免疫组织化学及PCR技术对PJS胃肠息肉中Brg1基因进行研究, 为PJS基因治疗提供新的思路, 对PJS胃肠息肉的临床治疗提供一定的实验依据.
如果能研究出一种抑制PJS患者息肉再生殖的药物, 将为PJS患者带来福音.
PJS中Brg1蛋白表达及基因突变的研究比较少, 本文有较好的创新性, 并为临床治疗相关疾病提供了较好的参考价值, 意义较大.
编辑: 张姗姗 电编:鲁亚静
| 1. | Wong AK, Shanahan F, Chen Y, Lian L, Ha P, Hendricks K, Ghaffari S, Iliev D, Penn B, Woodland AM. BRG1, a component of the SWI-SNF complex, is mutated in multiple human tumor cell lines. Cancer Res. 2000;60:6171-6177. [PubMed] |
| 2. | Baas AF, Smit L, Clevers H. LKB1 tumor suppressor protein: PARtaker in cell polarity. Trends Cell Biol. 2004;14:312-319. [PubMed] [DOI] |
| 3. | Rodriguez-Nieto S, Sanchez-Cespedes M. BRG1 and LKB1: tales of two tumor suppressor genes on chromosome 19p and lung cancer. Carcinogenesis. 2009;30:547-554. [PubMed] [DOI] |
| 7. | Sentani K, Oue N, Kondo H, Kuraoka K, Motoshita J, Ito R, Yokozaki H, Yasui W. Increased expression but not genetic alteration of BRG1, a component of the SWI/SNF complex, is associated with the advanced stage of human gastric carcinomas. Pathobiology. 2001;69:315-320. [PubMed] [DOI] |
| 9. | Reisman DN, Sciarrotta J, Wang W, Funkhouser WK, Weissman BE. Loss of BRG1/BRM in human lung cancer cell lines and primary lung cancers: correlation with poor prognosis. Cancer Res. 2003;63:560-566. [PubMed] |
| 10. | 崔 香艳, 汪 欣, 陈 玮伦, 于 红, 黄 可新, 祝 威. Brg1在喉鳞状细胞癌组织中的表达及意义. 吉林大学学报(医学版). 2010;36:546-549. |
| 11. | Marignani PA, Kanai F, Carpenter CL. LKB1 associates with Brg1 and is necessary for Brg1-induced growth arrest. J Biol Chem. 2001;276:32415-32418. [PubMed] [DOI] |
| 12. | Wang ZJ, Ellis I, Zauber P, Iwama T, Marchese C, Talbot I, Xue WH, Yan ZY, Tomlinson I. Allelic imbalance at the LKB1 (STK11) locus in tumours from patients with Peutz-Jeghers' syndrome provides evidence for a hamartoma-(adenoma)-carcinoma sequence. J Pathol. 1999;188:9-13. [PubMed] [DOI] |
| 13. | Tantipalakorn C, Khunamornpong S, Lertprasertsuke N, Tongsong T. Female genital tract tumors and gastrointestinal lesions in the Peutz-Jeghers syndrome. J Med Assoc Thai. 2009;92:1686-1690. [PubMed] |
| 14. | Kopácová M, Bures J, Ferko A, Tachecí I, Rejchrt S. Comparison of intraoperative enteroscopy and double-balloon enteroscopy for the diagnosis and treatment of Peutz-Jeghers syndrome. Surg Endosc. 2010;24:1904-1910. [PubMed] [DOI] |
| 15. | Jenne DE, Reimann H, Nezu J, Friedel W, Loff S, Jeschke R, Müller O, Back W, Zimmer M. Peutz-Jeghers syndrome is caused by mutations in a novel serine threonine kinase. Nat Genet. 1998;18:38-43. [PubMed] [DOI] |
| 16. | Hemminki A, Markie D, Tomlinson I, Avizienyte E, Roth S, Loukola A, Bignell G, Warren W, Aminoff M, Höglund P. A serine/threonine kinase gene defective in Peutz-Jeghers syndrome. Nature. 1998;391:184-187. [PubMed] [DOI] |
| 17. | Alessi DR, Sakamoto K, Bayascas JR. LKB1-dependent signaling pathways. Annu Rev Biochem. 2006;75:137-163. [PubMed] [DOI] |
| 18. | 赵 喜荣, 康 连春, 周 永双, 贾 义星, 陈 竹, 康 素海, 李 文梅, 赵 敏, 崔 建涛, 孙 安乐. Peutz-Jeghers综合征脆性组氨酸三连体基因突变与癌变的关系. 癌症. 2003;22:50-54. |
| 19. | Mehenni H, Blouin JL, Radhakrishna U, Bhardwaj SS, Bhardwaj K, Dixit VB, Richards KF, Bermejo-Fenoll A, Leal AS, Raval RC. Peutz-Jeghers syndrome: confirmation of linkage to chromosome 19p13.3 and identification of a potential second locus, on 19q13.4. Am J Hum Genet. 1997;61:1327-1334. [PubMed] [DOI] |
| 20. | Marneros AG, Mehenni H, Reichenberger E, Antonarakis SE, Krieg T, Olsen BR. Gene for the human transmembrane-type protein tyrosine phosphatase H (PTPRH): genomic structure, fine-mapping and its exclusion as a candidate for Peutz-Jeghers syndrome. Cytogenet Cell Genet. 2001;92:213-216. [PubMed] [DOI] |
| 23. | Chaiyapan W, Sangkhathat S, Kanngurn S, Phukaoloun M, Chiengkriwate P, Patrapinyokul S. Immunohistological evidence for Wnt-signaling activation in Peutz-Jeghers polyposis. Pediatr Surg Int. 2010;26:173-177. [PubMed] [DOI] |
| 24. | Alhopuro P, Katajisto P, Lehtonen R, Ylisaukko-Oja SK, Näätsaari L, Karhu A, Westerman AM, Wilson JH, de Rooij FW, Vogel T. Mutation analysis of three genes encoding novel LKB1-interacting proteins, BRG1, STRADalpha, and MO25alpha, in Peutz-Jeghers syndrome. Br J Cancer. 2005;92:1126-1129. [PubMed] [DOI] |
| 25. | 袁 柏思, 路 又可, 金 鑫鑫, 万 海军, 周 淑萍, 汪 芳裕. Peutz-Jeghers综合征: 恶性肿瘤高风险人群. 世界华人消化杂志. 2011;19:3094-3099. [DOI] |
| 26. | Bartlett C, Orvis TJ, Rosson GS, Weissman BE. BRG1 mutations found in human cancer cell lines inactivate Rb-mediated cell-cycle arrest. J Cell Physiol. 2011;226:1989-1997. [PubMed] [DOI] |
| 27. | Murphy DJ, Hardy S, Engel DA. Human SWI-SNF component BRG1 represses transcription of the c-fos gene. Mol Cell Biol. 1999;19:2724-2733. [PubMed] |
| 28. | Pal S, Yun R, Datta A, Lacomis L, Erdjument-Bromage H, Kumar J, Tempst P, Sif S. mSin3A/histone deacetylase 2- and PRMT5-containing Brg1 complex is involved in transcriptional repression of the Myc target gene cad. Mol Cell Biol. 2003;23:7475-7487. [PubMed] [DOI] |