修回日期: 2012-07-01
接受日期: 2012-08-06
在线出版日期: 2012-08-28
目的: 评价内镜下十二指肠乳头切除术(endoscopic papillectomy, EP)在乳头部肿瘤诊断中的临床价值.
方法: 分析2008-01/2012-03来我院的16例经病理检查确诊的十二指肠乳头部肿瘤患者的相关资料, 评价EP在十二指肠乳头部肿瘤诊断中的临床价值.
结果: 16例患者中, 内镜活检诊断为腺瘤者12例, 慢性炎症改变者4例. EP将乳头部肿瘤组织切除后整体送检行病理学检查确诊为低分化腺癌者2例, 高分化腺癌1例, 腺瘤13例(其中1例腺瘤恶变, 4例常规内镜活检诊断为慢性炎症改变者术后均确诊为腺瘤), EP术后准确率明显高于内镜活检法(P<0.05). 超声内镜(endoscopic ultrasonography, EUS)检查提示病变均起源于黏膜层, 胰胆管扩张者9例, 未见黏膜下层连续性中断及胰胆管受累者, 无腹膜后淋巴结肿大者; 12例高回声病变者术后病理检查结果均为腺瘤, 1例高回声病变局部见低回声区者术后病理检查结果为腺瘤恶变, 3例低回声病变者术后病理检查结果均为腺癌. EP术后2例低分化腺癌者、1例腺瘤恶变者及1例腺瘤者胆管开口处见病变残留, 提示胆管受累, 但术前EUS检查均未提示胆管受累; 1例高分化腺癌及11例腺瘤者病灶均完整切除, 术后切缘阴性. EP术后除2例出现黑便外, 无急性胰腺炎、穿孔及其他并发症发生, 无患者死亡.
结论: EP术将乳头部肿瘤组织切除后整体送检行病理学检查可提高诊断准确率, 为治疗方法的抉择提供科学依据.
引文著录: 覃华, 赵秋, 李德民, 高红宇, 李荣香, 张敏, 胡继芬, 王渝. 内镜下十二指肠乳头切除术在乳头部肿瘤诊断中的价值. 世界华人消化杂志 2012; 20(24): 2305-2309
Revised: July 1, 2012
Accepted: August 6, 2012
Published online: August 28, 2012
AIM: To evaluate the value of endoscopic papillectomy (EP) for the diagnosis of tumors of the ampulla of Vater.
METHODS: The clinical data for 16 patients with tumors of the ampulla of Vater were analyzed. The clinical efficacy, complications and safety of EP were evaluated.
RESULTS: Before EP, 12 patients were diagnosed with adenoma and 4 with chronic inflammation by endoscopic biopsy. After EP, 2 cases were diagnosed with poorly differentiated adenocarcinoma, 1 with well differentiated adenocarcinoma, and 13 with adenoma (including one case of adenoma with malignant transformation and all 4 cases diagnosed with "chronic inflammation" by endoscopic biopsy). The accuracy of EP was significantly higher than that of endoscopic biopsy (P < 0.05). In 9 cases, EUS showed that the lesions originated from the submucosal layer with dilated pancreatic and biliary ducts. None of the cases had submucosal continuity interruption, invasion to pancreatic/biliary ducts or enlarged retroperitoneal lymph nodes on EUS. Twelve patients with high echoic lesions were confirmed to have adenoma, one patient with hyperechoic lesion with localized low echo area were confirmed to have adenoma with malignant transformation, and 3 patients with low echo lesions were confirmed to have adenocarcinoma. After EP, residual lesions were found in bile duct orifice in 2 cases of poorly differentiated adenocarcinoma, 1 case of adenoma with malignant transformation and 1 case of adenoma, indicating invasion to the bile duct. All of them had a negative preoperative EUS. Lesions were completely resected in 1 case of well differentiated adenocarcinoma and 11 cases of adenoma, and the resection stump was histologically negative for neoplasm. After EP, two patients developed transient melena, but no acute pancreatitis, perforation or other complications occurred. There was no procedural-related death in this group of patients.
CONCLUSION: EP is safe and has a higher accuracy in the diagnosis of tumors of the ampulla of Vater.
- Citation: Qin H, Zhao Q, Li DM, Gao HY, Li RX, Zhang M, Hu JF, Wang Y. Clinical evaluation of endoscopic papillectomy for the diagnosis of tumors of the ampulla of Vater. Shijie Huaren Xiaohua Zazhi 2012; 20(24): 2305-2309
- URL: https://www.wjgnet.com/1009-3079/full/v20/i24/2305.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i24.2305
随着上消化道内镜检查的普及, 特别是内镜下逆行胰胆管造影(endoscopic retrograde cholangiopancreatography, ERCP)检查的推广应用, 十二指肠乳头部肿瘤检出率逐年增加, 其内镜下表现为十二指肠乳头明显肿大、隆起, 局部呈菜花样改变, 部分患者可出现出血、坏死. 虽然十二指肠乳头部肿瘤诊断技术在不断的改进, 但其定性诊断很困难, 内镜活检漏诊率可高达25%-60%[1,2]. 内镜下十二指肠乳头切除术(endoscopic papillectomy, EP)将乳头部肿瘤组织切除后整体送检行病理学检查可提高诊断准确率, 为评价EP在十二指肠乳头部肿瘤诊断中价值, 本研究分析了2008-01/2012-03我院16例行EP的十二指肠乳头部肿瘤患者的临床资料, 现报告如下.
16例十二指肠乳头部肿瘤患者中, 男7例, 女9例, 平均年龄54.49(43-77)岁. 其中9例因上腹痛伴皮肤巩膜黄染入院, 7例因上腹部不适行胃镜检查时发现十二指肠乳头部肿瘤而入院. 所有患者EP术前查血癌胚抗原(carcino-embryonic antigen, CEA)、糖类抗原(carbohydrate antigen 19-9, CA19-9)、甲胎蛋白(alpha-fetal protein, AFP)等肿瘤标记物均正常.
1.2.1 术前检查及准备: 16例患者入院后均行血常规、凝血全套、胸片、心电图、内镜下活检及超声内镜(endoscopic ultrasonography, EUS)等检查. EP术前禁食、水、备血并常规行碘过敏试验. 术前30 min予以丁溴东莨菪碱20 mg、地西泮10 mg和哌替啶50 mg肌肉注射. 内镜采用Olympus JF 240/260 V型电子十二指肠镜, 高频电发生器采用ERBE-ICC 200, 圈套器选用COOK公司一次性圈套器, 注射针选用Olympus 23G注射针.
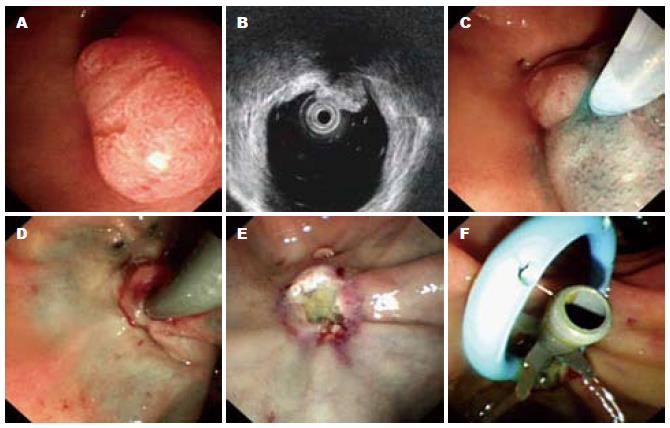
1.2.2 EP术中操作: 循腔插入侧视镜至十二指肠降部后仔细观察病灶, 黏膜下注射1:10 000肾上腺素-美兰盐水至病灶完全抬举, 以圈套器将肿瘤根部连同十二指肠乳头圈套并收紧提起后经高频电凝切除病变组织, 回收标本送检行病理学检查.
1.2.3 术后处理: EP术后3 h及12 h行血淀粉酶及血常规检查, 动态监测患者血压、心率, 观察患者腹部症状及体征; 术后禁食水, 予以质子泵抑制剂、生长抑素及抗生素等治疗3 d, 出现并发症者则予以相应治疗.
统计学处理 计量资料采用mean±SD表示, 内镜活检法与EP法准确率之间差异采用Fisher精确概率法进行比较, P<0.05表示有显著性差异.
EP术中操作过程如图1所示.
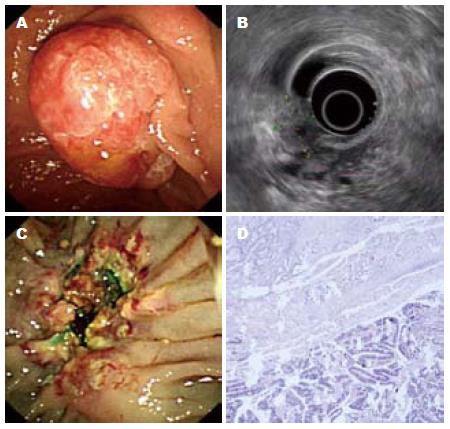
16例患者中, 内镜活检诊断为腺瘤者12例, 慢性炎症改变者4例. EP将乳头部肿瘤组织切除后整体送检行病理学检查确诊为低分化腺癌者2例, 高分化腺癌1例, 腺瘤13例(其中腺瘤恶变者1例, 4例常规内镜活检诊断为慢性炎症改变者术后均确诊为腺瘤), EP术后准确率明显高于内镜活检法(P = 0.0012). EUS检查提示病变均起源于黏膜层, 未见黏膜下层连续性中断及胰胆管受累者, 合并胰胆管扩张者9例, 未见腹膜后淋巴结肿大者; 其中12例高回声病变者术后病理检查结果均为腺瘤, 1例高回声病变局部见低回声区者术后病理检查结果为腺瘤恶变, 另3例低回声病变者术后病理检查结果均为腺癌. EP术后2例低分化腺癌者、1例腺瘤恶变者及1例腺瘤者胆管开口处见病变残留, 提示胆管受累(图2), 但术前EUS检查均未提示胆管受累; 1例高分化腺癌及11例腺瘤者病灶均完整切除, 术后切缘阴性. EUS检查在评价病变累及的深度及范围方面准确率为75%. 内镜活检及EUS后均无消化道出血、穿孔等并发症发生; EP术后除2例出现黑便外, 无急性胰腺炎、穿孔及其他并发症发生, 无患者死亡. 2例黑便者, 急诊十二指肠镜检查创面均未见活动性出血, 予以质子泵抑制剂及止血治疗3 d后大便潜血转阴. 内镜活检及EP术后病理检查结果见表1.
| 取材方法 | 腺瘤 | 腺瘤恶变 | 腺癌 | 总体准确率 |
| 内镜活检法 | 8/12(75) | 0/1(0) | 0/3(0) | 8/16(50)a |
| EP法 | 12/12(100) | 1/1(100) | 3/3(100) | 16/16(100) |
十二指肠乳头部肿瘤非常罕见[3], 尸检检出率约为0.04%-0.12%, 占消化系肿瘤的5%[4], 其临床表现包括反复发作的腹痛、进行性黄疸、腹泻、黑便等, 部分患者可合并急性胰腺炎. 因十二指肠乳头部肿瘤具有潜在恶变可能[5,6], 对于十二指肠乳头部肿瘤无论其性质如何均需切除, 其治疗方式取决于病变的性质. 目前十二指肠乳头部肿瘤常用的确诊方法为内镜下活检, 因内镜活检钳取的病变组织较小且表浅, 其阳性率较低, 难以准确评估病变的性质及病变浸润的范围、深度; 虽采用多部位深凿活检法可提高其阳性率, 但内镜活检总体阳性率为47%-95%[7-10]. 窄带成像技术结合放大内镜可清楚显示乳头部肿瘤组织腺管开口类型及表浅血管形态, 判断病变的良恶性[1,11,12], 但相关报道不多, 其临床价值有待于进一步明确. EP可将病变组织切除后整体送检行病理学检查, 不仅可明确病变的性质, 而且可准确评估病变的浸润范围及深度. 本研究中2例低分化腺癌、1例高分化腺癌及1例腺瘤恶变者均于EP术后确诊, 术前虽多次、多部位活检, 均误诊为腺瘤; 4例腺瘤者内镜下活检误诊为慢性炎症改变, 内镜下活检总体准确率为50%, EP术后病理检查准确率可明显提高(P<0.05).
EUS检查虽可显示十二指肠乳头部肿瘤的起源层次、病变累及深度, 以及胆管、胰管、胰腺及其周围组织结构[7], 但难以准确显示病变部及其周围组织结构全貌[13], 其准确率为63%[14-16]. 在行EP时, 若十二指肠乳头部肿瘤已侵及黏膜下层组织, 则病变组织易与黏膜下组织相粘连, 可导致黏膜下注射后粘连处病变抬举征阴性, 因而可协助判断病变浸润的深度. 本研究中4例EP术后胆管开口处见病变残留, 提示胆管受累, 但术前EUS检查均未提示, 其准确率为75%, 可见EUS检查在评价病变累及的深度及范围方面仍有一定的局限性. 为准确判断十二指肠乳头部肿瘤浸润深度及范围, 我们的经验是在EP前需常规行EUS检查, 反复变换操作手法以从不同切面扫描, 仔细分析不同层面的结构, 尽可能全面了解病变的范围.
在行黏膜下注射时, 需从乳头部肿瘤的肛侧开始注射足量的1:10 000肾上腺素-美兰盐水后, 再于病变的两侧注射, 最后于病变的口侧注射, 注射术中及术后仔细观察病变是否已完全抬举, 若局部抬举征阴性则应考虑病变已侵犯黏膜下层组织. EUS虽可从病变组织的回声来判断病变的性质, 但无法替代病理检查. EUS下腺瘤组织可表现为高回声或等回声病变, 腺癌一般表现为低回声改变. 本研究中3例低回声病变者术后病理检查均确诊为腺癌, 1例高回声病变局部见低回声区者术后病理检查确诊为腺瘤恶变, 因此在行EUS检查发现十二指肠乳头部低回声病变时应高度警惕乳头部腺癌可能.
EP术后常见并发症包括出血、穿孔、急性胰腺炎、胆管炎、乳头狭窄等[17-23], 其总体发生率约为23%(10%-58%), 死亡率约为0.4%(0%-7%)[24-28]. 本研究16例患者中术后出现黑便者2例, 急诊十二指肠镜检查创面可见血痂附着, 但均未见活动性出血, 予以药物治疗3 d后大便转黄, 潜血试验转阴; 术后无十二指肠穿孔、急性胰腺炎、胆管炎、乳头狭窄等并发症发生, 我们认为EP是相对安全的. 与内镜活检及EUS相比, EP术后并发症的总体发生率仍相对较高[29]. 因此, 我们建议仍将内镜活检作为诊断十二指肠乳头部肿瘤的首选方法, 对于多次内镜活检均为阴性者, 为明确诊断可行EP术将乳头部病变组织切除后整体送检行病理学检查[4,30].
十二指肠乳头部肿瘤的检出率逐年增加, 单凭常规内镜下活检无法准确评估病变性质而影响其治疗方案的抉择. EP术将乳头部肿瘤组织切除后整体送检行病理学检查, 可准确评价病变的性质以及病变范围、浸润的深度, 提高其诊断准确率, 为治疗方法的抉择提供科学依据.
临床上十二指肠乳头部肿瘤非常罕见, 内镜活检法为最常用的定性诊断方法, 但其漏诊率较高, 因此十二指肠乳头部肿瘤定性诊断仍相对困难.
宋振顺, 教授, 西京医院肝胆外科
内镜下十二指肠乳头切除术(EP)可用于多次内镜活检仍难于确诊乳头部肿瘤者, EP将病变组织切除后整体送检可明确诊断, 对于局限于乳头部的十二指肠乳头腺瘤可以起到根治的作用.
Ogawa等报道十二指肠乳头癌可通过十二指肠乳头切除术将病变组织整体切除后行病理学检查以明确诊断.
本文通过EP将乳头部肿瘤组织切除后整体送检行病理学检查, 可显著提高诊断准确率, 表明EP可用于多次内镜活检仍难于确诊的乳头部肿瘤患者.
本文探讨了内镜下十二指肠乳头切除术在乳头部肿瘤诊断中的价值及其安全性, 对乳头部肿瘤的诊断具有一定的指导作用.
编辑: 张姗姗 电编:闫晋利
| 1. | Uchiyama Y, Imazu H, Kakutani H, Hino S, Sumiyama K, Kuramochi A, Tsukinaga S, Matsunaga K, Nakayoshi T, Goda K. New approach to diagnosing ampullary tumors by magnifying endoscopy combined with a narrow-band imaging system. J Gastroenterol. 2006;41:483-490. [PubMed] [DOI] |
| 3. | Kanamori A, Kumada T, Kiriyama S, Sone Y, Tanikawa M, Hisanaga Y, Toyoda H, Kawashima H, Itoh A, Hirooka Y. Endoscopic papillectomy of minor papillar adenoma associated with pancreas divisum. World J Gastroenterol. 2009;15:1138-1140. [PubMed] [DOI] |
| 4. | Harano M, Ryozawa S, Iwano H, Taba K, Sen-Yo M, Sakaida I. Clinical impact of endoscopic papillectomy for benign-malignant borderline lesions of the major duodenal papilla. J Hepatobiliary Pancreat Sci. 2011;18:190-194. [PubMed] [DOI] |
| 5. | Heinzow HS, Lenz P, Lenze F, Domagk D, Domschke W, Meister T. Feasibility of snare papillectomy in ampulla of vater tumors: meta-analysis and study results from a tertiary referral center. Hepatogastroenterology. 2012;59:332-335. [PubMed] [DOI] |
| 6. | Bohnacker S, Soehendra N, Maguchi H, Chung JB, Howell DA. Endoscopic resection of benign tumors of the papilla of vater. Endoscopy. 2006;38:521-525. [PubMed] [DOI] |
| 7. | Ito K, Fujita N, Noda Y, Kobayashi G, Horaguchi J. Diagnosis of ampullary cancer. Dig Surg. 2010;27:115-118. [PubMed] [DOI] |
| 8. | Kim JH, Kim JH, Han JH, Yoo BM, Kim MW, Kim WH. Is endoscopic papillectomy safe for ampullary adenomas with high-grade dysplasia? Ann Surg Oncol. 2009;16:2547-2554. [PubMed] [DOI] |
| 9. | Jung MK, Cho CM, Park SY, Jeon SW, Tak WY, Kweon YO, Kim SK, Choi YH. Endoscopic resection of ampullary neoplasms: a single-center experience. Surg Endosc. 2009;23:2568-2574. [PubMed] [DOI] |
| 11. | Yamao T, Isomoto H, Yamaguchi N, Irie J, Ito Y, Nakashima Y, Shikuwa S, Mizuta Y, Kohno S, Imamura S. Magnified endoscopic observation using narrow-band imaging of periampullary adenoma in a patient with familial adenomatous polyposis. Med Sci Monit. 2009;15:CS169-CS173. [PubMed] |
| 12. | Itoi T, Tsuji S, Sofuni A, Itokawa F, Kurihara T, Tsuchiya T, Ishii K, Ikeuchi N, Igarashi M, Gotoda T. A novel approach emphasizing preoperative margin enhancement of tumor of the major duodenal papilla with narrow-band imaging in comparison to indigo carmine chromoendoscopy (with videos). Gastrointest Endosc. 2009;69:136-141. [PubMed] [DOI] |
| 13. | Yamashita Y, Ito K, Fujita N, Noda Y, Kobayashi G, Obana T, Horaguchi J, Kato Y, Koshita S, Kanno Y. A case of early carcinoma of the papilla of Vater confined to the mucosa and continuative epithelium of glands in Oddi's sphincter (m-God) treated by endoscopic papillectomy. Intern Med. 2010;49:2447-2450. [PubMed] [DOI] |
| 14. | Yamao T, Isomoto H, Kohno S, Mizuta Y, Yamakawa M, Nakao K, Irie J. Endoscopic snare papillectomy with biliary and pancreatic stent placement for tumors of the major duodenal papilla. Surg Endosc. 2010;24:119-124. [PubMed] [DOI] |
| 15. | Will U, Bosseckert H, Meyer F. Correlation of endoscopic ultrasonography (EUS) for differential diagnostics between inflammatory and neoplastic lesions of the papilla of Vater and the peripapillary region with results of histologic investigation. Ultraschall Med. 2008;29:275-280. [PubMed] [DOI] |
| 16. | Ito K, Fujita N, Noda Y, Kobayashi G, Horaguchi J, Takasawa O, Obana T. Preoperative evaluation of ampullary neoplasm with EUS and transpapillary intraductal US: a prospective and histopathologically controlled study. Gastrointest Endosc. 2007;66:740-747. [PubMed] [DOI] |
| 17. | Catalano MF, Linder JD, Chak A, Sivak MV, Raijman I, Geenen JE, Howell DA. Endoscopic management of adenoma of the major duodenal papilla. Gastrointest Endosc. 2004;59:225-232. [PubMed] [DOI] |
| 18. | Cheng CL, Sherman S, Fogel EL, McHenry L, Watkins JL, Fukushima T, Howard TJ, Lazzell-Pannell L, Lehman GA. Endoscopic snare papillectomy for tumors of the duodenal papillae. Gastrointest Endosc. 2004;60:757-764. [PubMed] [DOI] |
| 19. | Kahaleh M, Shami VM, Brock A, Conaway MR, Yoshida C, Moskaluk CA, Adams RB, Tokar J, Yeaton P. Factors predictive of malignancy and endoscopic resectability in ampullary neoplasia. Am J Gastroenterol. 2004;99:2335-2339. [PubMed] [DOI] |
| 20. | Norton ID, Gostout CJ, Baron TH, Geller A, Petersen BT, Wiersema MJ. Safety and outcome of endoscopic snare excision of the major duodenal papilla. Gastrointest Endosc. 2002;56:239-243. [PubMed] [DOI] |
| 21. | Saurin JC, Chavaillon A, Napoléon B, Descos F, Bory R, Berger F, Ponchon T. Long-term follow-up of patients with endoscopic treatment of sporadic adenomas of the papilla of vater. Endoscopy. 2003;35:402-406. [PubMed] [DOI] |
| 22. | Smith MT, Sherman S, Ikenberry SO, Hawes RH, Lehman GA. Alterations in pancreatic ductal morphology following polyethylene pancreatic stent therapy. Gastrointest Endosc. 1996;44:268-275. [PubMed] [DOI] |
| 26. | Irani S, Arai A, Ayub K, Biehl T, Brandabur JJ, Dorer R, Gluck M, Jiranek G, Patterson D, Schembre D. Papillectomy for ampullary neoplasm: results of a single referral center over a 10-year period. Gastrointest Endosc. 2009;70:923-932. [PubMed] [DOI] |
| 27. | Hernandez LV, Catalano MF. Endoscopic papillectomy. Curr Opin Gastroenterol. 2008;24:617-622. [PubMed] [DOI] |
| 28. | Han J, Kim MH. Endoscopic papillectomy for adenomas of the major duodenal papilla (with video). Gastrointest Endosc. 2006;63:292-301. [PubMed] [DOI] |
| 29. | Ito K, Fujita N, Noda Y. Endoscopic diagnosis and treatment of ampullary neoplasm (with video). Dig Endosc. 2011;23:113-117. [PubMed] [DOI] |
| 30. | Ogawa T, Ito K, Fujita N, Noda Y, Kobayashi G, Horaguchi J, Koshita S, Kanno Y, Masu K, Ishii S. Endoscopic papillectomy as a method of total biopsy for possible early ampullary cancer. Dig Endosc. 2012;24:291. [PubMed] [DOI] |