修回日期: 2012-07-15
接受日期: 2012-08-01
在线出版日期: 2012-08-18
目的: 比较分化程度不同的大肠癌患者与无器质性肠道疾病志愿者肠黏膜血管紧张素Ⅱ(AngiotensinⅡ)及其Ⅰ型受体(Angiotensin Ⅱ typeⅠreceptor, AT1R)表达差异.
方法: 肠镜室募集大肠癌患者24例(病理学检查证实其中9例为大肠高分化腺癌患者, 9例为大肠中分化腺癌患者, 6例为大肠低分化腺癌患者)及6例无器质性肠道疾病志愿者, 电子结肠镜下取活检获得新鲜的肠黏膜组织. 免疫组织化学法检测各组肠黏膜AngiotensinⅡ及AT1R蛋白表达强度, 单因素方差分析各组之间的差异.
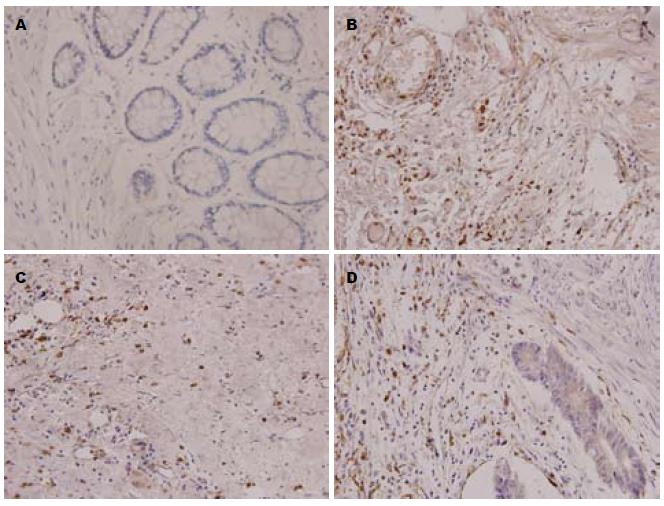
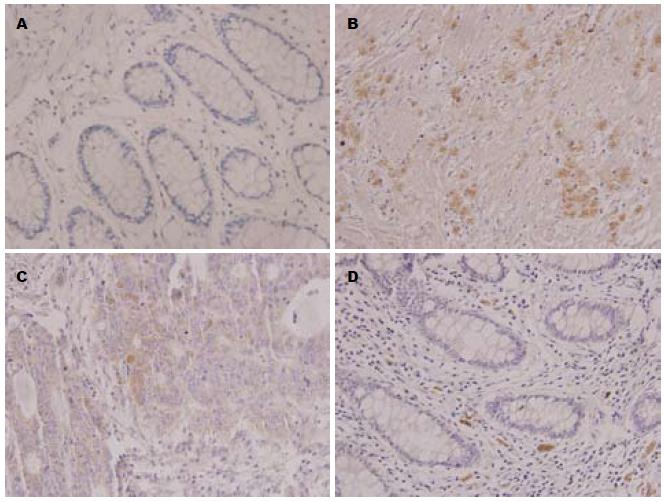
结果: 大肠腺癌(低、中、高分化组)患者肠黏膜Angiotensin Ⅱ和AT1R的表达较无器质性肠道疾病志愿者肠组织Angiotensin Ⅱ和AT1R表达明显增强(21.24±4.60, 19.90±5.16, 17.87±5.30 vs 2.45±0.83; 15.98±3.66, 8.13±2.49, 8.12±2.13 vs 2.53±0.82, 均P<0.01); 不同分化程度的各组之间Angiotensin Ⅱ表达未见明显差异(P>0.05); 分化程度越高AT1R表达越少(P<0.01).
结论: AngiotensinⅡ及其Ⅰ型受体的表达与大肠癌存在一定的关系, 其深入机制需要进一步通过动物实验及体外实验来证实.
引文著录: 杨胜兰, 沈霖, 高洁嫦, 樊琼, 黄璐, 吴嫣然. 不同分化程度的大肠癌患者肠黏膜血管紧张素Ⅱ及其Ⅰ型受体的表达差异与意义. 世界华人消化杂志 2012; 20(23): 2213-2217
Revised: July 15, 2012
Accepted: August 1, 2012
Published online: August 18, 2012
AIM: To investigate the expression of Angiotensin Ⅱand AT1R in colorectal cancer.
METHODS: Fresh colonic specimens were obtained from 6 healthy volunteers and 24 patients suffering from colorectal cancer (including 6 patients with poorly differentiated adenocarcinoma, 9 patients with moderately differentiated adenocarcinoma and 9 patients with well differentiated adenocarcinoma) by endoscopic punch biopsy. The diagnosis was confirmed pathologically. Immunohistochemistry was used to examine the expression of Angiotensin Ⅱ and AT1R in the colon of patients with colorectal cancer and healthy volunteers.
RESULTS: The expression of Angiotensin Ⅱ and AT1R proteins in the colon of patients with colorectal cancer with different differentiation grades was significantly higher than that in normal controls (21.24 ± 4.60, 19.90 ± 5.16, 17.87 ± 5.30 vs 2.45 ± 0.83; 15.98 ± 3.66, 8.13 ± 2.49, 8.12 ± 2.13 vs 2.53 ± 0.82, all P < 0.01). The expression of Angiotensin II had no difference among colorectal cancer with different differentiation grades (P > 0.05). Compared to moderately and well differentiated adenocarcinoma, the expression of AT1R was higher in poorly differentiated grade (both P < 0.01).
CONCLUSION: These data suggest that Angiotensin Ⅱ and AT1R perhaps play an important role in the pathogenesis of colorectal cancer.
- Citation: Yang SL, Shen L, Gao JC, Fan Q, Huang L, Wu YR. Expression of Angiotensin Ⅱand AT1R in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(23): 2213-2217
- URL: https://www.wjgnet.com/1009-3079/full/v20/i23/2213.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i23.2213
结直肠癌是世界范围内最常见的恶性肿瘤之一, Ⅰ期结直肠癌患者术后5年生存率接近100%; 若肿瘤侵犯淋巴结(Ⅲ期)患者术后5年生存率大约为50%; 如果肿瘤发生远处转移(Ⅳ期), 患者术后生存率只有5%左右[1]. 血管紧张素(Angiotensin)Ⅱ是肾素血管紧张素系统中重要的血管活性肽, 主要功能为调节血压和维持心血管稳态. AngiotensinⅡ受血管紧张素转化酶调节, 血管紧张素转化酶抑制剂Ⅱ及AngiotensinⅠ型受体抗体也可阻滞其功能. 血管紧张素转化酶抑制剂主要用于治疗高血压、心力衰竭及糖尿病肾病等. 值得注意的是越来越多的证据表明AngiotensinⅡ参与细胞增殖、血管发生、炎症反应与组织重建, 这些功能均提示其可能在肿瘤的发生发展中起某种作用[2-4]. 本文拟观察不同分化程度大肠癌患者与无器质性肠道疾病志愿者肠组织AngiotensinⅡ及其Ⅰ受体(Angiotensin Ⅱ typeⅠreceptor, AT1R)表达差异.
大肠高分化腺癌患者9例, 大肠中分化腺癌患者9例, 大肠低分化腺癌患者6例, 无器质性肠道疾病志愿者6例被纳入试验, 肠组织通过电子结肠镜下取活检获得. AngiotensinⅡ抗体、AT1R抗体及DAB试剂盒购自武汉博士德生物公司(货号分别为BA0639、BA0582、SA1022).
活检获得的肠组织置于4%的多聚甲醛中固定→脱水→石蜡包埋→切片(厚度为4 μm)→二甲苯脱蜡(3次, 每次15 min)→水化(无水乙醇浸泡5 min, 950 mL/L乙醇浸泡5 min, 750 mL/L乙醇浸泡5 min)→PBS溶液洗涤玻片(3次, 每次5 min)→抗原修复(将玻片放入装有pH值为6.0的0.01 mmol/L枸橼酸钠溶液的抗原修复盒中, 高火微波修复3 min, 自然冷却至室温)→PBS溶液洗涤玻片(3次, 每次5 min)→玻片上滴加3%H2O2避光反应10 min(H2O2可抑制内源性过氧化物酶、使DAB显色及降低非特异性染色)→PBS溶液洗涤玻片(3次, 每次5 min)→羊血清封闭30 min(将载有玻片的湿盒置于37 ℃恒温床中, 此步骤可降低非特异性染色), 滴加兔抗人Angiotensin Ⅱ和AT1R抗体(1:150稀释, 4 ℃孵育过夜)→复温(将载有玻片的湿盒置于37 ℃度恒温床中10 min)→PBS溶液洗涤玻片(3次, 每次5 min)→滴加二抗(将载有玻片的湿盒置于37 ℃度恒温床中40 min)→PBS溶液洗涤玻片(3次, 每次5 min)→滴加HRP标记链亲和素(将载有玻片的湿盒置于37 ℃恒温床中30 min)→PBS溶液洗涤玻片(3次, 每次5min)→滴加DAB显色液(玻片在镜下可见棕黄色即用自来水充分冲洗)→苏木素复染(5 s)→盐酸酒精分化→PBS溶液洗涤玻片(3次, 每次5 min)→酒精脱水(750 mL/L乙醇浸泡5 min, 950 mL/L乙醇浸泡5 min, 无水乙醇浸泡5 min)→二甲苯中浸泡(2次, 每次15 min)→中性树胶封片→显微镜下观察拍照后运用显微图像分析系统分析试验结果.
统计学处理 免疫组织化学染色结果以DAB染色后普通显微镜下显示棕黄色为阳性表达. 每张切片随机选择5个视野以分析其阳性指数(阳性指数 = 100倍显微镜下阳性细胞数/总细胞数×100%, 此数值越大表明该蛋白表达越多). 计量数据以mean±SD表示, 单因素方差分析各组肠黏膜Angiotensin Ⅱ和AT1R表达差异, 若P<0.05则表明差异具有统计学意义.
Angiotensin Ⅱ和AT1R主要在细胞膜与细胞浆内表达(图1, 2和表1). 无器质性肠道疾病志愿者肠组织Angiotensin Ⅱ和AT1R表达很少, 大肠腺癌患者肠组织Angiotensin Ⅱ和AT1R表达则较其明显增强(P<0.01); 不同分化程度的各组之间Angiotensin Ⅱ表达未见明显差异; 分化程度越高AT1R表达越少(P<0.01).
结直肠癌全球发病率达3.6-59.1/100 000(发病率差异与种族、性别、年龄、地理区域及饮食习惯等有关), 每年新增病例大约为940 000人、死亡病例大约为500 000人, 近年大肠癌发病率与患病率呈增加趋势, 其原因可能与"西洋化的生活方式"(Westernization)有关. 尽管在发达国家, 该病死亡率呈下降趋势, 但是在资源欠缺地区(如亚洲、南美及东欧国家等), 其病死率仍很高[5-7].
新近有学者报道长时间应用肾素血管紧张素系统(renin angiotensin system, RAS)抑制剂的高血压患者罹患癌症的风险降低. Pahor等学者将750例年龄超过70岁的无肿瘤疾病史的高血压患者分为3组: β受体阻滞剂组、血管紧张素转化酶抑制剂组及钙离子拮抗剂组, 随访4年结果显示: 与β受体阻滞剂组相比较(校正年龄、性别、种族、吸烟与否、体质量指数及入院次数等影响因素后), 血管紧张素转化酶抑制剂组罹患癌症风险为0.73(95%CI: 0.30-1.78), 钙离子拮抗剂组罹患癌症风险为2.02(95%CI: 1.16-3.54)[7]. Lever等[8]学者回顾性分析5 207例高血压患者的临床资料结果显示: 与对照组相比, 1 559例长期服用血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors)的患者罹患癌症的相对风险为0.72(95%CI: 0.55-0.92)-0.65(95%CI: 0.44-0.93), 3 648例长期服用非血管紧张素转化酶抑制剂者(其中服用钙离子拮抗剂者1 416例, 服用利尿剂者2 099例, 服用β受体阻滞剂者2 681例)的相对风险为110(95%CI: 0.97-1.22)-1.03(95%CI: 0.87-1.20). 该课题组由此认为长时间服用血管紧张素转化酶抑制剂可能防癌, 但需要大样本的随机对照研究加以证实. Jick等[9]学者采用分组病例对照研究法分析长期服用钙离子拮抗剂、血管紧张素转化酶抑制剂及β受体阻滞剂的高血压患者抑制罹患癌症的风险, 结果显示: 与β受体阻滞剂组相比较, 钙离子拮抗剂组与血管紧张素转化酶抑制剂组罹患癌症风险分别为1.27(95%CI: 0.98-1.63)与0.79(95%CI: 0.58-1.06). Ronquist等[10]学者也用分组病例对照研究法发现长期服用卡托普利患者罹患前列腺癌的风险较低(0.7, 95%CI: 0.4-1.2). Neo等[11]学者观察卡托普利与依贝沙坦对小鼠肿瘤模型肿瘤生长的影响时发现: 这两种血管紧张素转化酶抑制剂都可显著肿瘤生长(P = 0.003, 0.004). Attoub等[12]学者利用高致瘤性人肺LNM35细胞移植于裸鼠制作肺癌动物模型为研究平台, 治疗组裸鼠每日灌服卡托普利2.8 mg, 3 wk后检测发现: 与模型组比较, 卡托普利可显著抑制肿瘤生长(P<0.01). van der Knaap等[2]学者随访7 679例既往无肿瘤病史的志愿者9年半, 其中730例罹患癌症, 利用Cox比例风险模型分析ACEI/D基因型与患病之间的关系发现: 高表达DD基因型者罹患乳腺癌风险较低表达Ⅱ/ⅠD基因型者高(危险比为1.47, 95%CI: 1.05-2.04), 肾素血管紧张素系统抑制剂能降低高表达DD基因型者罹患癌症的可能性. Suganuma[13]课题组用免疫组织化学法检测99例卵巢肿瘤组织病理切片AT1R及VEGF的表达, 结果显示侵袭性腺癌组织、癌前病变组织及良性肿瘤组织AT1R阳性表达率为85%、66%及14%, AT1R的表达与VEGF的表达呈正相关. 且他们的体外实验表明Angiotensin Ⅱ能显著增加AT1R阳性的卵巢癌细胞SKOV-3分泌VEGF, AT1R拮抗剂坎地沙坦可完全阻断此变化. Röcken等[14]学者利用定量逆转录聚合酶链反应和免疫组织化学法比较141例结直肠癌患者与189例结直肠腺瘤患者肠组织血管紧张素转化酶表达的差异, 发现结直肠癌患者肠组织血管紧张素转化酶表达明显增加(P<0.01). 文献资料显示体外实验证实血管紧张素转化酶抑制剂可修饰基因表达、抑制肿瘤细胞的增殖和侵袭能力、抑制上皮细胞迁移、拮抗血管新生, 体内实验证实其可抑制肿瘤生长与转移[15].
但Friis等[16]学者通过大样本人群研究未能证实血管紧张素转化酶抑制剂的防癌作用. 该课题组耗时3年半随访17 897例长期服用血管紧张素转化酶抑制剂的高血压患者, 将此类人群癌症发病率与普通人群癌症发病率相比较, 结果显示: 17 897例长期服用血管紧张素转化酶抑制剂的高血压患者中有909例罹患癌症, 相同样本量的普通人群有846例罹患癌症. Li等[17]学者1997-1999年招募到华盛顿州975例乳腺癌患者与1 007例健康志愿者, Logistic回归分析乳腺癌发生于长期服用降压药的关系, 结果表明: 服用降压药与否与罹患癌症与否两者之间没有相关性, 服用3种不同降压药(钙离子拮抗剂、β受体阻滞剂及血管紧张素转化酶抑制剂)的高血压患者罹患乳腺癌风险没有统计学意义. 有学者也报道过类似的研究结果[17-20]. 因此需进一步扩大样本量进行深入研究.
尽管前人的研究存在这样那样的争议, 我们课题组实验结果表明大肠腺癌患者肠黏膜Angiotensin Ⅱ和AT1R表达较无器质性肠道疾病志愿者肠组织明显增强; 不同分化程度的各组之间Angiotensin Ⅱ表达未见明显差异; 分化程度越高AT1R表达越少. 这些结果提示我们ANG Ⅱ-AT1R信号通路参与大肠癌的发病过程, AT1R表达与结直肠癌分化程度呈负相关. 当然, 这些初步结论需要进一步通过动物实验及体外实验来证实.
血管紧张素(Angiotensin)Ⅱ是肾素血管紧张素系统中重要的血管活性肽, 主要功能为调节血压和维持心血管稳态. AngiotensinⅡ受血管紧张素转化酶调节, 血管紧张素转化酶抑制剂及AngiotensinⅠ型受体抗体也可阻滞其功能. 血管紧张素转化酶抑制剂主要用于治疗高血压、心力衰竭及糖尿病肾病等. 值得注意的是越来越多的证据表明AngiotensinⅡ参与细胞增殖、血管发生、炎症反应与组织重建, 这些功能均提示其可能在肿瘤的发生发展中起某种作用.
许玲, 教授, 主任医师, 上海中医药大学附属龙华医院肿瘤科
Pahor等学者将750例年龄超过70岁的无肿瘤疾病史的高血压患者分为3组: β受体阻滞剂组、血管紧张素转化酶抑制剂组及钙离子拮抗剂组, 随访4年结果显示: 与β受体阻滞剂组相比较(校正年龄、性别、种族、吸烟与否、体质量指数及入院次数等影响因素后), 血管紧张素转化酶抑制剂组罹患癌症风险为0.73(95%CI: 0.30-1.78), 钙离子拮抗剂组罹患癌症风险为2.02(95%CI: 1.16-3.54).
本课题组实验结果表明大肠腺癌患者肠黏膜Angiotensin Ⅱ和AT1R表达较无器质性肠道疾病志愿者肠组织明显增强; 不同分化程度的各组之间Angiotensin Ⅱ表达未见明显差异; 分化程度越高AT1R表达越少. 这些结果提示ANG Ⅱ-AT1R信号通路参与大肠癌的发病过程, AT1R表达与结直肠癌分化程度呈负相关.
本课题立题新颖, 设计合理, 结果可靠, 具有很好的可读性.
编辑: 李军亮 电编:鲁亚静
| 1. | Nicolay C, Purkayastha S, Darzi A. Minimally invasive surgery for colorectal cancer. Expert Rev Anticancer Ther. 2010;10:469-471. [PubMed] [DOI] |
| 2. | van der Knaap R, Siemes C, Coebergh JW, van Duijn CM, Hofman A, Stricker BH. Renin-angiotensin system inhibitors, angiotensin I-converting enzyme gene insertion/deletion polymorphism, and cancer: the Rotterdam Study. Cancer. 2008;112:748-757. [PubMed] [DOI] |
| 3. | Deshayes F, Nahmias C. Angiotensin receptors: a new role in cancer? Trends Endocrinol Metab. 2005;16:293-299. [DOI] |
| 4. | Louis SN, Wang L, Chow L, Rezmann LA, Imamura K, MacGregor DP, Casely D, Catt KJ, Frauman AG, Louis WJ. Appearance of angiotensin II expression in non-basal epithelial cells is an early feature of malignant change in human prostate. Cancer Detect Prev. 2007;31:391-395. [PubMed] [DOI] |
| 5. | Center MM, Jemal A, Smith RA, Ward E. Worldwide variations in colorectal cancer. CA Cancer J Clin. 2009;59:366-378. [PubMed] [DOI] |
| 6. | Ries LA, Wingo PA, Miller DS, Howe HL, Weir HK, Rosenberg HM, Vernon SW, Cronin K, Edwards BK. The annual report to the nation on the status of cancer, 1973-1997, with a special section on colorectal cancer. Cancer. 2000;88:2398-2424. [PubMed] [DOI] |
| 7. | Neo JH, Ager EI, Angus PW, Zhu J, Herath CB, Christophi C. Changes in the renin angiotensin system during the development of colorectal cancer liver metastases. BMC Cancer. 2010;10:134. [PubMed] [DOI] |
| 8. | Lever AF, Hole DJ, Gillis CR, McCallum IR, McInnes GT, MacKinnon PL, Meredith PA, Murray LS, Reid JL, Robertson JW. Do inhibitors of angiotensin-I-converting enzyme protect against risk of cancer? Lancet. 1998;352:179-184. [PubMed] [DOI] |
| 9. | Jick H, Jick S, Derby LE, Vasilakis C, Myers MW, Meier CR. Calcium-channel blockers and risk of cancer. Lancet. 1997;349:525-528. [PubMed] [DOI] |
| 10. | Ronquist G, Rodríguez LA, Ruigómez A, Johansson S, Wallander MA, Frithz G, Svärdsudd K. Association between captopril, other antihypertensive drugs and risk of prostate cancer. Prostate. 2004;58:50-56. [PubMed] [DOI] |
| 11. | Neo JH, Malcontenti-Wilson C, Muralidharan V, Christophi C. Effect of ACE inhibitors and angiotensin II receptor antagonists in a mouse model of colorectal cancer liver metastases. J Gastroenterol Hepatol. 2007;22:577-584. [PubMed] [DOI] |
| 12. | Attoub S, Gaben AM, Al-Salam S, Al Sultan MA, John A, Nicholls MG, Mester J, Petroianu G. Captopril as a potential inhibitor of lung tumor growth and metastasis. Ann N Y Acad Sci. 2008;1138:65-72. [PubMed] [DOI] |
| 13. | Suganuma T, Ino K, Shibata K, Kajiyama H, Nagasaka T, Mizutani S, Kikkawa F. Functional expression of the angiotensin II type 1 receptor in human ovarian carcinoma cells and its blockade therapy resulting in suppression of tumor invasion, angiogenesis, and peritoneal dissemination. Clin Cancer Res. 2005;11:2686-2694. [PubMed] [DOI] |
| 14. | Röcken C, Neumann K, Carl-McGrath S, Lage H, Ebert MP, Dierkes J, Jacobi CA, Kalmuk S, Neuhaus P, Neumann U. The gene polymorphism of the angiotensin I-converting enzyme correlates with tumor size and patient survival in colorectal cancer patients. Neoplasia. 2007;9:716-722. [PubMed] [DOI] |
| 15. | Lindberg H, Nielsen D, Jensen BV, Eriksen J, Skovsgaard T. Angiotensin converting enzyme inhibitors for cancer treatment? Acta Oncol. 2004;43:142-152. [PubMed] [DOI] |
| 16. | Friis S, Sørensen HT, Mellemkjaer L, McLaughlin JK, Nielsen GL, Blot WJ, Olsen JH. Angiotensin-converting enzyme inhibitors and the risk of cancer: a population-based cohort study in Denmark. Cancer. 2001;92:2462-2470. [PubMed] [DOI] |
| 17. | Li CI, Malone KE, Weiss NS, Boudreau DM, Cushing-Haugen KL, Daling JR. Relation between use of antihypertensive medications and risk of breast carcinoma among women ages 65-79 years. Cancer. 2003;98:1504-1513. [PubMed] [DOI] |
| 18. | Meier CR, Derby LE, Jick SS, Jick H. Angiotensin-converting enzyme inhibitors, calcium channel blockers, and breast cancer. Arch Intern Med. 2000;160:349-353. [PubMed] [DOI] |
| 19. | González-Pérez A, Ronquist G, García Rodríguez LA. Breast cancer incidence and use of antihypertensive medication in women. Pharmacoepidemiol Drug Saf. 2004;13:581-585. [PubMed] [DOI] |
| 20. | Perron L, Bairati I, Harel F, Meyer F. Antihypertensive drug use and the risk of prostate cancer (Canada). Cancer Causes Control. 2004;15:535-541. [PubMed] [DOI] |