修回日期: 2012-06-08
接受日期: 2012-08-01
在线出版日期: 2012-08-18
目的: 研究血管内皮生长因子受体3(vascular endothelial growth factor receptor 3, VEGFR-3)小干扰RNA对结肠癌细胞移植瘤模型生长的影响.
方法: 构建VEGFR-3小干扰RNA表达载体. 将结肠癌LoVo细胞注射入裸鼠皮下建造裸鼠移植瘤模型. 将15只裸鼠结肠癌模型随机分成3组: 实验组(pG-siRNA/VEGFR-3重组质粒)、阴性对照组(pG-HK重组质粒)与空白对照组. 分别瘤体内注射相应的siRNA混合物或转染剂混合液, 每3 d注射1次, 共注射3次, 观察肿瘤体积的变化; 6 wk后处死裸鼠, 肿瘤称取质量, 并进行qRT-PCR和Western blot测定VEGFR-3 mRNA和蛋白的变化, 通过免疫组织化学进行微淋巴管计数.
结果: 实验组移植瘤体积和质量明显小于阴性对照组和空白对照组, 有显著的统计学意义(P<0.001). 实验组抑制率为52.75%, 与对照组相比, 差异有显著(P<0.001). qRT-PCR和Western blot测定VEGFR-3 mRNA和蛋白的变化比较, 实验组有明显降低(P<0.001). 实验组淋巴管计数较对照组差异显著(P<0.05).
结论: VEGFR-3 siRNA可以抑制裸鼠结肠癌细胞移植瘤的生长, 并减少裸鼠移植瘤淋巴管生成, 能有效抑制结肠癌细胞的生长.
引文著录: 吕志诚, 苏芝兰, 王海忠, 杨文元, 张锋军. VEGFR-3小干扰RNA对结肠癌裸鼠移植瘤生长的影响. 世界华人消化杂志 2012; 20(23): 2189-2193
Revised: June 8, 2012
Accepted: August 1, 2012
Published online: August 18, 2012
AIM: To investigate the inhibory effect of siRNA-mediated down-regulation of vascular endothelial growth factor receptor 3 (VEGFR-3) on the growth of human colorectal carcinoma cell xenografts in nude mice.
METHODS: Human colorectal carcinoma LoVo cells were transplanted subcutaneously into Balb/c nude mice to establish a xenograft tumor model. Fifteen model mice were randomized into three groups and were injected with recombinant plasmid carrying the siRNA (pG-siRNA/VEGFR-3), empty plasmid (pG-HK), and tranfection reagent (control), respectively. Tumor volume and weight were measured, and the reduced rate of tumor growth was calculated. VEGFR-3 mRNA and protein expression was detected by qRT-PCR and Western blot. Microlyphamatic vessels were counted by immunohistochemistry.
RESULTS: Tumor volume and weight were significantly less in the pG-siRNA/VEGFR-3 group than in the pG-HK and control group (both P < 0.001). Compared to the control group, the reduced rate of tumor growth was 52.75%, and VEGFR-3 expression was down-regulated in the pG-siRNA/VEGFR-3 group. However, there was no similar inhibitory effect in the control group and pG-HK group. Significant differences in microlymphatic counts were noted between the pG-siRNA/VEGFR-3 group and the two control groups (both P < 0.05).
CONCLUSION: SiRNA-mediated down-regulation of VEGFR-3 could inhibit the growth of human colorectal cancer cell xenografts in nude mice and reduce lymphangiogenesis.
- Citation: Lv ZC, Su ZL, Wang HZ, Yang WY, Zhang FJ. SiRNA-mediated down-regulation of vascular endothelial growth factor receptor 3 inhibits the growth of human colorectal cancer cell xenografts in nude mice. Shijie Huaren Xiaohua Zazhi 2012; 20(23): 2189-2193
- URL: https://www.wjgnet.com/1009-3079/full/v20/i23/2189.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i23.2189
结肠癌在我国的发病率有逐渐增加的趋势, 结肠癌和其他恶性肿瘤一样, 晚期几乎都会发生远处转移. 淋巴途径转移是胃肠道肿瘤最重要的转移方式, 但淋巴转移的研究相对滞后. 血管内皮生长因子受体3(vascular endothelial growth factor receptor 3, VEGFR-3)是最主要的淋巴管生成因子, 在肿瘤的发生和发展中起着非常重要的作用[1,2]. VEGFR-3通过和VEGF-C、-D的结合, 激活下游的信号通路, 不仅促进淋巴管的生成, 而且对肿瘤的侵袭、增殖和转移密切相关, 其在肿瘤治疗上的应用已成为研究的热点[3,4]. 本研究通过建立裸鼠的结肠癌模型, 构建针对VEGFR-3基因的siRNA真核表达质粒pG-siRNA/VEGFR-3, 将其注射入裸鼠的结肠癌肿瘤中, 观察该表达质粒对结肠癌体内生长的影响, 期望为结肠癌的临床的治疗开辟一条新的途径.
人结肠癌LoVo细胞株购自中国科学院上海细胞所; 胎牛血清购自杭州四季青生物制品有限公司; RPMI 1640培养基购自Gibco公司; 细胞培养使用含100 mL/L胎牛血清, 青霉素100 U/mL, 链霉素100 mg/ mL, 在37 ℃、50 mL/L CO2细胞孵育箱内培养. 脂质体LipofectarmineTM 2000购自lnvitrogen公司, 限制性内切酶Hind Ⅲ、BamH Ⅰ, T4 DNA连接酶RT-PCR试剂盒均为大连TaKaRa生物公司产品; 琼脂糖凝胶回收试剂盒购自上海生工公司; RNA提取试剂TRIzol、DEPC购自美国Roche公司; 醋酸纤维膜购自瑞典Amersham公司; 小鼠抗人VEGFR-3单克隆抗体购自美国Abcom公司; 兔抗人β-actin抗体、HRP标记的羊抗兔二抗及兔抗鼠二抗均购自北京中杉生物技术公司; Balb/c雌性裸鼠购自上海斯莱克实验动物中心.
1.2.1 siRNA的设计和siRNA表达载体的构建: 在Genbank中找到VEGFR-3基因的cDNA序列(NM_002020), 根据Elbashir的设计原则, 并参考在线siRNA靶点设计软件(http: //http://www.ambion.com/techlib/mis/sirna-finder.html)确定靶序列. 根据质粒载体质粒载体Genesil的多克隆位点特点, 设计了靶向VEGFR-3家族同源基因片段451-472位点的序列: 5'-GAGAGACTTTGAGCAGCCATT-3'(sense) and 5'-AATGGCTGCTCAAAGTCTCTC-3'(antisense), 命名为pG-siRNA/VEGFR-3. 同时, 设计非特异性dsRNA的序列作为对照: 5'-GACTTCATAAGGCGCATGC-3'(sense) and 5'-GCATGCGCCTTATGAAGTC-3'(antisense), 命名为pG-HK, 由武汉晶赛生物工程公司合成.
1.2.2 动物饲养: 4周龄♀ Balb/c裸小鼠15只, 4-6 mo, 体质量为12.5-14.5 g, 饲养于中国人民解放军兰州军区兰州总医院实验动物中心. 25 ℃-37 ℃无菌恒温、恒湿(45%-50%)的SPF层流罩中饲养, 所有饲料、饮用水及垫料经高压灭菌处理, 每3 d 更换饲料、饮用水及垫料. 为减少进出次数避免污染, 每次更换前进行体质量和肿瘤大小的测量.
1.2.3 结肠癌移植瘤模型的建立: 人结肠癌LoVo细胞株在含100 mL/L胎牛血清的RPMI 1640培养基内加青霉素100 U/mL、链霉素100 U/mL, 置于37 ℃、50 mL/L CO2及饱和湿度条件下培养. 取对数生长期的LoVo细胞, 用胰酶消化后, 离心去除上清液, PBS溶液重悬细胞, 制备获得1.5×106个/mL的细胞悬液, 取0.2 mL接种于裸鼠左颈部皮下. 观察移植瘤生长情况. 1 wk后待肿瘤形成开始用游标卡尺每隔7 d测量一次肿瘤的长径(a)及宽径(b), 肿瘤体积计算公式如下: V = (ab2)/2, 待肿瘤体积达40 mm3左右时, 将其随机分为3组, 分别为实验组(pG-siRNA/VEGFR-3重组质粒)、阴性对照组(pG-HK重组质粒)与空白对照组. 每组5只裸鼠, 各组瘤体内注射相应的siRNA混合物或转染剂混合液进行瘤内注射治疗. 实验组每次每只用无菌微量注射器肿瘤体内分别多点注射含有pG-siRNA/VEGFR-3重组质粒的转染试剂混合液(转染试剂按照Invitroen公司的LipofectamineTM 2000的说明书配制, 质粒为50 μg) 200 μL; 阴性对照组注射仍为内含有pG-HK质粒50 μg的转染剂混合液200 μL, 空白对照组仅为转染剂混合液, 内无任何质粒. 6 d和第9 d分别再注射1次, 共3次, 每隔7 d测量肿瘤最大和最小直径, 计算肿瘤体积. 6 mo后处死裸鼠, 取出肿瘤标本, 称其质量, 计算抑瘤率. 部分放置于-80 ℃冷冻保存以进行下一步基因测定, 部分于10%多聚甲醛溶液中固定, 常规石蜡包埋切片. 抑瘤率(%) = (空白对照组肿瘤质量-实验组肿瘤质量)/空白对照组肿瘤质量×100%.
1.2.4 qRT-PCR法检测血管内皮生长因子受体3 mRNA的表达: 提取总RNA, 将收集的细胞在1 mL TRIzol试剂中匀浆, 经离心后与异丙酮混合, 室温孵育10 min. 于4 ℃离心15 min, 弃上清, 沉淀块用700 mL/L乙醇冲洗后, 以50 μL DEPC水溶解. 经纯化后将RNA沉淀溶解于DEPC处理的水中, 用分光光度计测量RNA浓度, 于-80 ℃保存备用. 在50 μL的反应体系中加入5 μg总RNA, 5×反应缓冲液10 μL, 10 mmol/L dNTPs 5 μL, RNasin(40 U/μL) 0.5 μL, Oligo(dT) 0.25 μg, 反转录酶(Superscript Ⅱ, 200 U/μL) 2 μL, 0.1 mol/L DTT 0.5 μL, 置37 ℃孵育1 h, 然后在65 ℃加热5 min终止反应. 将cDNA保存于-20 ℃. 采用Primer 5.0引物设计软件设计引物. VEGFR-3特异性PCR引物为上游引物(F): 5'-GACCAGACCATGCTTCAGTGAGA-3'; 下游引物(R): 5'-GTTGCATGGCTGTTCACAGGA-3', 扩增产物为151 bp. 内参β-actin引物序列上游引物为: 5'-TCATGAAGTGTGACGTTGCATCCGT-3'; 下游引物为: 5'-CCTAGAAGCATTTGCGGTGCCGATG-3', 扩增产物片段长100 bp. 分别将各样品行10倍稀释. 浓度梯度为105/2 mL-1010/2 μL. 反应体系如下: PremixExTaqTM(2×) 12.5 μL、引物(10 μmol/L)1.0 μL、SYBRGreen Ⅰ稀释液2.5 μL、dH2O 7.0 μL, 模板2 μL, 总体积25 μL. 1-6号作为标准曲线管. 按浓度梯度加入标准品DNA 2 μL, 7号管作为空白对照管. 其余12管按次序加入样本cDNA 2 μL. 荧光定量PCR的扩增条件同标准品的制备. 通过顺序检测系统观察各扩增曲线、融解曲线, 标准曲线的线形回归系数R值, 统计软件自动进行各样本的mRNA拷贝数的计算. 以VEGFR-3 mRNA与β-actin mRNA拷贝数之比对结果进行标准化.
1.2.5 Western blot检测VEGFR-3表达: 取各组移植瘤组织各50 mg, 加约5倍湿重的裂解缓冲液, 碾磨粉碎匀浆, 裂解细胞提取总蛋白, 于4 ℃离心, 15 000 r/min×10 min, 取上清, 用酚试剂法测蛋白浓度. 用凝胶加样缓冲液将各管蛋白浓度调为2 g/L, 电泳, 4%浓缩胶, 12.5%分离胶, 120 V、50 mA、1.5 h; 转膜, 50 V、100 mA、2 h. 用含5%脱脂奶粉的TBS将膜封闭2 h, TBST漂洗2次×10 min, 分别入VEGFR-3抗体(1:500)、β-actin抗体(1:1 000)孵育, 4 ℃过夜, TBST洗2次×10 min, 分别加入碱性磷酸酶标记山羊抗兔IgG(1:2 000)室温孵育2 h, TBST洗2次×5 min. 将滤膜放入配好的显色液中显色15-30 min, 取出滤膜, 蒸馏水冲洗, 晾干, 扫描, 软件分析条带的吸光度(A)值, 以VEGFR-3 A值与β-actin A值之比进行标准化处理.
1.2.6 免疫组织化学并淋巴管计数: 标本用10%多聚甲醛固定, 石蜡包埋组织连续4 μm连续切片, 二甲苯脱蜡, VEGFR-3工作浓度为1:200; DAB显色; SP法染色操作按说明书. PBS代替一抗作为阴性对照. 结果判定: 胞质或者胞膜出现棕黄色颗粒者为VEGFR-3阳性细胞. VEGFR-3阳性微淋巴管结果判断及计数方法按照文献进行[5].
统计学处理 所有数据均经SPSS11.0软件进行统计分析, 计量资料采用mean±SD表示; 两组均数的比较采用t检验; 两组以上均数的比较用方差分析(ANVOA). 以P<0.05为差异有显著性.
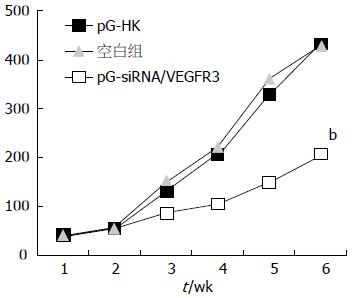
人结肠癌细胞株LoVo接种小鼠7 d, 所有裸鼠体内均肿瘤形成, 各组开始多点注射质粒, 肿瘤生长良好. 结果表明: 在观察的3 mo开始, 实验组pG-siRNA/VEGFR-3与阴性对照组pG-HK和空白对照组比较, 差异有统计学意义(P<0.001), 后两组生长明显快于实验组, 而阴性对照组和空白对照组之间经比较, 则差异无统计学意义(图1).
所有小鼠6 mo后处死, 取出肿瘤, 称取肿瘤质量并计算抑瘤率. 42 d时裸鼠移植瘤平均质量为: 实验组2.03 g±0.32 g, 阴性对照组5.21 g±0.25 g, 空白对照组5.18 g±0.30 g. 结果表明, 实验组抑制率为60.81%, 与对照组相比, 差异有显著(P<0.001)阴性对照组的肿瘤抑制率分别为5.79%, 与空白对照组, 差异不显著.
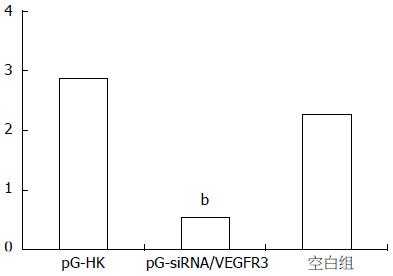
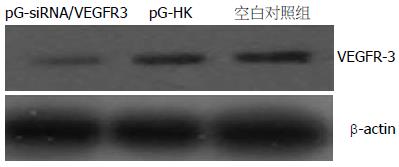
实时荧光定量PCR结果表明, VEGFR-3和β-actin的标准曲线的制备均在线性范围内, PCR扩增产物融解曲线满足要求. 阴性对照组和空白对照组的VEGFR-3的基因表达水平(VEGFR-3/β-actin)无显著差异(P>0.05), 明显高于实验组的表达水平, 与对照组相比, 实验组有41.08%减少, 差异有统计学意义(P<0.001, 图2). Western blot检测发现在实验组中VEGFR-3蛋白的表达明显低于阴性对照组和空白对照组(图3).
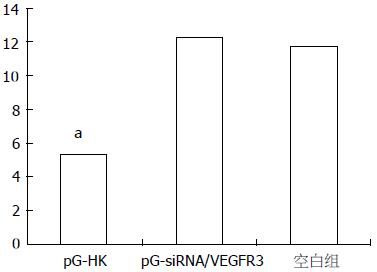
各组裸鼠移植瘤细胞中VEGFR-3蛋白染色主要定位于细胞质, 细胞膜和淋巴管中, 呈棕黄色, 对照组与干扰组相比淋巴管较丰富, 在肿瘤间质出现被染成棕黄色的毛细淋巴管, 部分淋巴管扩张, 每组肿瘤组织切片的LVD值计算结果, 差异有统计学意义(P<0.05, 图4).
淋巴转移是恶性肿瘤发生转移的主要途径之一. 血管/淋巴管新生在恶性肿瘤进展和浸润转移过程中发挥着重要作用, 淋巴结转移是判断结肠癌患者预后和确定治疗方案的重要依据, 晚期患者几乎都会发生淋巴转移, 故以结肠癌血管淋巴管生成的各个环节为靶点, 通过其对结肠癌抗淋巴管生成的治疗, 有效地抑制结肠癌的转移、生长和复发, 提高结肠癌患者5年生存率具有重要意义.
VEGFR-3(也称Flt4)是膜受体介导的酪氨酸蛋白激酶受体家族成员, 是淋巴管特异性标志物. 主要的生理作用是参与淋巴管的生成, 其与配体VEGF-C结合后, 诱导内皮细胞的增殖和迁移, 调控淋巴管的生成. 同时VEGFR-3与肿瘤的淋巴道转移密切相关. 在对VEGFR-3的研究中发现, 在非小细胞肺癌、大肠癌、子宫内膜癌、卵巢癌、原发性乳腺癌、前列腺癌、胃癌中VEGFR-3表达与患者的生存时间有相关性, 且认为VEGFR-3的是一个独立的预后因素; VEGFR-3的高表达与淋巴管浸润, 淋巴结转移及不良生存预后相关[6-11].
小干扰RNA技术由于其基因阻断的有效性和特异性已成为疾病基因疗法的理想的工具. 在肿瘤的研究中, 应用siRNA技术可以特异地下调原癌基因、抑癌基因、凋亡相关基因等靶基因使肿瘤细胞生长受抑制, 从而达到治疗肿瘤的目的. 由于其高稳定性、高效性、高特异性和高穿透性地发挥其RNA抑制肿瘤基因表达, siRNA可为肿瘤的靶向治疗开辟一条新的途径.
本研究将VEGFR-3作为靶位点, 设计并化学合成针对VEGFR-3的siRNA小片段并构建相关的表达载体, 通过裸鼠的移植瘤模型进行实验来研究siRNA VEGFR-3能否利用RNA干扰技术特异、有效地抑制结肠癌细胞株LoVo细胞中VEGFR-3的表达和癌细胞的生长能力.
我们待肿瘤形成后, 选择每3 d肿瘤内多点注射混有转染剂LipofectamineTM 2000的载体和单纯转染剂的混合液, 观察肿瘤生长情况. 和空白对照组和阴性对照组相比, siRNA组肿瘤生长明显受到抑制, 而阴性对照组和空白对照组相比没有差异. 待6 mo后, 处死动物后, 对移植瘤进行VEGFR-3 mRNA和蛋白表达分析表明, siRNA组VEGFR-3表达明显受到抑制. 而移植瘤免疫组化和HE染色分析发现, siRNA组的肿瘤细胞出现细胞凋亡现象, 说明通过小干扰RNA技术抑制结肠癌细胞VEGFR-3的表达, 可以有效抑制肿瘤的生长. 而免疫组织化学分析也发现siRNA组的肿瘤中淋巴管密度较其他两对照组有明显减少. 通过本研究显示: 靶向VEGFR-3的小干扰RNA表达载体可以抑制结肠癌细胞的生长, 减少肿瘤组织中淋巴管的生成, 提示我们通过靶向VEGFR-3的RNA干扰技术可以有效控制结肠癌肿瘤的生长, 为结肠癌靶向治疗提供新的思路.
我国结肠癌的发病率有逐渐增加的趋势, 结肠癌淋巴途径转移是最重要的转移方式, Gore和Newman等研究发现VEGFR-3通过和VEGF-C、-D的结合, 促进淋巴管的生成, 起着重要的作用, 阻断该信号途径可以为肿瘤生物治疗提供重要途径.
王炳元, 教授, 中国医科大学附属第一医院消化内科
本研究通过应用小干扰RNA表达载体阻断VEGFR-3, 观察该表达质粒对结肠癌体内生长的影响, 期望为结肠癌的临床的治疗开辟一条新的途径.
Lui等通过VEGFR-3的小干扰RNA降低其表达, 抑制了肿瘤细胞的生长. He等将可溶性VEGFR3-Ig的融合蛋白通过载体阻断VEGFR-3信号途径, 从而抑制了肿瘤的淋巴管血管生成和淋巴结转移.
本试验通过RNA干扰的方法抑制人结肠癌VEGFR-3的表达, 减少了移植瘤的增长, 具有一定的创新性.
利用RNA干扰抑制VEGFR-3的表达, 为进一步阐明VEGFR-3的作用机制和预防淋巴结转移提供了方法和途径, 有着十分重要的理论和实践意义.
siRNA: 是一种短片段双链RNA分子, 能够以同源互补序列的mRNA为靶目标降解特定的mRNA, 从而下调相应基因的表达.
本文进行靶向VEGFR-3基因RNA干扰表达载体的构建, 并应用于裸鼠移植瘤模型, 研究过程复杂, 总体设计合理, 方法得当, 结论有一定的科学性, 为肿瘤基因治疗体内研究提供新途径.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Smith NR, Baker D, James NH, Ratcliffe K, Jenkins M, Ashton SE, Sproat G, Swann R, Gray N, Ryan A. Vascular endothelial growth factor receptors VEGFR-2 and VEGFR-3 are localized primarily to the vasculature in human primary solid cancers. Clin Cancer Res. 2010;16:3548-3561. [PubMed] [DOI] |
| 2. | Lui Z, Ma Q, Wang X, Zhang Y. Inhibiting tumor growth of colorectal cancer by blocking the expression of vascular endothelial growth factor receptor 3 using interference vector-based RNA interference. Int J Mol Med. 2010;25:59-64. [PubMed] |
| 3. | Gore AV, Swift MR, Cha YR, Lo B, McKinney MC, Li W, Castranova D, Davis A, Mukouyama YS, Weinstein BM. Rspo1/Wnt signaling promotes angiogenesis via Vegfc/Vegfr3. Development. 2011;138:4875-4886. [PubMed] [DOI] |
| 4. | Newman B, Lose F, Kedda MA, Francois M, Ferguson K, Janda M, Yates P, Spurdle AB, Hayes SC. Possible genetic predisposition to lymphedema after breast cancer. Lymphat Res Biol. 2012;10:2-13. [PubMed] [DOI] |
| 5. | He Y, Rajantie I, Pajusola K, Jeltsch M, Holopainen T, Yla-Herttuala S, Harding T, Jooss K, Takahashi T, Alitalo K. Vascular endothelial cell growth factor receptor 3-mediated activation of lymphatic endothelium is crucial for tumor cell entry and spread via lymphatic vessels. Cancer Res. 2005;65:4739-4746. [PubMed] [DOI] |
| 6. | Donnem T, Andersen S, Al-Saad S, Al-Shibli K, Busund LT, Bremnes RM. Prognostic impact of angiogenic markers in non-small-cell lung cancer is related to tumor size. Clin Lung Cancer. 2011;12:106-115. [PubMed] [DOI] |
| 7. | Khromova N, Kopnin P, Rybko V, Kopnin BP. Downregulation of VEGF-C expression in lung and colon cancer cells decelerates tumor growth and inhibits metastasis via multiple mechanisms. Oncogene. 2012;31:1389-1397. [PubMed] [DOI] |
| 8. | Donoghue JF, Lederman FL, Susil BJ, Rogers PA. Lymphangiogenesis of normal endometrium and endometrial adenocarcinoma. Hum Reprod. 2007;22:1705-1713. [PubMed] [DOI] |
| 9. | Klasa-Mazurkiewicz D, Jarząb M, Milczek T, Lipińska B, Emerich J. Clinical significance of VEGFR-2 and VEGFR-3 expression in ovarian cancer patients. Pol J Pathol. 2011;62:31-40. [PubMed] |
| 10. | Raica M, Cimpean AM, Ceausu R, Ribatti D. Lymphatic microvessel density, VEGF-C, and VEGFR-3 expression in different molecular types of breast cancer. Anticancer Res. 2011;31:1757-1764. [PubMed] |
| 11. | Ozmen F, Ozmen MM, Ozdemir E, Moran M, Seçkin S, Guc D, Karaagaoglu E, Kansu E. Relationship between LYVE-1, VEGFR-3 and CD44 gene expressions and lymphatic metastasis in gastric cancer. World J Gastroenterol. 2011;17:3220-3228. [PubMed] |