修回日期: 2012-06-29
接受日期: 2012-08-01
在线出版日期: 2012-08-18
目的: 观察针刺对功能性消化不良(functional dyspepsia, FD)患者脑功能的影响, 探讨针刺治疗FD的中枢机制.
方法: 以肝郁型FD患者为研究对象, 以正电子发射计算机断层扫描技术为研究手段, 以疏肝解郁常用的足少阳胆经穴为电针刺激点, 观察针刺治疗FD患者的临床疗效及针刺前后患者脑葡萄糖代谢的变化. 采用尼平消化不良指数(nepean dyspepsia index, NDI)评价针刺治疗效应, 采用统计参数图软件分析针刺治疗前后患者脑功能的变化.
结果: 与治疗前相比, 针刺治疗后患者NDI症状积分显著减低(32.30±13.17 vs 52.10±14.69), NDI生活质量评分显著增高(88.57±11.59 vs 75.45±17.52, P<0.05); 患者双侧小脑、前扣带回、海马、海马旁回以及左侧脑岛等边缘系统脑区的葡萄糖代谢显著降低(P<0.005).
结论: 针刺足少阳胆经穴可以有效改善肝郁型FD患者临床症状, 其治疗效应的发挥可能与改善FD患者边缘系统为主脑功能活动异常, 调节与病情相关的脑岛、前扣带回和小脑功能有关.
引文著录: 曾芳, 兰蕾, 刘迈兰, 卢圣峰, 唐勇, 刘旭光, 梁繁荣. 针刺足少阳胆经穴对功能性消化不良患者脑葡萄代谢的影响. 世界华人消化杂志 2012; 20(23): 2146-2150
Revised: June 29, 2012
Accepted: August 1, 2012
Published online: August 18, 2012
AIM: To explore the central mechanism of therapeutic effect of acupuncture on functional dyspepsia (FD) by investigating cerebral responses to acupuncture treatment in FD patients.
METHODS: Ten FD patients were enrolled in this study. PET-CT scan was performed on each patient at baseline and after electro-acupuncture treatment. The nepean dyspepsia index (NDI) was used to evaluate the therapeutic effects of acupuncture treatment. Statistical Parametric Mapping 5.0 was used to analyze changes in cerebral glucose metabolism elicited by acupuncture treatment.
RESULTS: After electro-acupuncture treatment, the NDI symptom scores were significantly decreased (32.30 ± 13.17 vs 52.10 ± 14.69, P < 0.05) and the NDI quality of life scores were increased (88.57 ± 11.59 vs 75.45 ± 17.52, P < 0.05) in FD patients. Glucose metabolism in the bilateral cerebellum, anterior cingulate cortex, hippocampus and para-hippocampus, and left insula was significantly decreased (P < 0.005, uncorrected).
CONCLUSION: Acupuncture treatment improved the symptoms of FD patients. The therapeutic effect of acupuncture treatment for FD might be associated with regulating the cerebral activities of the regions in the limbic system, especially the cerebellum, anterior cingulate cortex, and insula.
- Citation: Zeng F, Lan L, Liu ML, Lu SF, Tang Y, Liu XG, Liang FR. Cerebral responses to acupuncture at acupoints of gallbladder meridian in patients with functional dyspepsia. Shijie Huaren Xiaohua Zazhi 2012; 20(23): 2146-2150
- URL: https://www.wjgnet.com/1009-3079/full/v20/i23/2146.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i23.2146
功能性消化不良(functional dyspepsia, FD)是一种以非器质性、代谢性疾病引起的长期、持续的餐后饱胀不适、早饱、上腹部疼痛和上腹部烧灼感为主要特征的临床常见消化系疾病. 目前, FD以其高发病率[1]、高社会经济负担[2]和对生活质量的显著影响[3]而成为重要的社会公共卫生问题. 针刺治疗FD疗效确切. 大量的古代文献记载表明针灸治疗FD相关症状历史悠久且安全有效. 现代的临床研究也证实了针刺治疗FD的有效性. 课题组前期开展的多中心、大样本、临床随机对照研究显示[4], 针刺足少阳胆经穴能显著改善FD患者症状、提高患者生活质量, 且其疗效优于非经非穴组和西药对照组. 但针刺足少阳胆经穴治疗FD的中枢机理尚不清晰. 近年来的神经影像学研究显示, 以边缘系统为主的中枢神经系统功能异常可能是FD的重要病理特征[5-7]. 我们前期的研究也证实, FD患者以边缘系统为主的多个脑区葡萄糖代谢显著增高[8]. 那么, 针刺足少阳胆经穴对FD的治疗效应是否与降低边缘系统异常增高的葡萄糖代谢、调节中枢神经系统功能有关?因此, 本研究以肝郁气滞型FD患者为研究对象, 正电子发射计算机断层扫描(positron emission tomography-computed tomography, PET-CT)为研究手段, 观察针刺足少阳胆经穴对FD患者脑葡萄糖代谢的影响, 探讨针刺足少阳胆经穴治疗FD的中枢机制, 为针刺治疗FD的临床运用提供可视化的试验依据.
本研究共纳入FD患者10例, 均来自成都中医药大学附属医院消化内科门诊. 患者纳入标准包括: 符合FD罗马Ⅲ诊断标准者; 中医辨证属于肝郁气滞型者; 右利手, 20岁≤年龄≤30岁者; 在进入研究前至少15 d内未服用过任何胃肠促动力药, 未参加其他临床研究者; 签署知情同意书, 自愿参加本项研究者. 排除标准包括: 合并心血管、肝、肾、消化、造血系统等严重原发性疾病者; 伴有严重痛经症状的女性患者; 伴有头痛、偏头痛及头部外伤史者; 孕妇及哺乳期妇女. PET-CT扫描仪采用西门子公司生产Biograph DUO BGO型扫描仪; 示踪剂为氟18脱氧葡萄糖(fluorine-18 fluorodeoxyglucose, 18F-FDG), 由MINItrace回旋加速器生产, 化学纯>95%, 放化纯>95%, pH 6.0, 无色透明, 无菌无热源; 针灸针采用苏州医疗用品有限公司生产的华佗牌一次性针灸针: 电针仪采用南京济生医疗科技有限公司生产的LH200韩氏穴位神经刺激仪(HANS).
1.2.1 针刺治疗及疗效评价: 患者每天接受1次电针治疗, 5次为1疗程, 疗程之间间隔2 d, 连续治疗4个疗程, 共20次. 穴位包括足少阳胆经原穴丘墟、络穴光明、合穴(下合穴)阳陵泉和郄穴外丘. 上述穴位针刺得气后, 连接电针仪, 取疏密波, 频率2 Hz/100Hz, 电流强度在0.1-1.0 mA, 以患者耐受为度, 定时为30 min. 针刺治疗前后采用尼平消化不良指数(nepean dyspepsia index, NDI)症状评分和NDI生活质量评分评价针刺疗效, 以焦虑自评量表(self-rating anxiety scale, SAS)和抑郁自评量表(self-rating depression scale, SDS)评价患者情绪状态的变化.
1.2.2 PET-CT扫描: 患者于针刺治疗前和针刺治疗后分别进行PET-CT扫描. 扫描流程为: 患者禁食6 h以上、封闭视听平静休息40 min后进入扫描室. 继续封闭视听平卧于检查床, 头放于头托内, 保持舒适位置, 切无偏转, 眶耳线(orbito meatal line, OML)与地面垂直. 先同机进行CT扫描, 再同机进行PET扫描. CT扫描参数: 电压: 120 kV; 电流: 200 mAs; 矩阵: 128×128, 放大2倍; 层厚: 3 mm, 层间间距: 1.5 mm. PET扫描参数: 扫描模式: 3D扫描, 1个床位; 扫描时间: 8-10 min; 总计数: 3×108.
统计学处理 采用SPSS16.0统计软件对患者针刺前后临床数据进行分析. 采用统计参数图软件(statistical parametric mapping 5.0, SPM5)对PET-CT数据进行分析, 统计检验采用配对t检验, P值设置为0.005, 连续20个激活像素定义为激活区, 将FD患者针刺前后的PET图像进行对比后得到针刺后FD患者的脑葡萄糖代谢变化情况, 用Talairach坐标图和Mni-Space utility软件对所得代谢变化的脑区进行神经解剖定位.
针刺治疗后, FD患者NDI症状评分较治疗前显著降低, NDI生活质量评分则显著增高(P<0.05); 针刺治疗后, FD患者SAS评分和SDS评分均较治疗前显著降低(P<0.05, 表1).
| 评分项目 | 治疗前 | 治疗后 | 统计值 | P值 |
| NDI | ||||
| 症状 | 52.10±14.69 | 32.30±13.17 | 9.933 | 0.000 |
| 生活质量 | 75.45±17.52 | 88.57±11.59 | -3.315 | 0.009 |
| SAS | 40.88±9.47 | 33.73±6.89 | 2.842 | 0.019 |
| SDS | 40.38±9.07 | 33.25±5.14 | 3.022 | 0.014 |
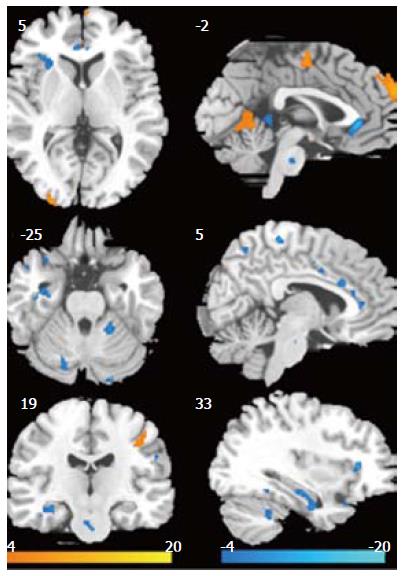
针刺治疗后, FD患者双侧小脑、前扣带回(anterior cingulate cortex ACC, BA24)、海马、海马旁回(BA37)、梭状回(BA37)、颞极(BA21、BA38)、楔前叶(BA7), 左侧脑岛(BA13)葡萄糖代谢显著降低(P<0.005, 表2, 图1).
| 脑区 | Talairach坐标 | t 值 | Brodmman Area分区 | ||
| X | Y | Z | |||
| 小脑 | |||||
| 左 | -18 | -30 | -15 | 6.11 | |
| 右 | 20 | -46 | -18 | 8.51 | |
| 前扣带回 | |||||
| 左 | -2 | 29 | -6 | 8.18 | BA24 |
| 右 | 2 | 33 | 0 | 10.5 | BA24 |
| 海马旁回 | |||||
| 左 | -33 | 35 | -4 | 8.21 | BA37 |
| 右 | 28 | -45 | -10 | 4.91 | BA37 |
| 梭状回 | |||||
| 左 | -40 | -15 | -23 | 5.58 | BA37 |
| 右 | 36 | -47 | -11 | 4.71 | BA37 |
| 脑岛 | |||||
| 左 | -32 | 23 | 3 | 5.49 | BA13 |
| 海马 | |||||
| 左 | -30 | -26 | -7 | 7.76 | |
| 右 | 30 | -37 | 2 | 7.15 | |
| 颞极 | |||||
| 左 | -48 | 8 | -29 | 6.94 | BA21 |
| 右 | 59 | 7 | -5 | 6.81 | BA38 |
| 楔前叶 | |||||
| 左 | -6 | -58 | 61 | 7.08 | BA7 |
| 右 | 7 | -59 | 53 | 5.13 | BA7 |
祖国医学虽无"功能性消化不良"这一病名, 但根据FD的临床症状及发病特点, 2001年中华中医药学会内科脾胃病专业委员会通过的《功能性消化不良中医诊治规范(草案)》确定FD对应的中医病名为"胃脘痛"和"痞满". 中医认为FD病位在胃, 涉及肝脾. 病因多与饮食不节或情志失调等有关, 治疗多从健脾、和胃、疏肝、理气着眼, 针灸取穴多依据辩证结果, 如脾胃失和者多取以足阳明胃经、足太阴脾经穴, 肝郁气滞者多取足少阳胆经穴为主等. 西医认为FD的发病主要与胃肠动力障碍、胃容受性损伤、内脏高敏感、幽门螺旋杆菌感染以及心理因素等有关[9]. 而近年来, 越来愈多的证据表明, 以边缘系统为主的中枢神经系统的功能异常在包括FD在内的功能性胃肠病(functional gastrointestinal diseases, FGID)的发病中扮演着重要的角色[10]. Vandenberghe等[5]利用H2O15-PET技术观察发现: 在相同的胃近端疼痛性球囊扩张下, FD患者与健康受试者相比, 出现了脑岛、额下回、小脑、丘脑以及颞下回的显著激活. 提示以边缘系统为主的中枢神经系对FD患者内脏疼痛信号的处理有别于健康人. Van Oudenhove等[6]也证实内脏高敏感FD患者中枢神经系统对胃胀刺激及假刺激的处理异于健康受试者. 在前期的研究中[8], 我们利用18F-FDG PET-CT技术, 对比观察FD患者与健康受试者静息态脑功能活动的差异, 结果显示: 与健康受试者相比, FD患者静息状态下脑葡萄糖代谢显著增高, 呈现出以边缘系统脑区为主的多个脑区的功能异常. 其中, FD患者双侧丘脑、ACC、中扣带回(middle cingulate cortex, MCC)、脑岛和小脑葡萄糖代谢的异常增高与患者病情的严重程度显著相关; 且与病情较轻FD患者相比, 病情较重FD患者双侧丘脑、ACC、MCC、脑岛和小脑的葡萄糖代谢显著增高. 因而认为丘脑、ACC、MCC、脑岛和小脑可能是与FD病情密切相关的核心脑区.
边缘系统对内脏活动有极为重要的调节作用, 素有"内脏脑"之称. 他除通过下行纤维影响内脏活动外, 还可以通过下丘脑-垂体的神经体液途径影响内脏活动, 在调节胃肠道感觉和运动功能中, 边缘系统发挥着重要的作用, 尤其以扣带回、脑岛、丘脑、下丘脑对消化系的影响最为显著[11,12]. 本研究中, 针刺足少阳胆经穴可以降低FD患者异常增高的脑葡萄糖代谢, 减低的区域包括双侧小脑、ACC、海马、海马旁回、梭状回、颞极、楔前叶和左侧脑岛. 上述区域大多属于边缘系统. 其中, 小脑、ACC和脑岛在我们前期研究中被认为是与FD病情密切相关的核心脑区. 脑岛是重要的"内感受皮层"(interoceptive cortex), 属于边缘系统的一部分. 他通过接收来自丘脑、孤束核、杏仁核和ACC的躯体和内脏传入纤维, 从而将内脏和情绪信息进行整合. 脑岛的传出纤维则主要到达杏仁核、下丘脑、前额叶(prefrontal cortex, PFC)、ACC以及脑干等区域. 这种解剖上的密切联系进一步证实了脑岛是内脏自主活动的高级整合中枢[13-15]. 事实上, 几乎所有关于FGID的影像学研究中都可以看到脑岛的激活[16]. 在本研究中, 针刺足少阳胆经穴可以显著降低FD患者脑岛异常增高的葡萄糖代谢, 这可能与针刺改善患者的消化不良症状有关.
扣带回是边缘系统的重要组成部分, 其中ACC与脑岛、PFC等边缘系统脑区和其他皮质下结构有着非常密切的联系, 被认为与疼痛、应激和FGID密切相关. 多项研究证实ACC是一个处理胃肠道信号的重要脑区[17], ACC的激活也几乎在所有FGID的神经影像学研究中都可以看到[16]. 同时, 神经电生理研究也证实ACC与胃肠调节关系密切. 如研究者发现, 刺激猴的ACC, 可以使幽门部运动及张力受到抑制, 切断迷走神经后抑制反应消失[18]. 此外, ACC在情绪调节中也具有重要的作用. 在本研究中, 针刺足少阳胆经穴可以显著降低FD患者ACC异常增高的葡萄糖代谢, 这可能与针刺改善患者消化不良症状和调节患者情绪异常有关.
小脑与大脑皮层和邻近的中脑区域有着极其复杂的传入、传出神经联系, 因而在调节内脏活动、高级认知功能和情绪行为等方面发挥着重要的作用. 电刺激小脑可影响内脏功能, 出现血压、排便及胃肠蠕动的变化[19]. IBS患者在直肠刺激下[20]、FD患者在疼痛性胃近端刺激时[5], 小脑半球都显著激活. 这些研究都提示小脑异常激活可能与FGID的病机有关. 在本研究中, 针刺足少阳胆经穴可以显著降低FD患者小脑异常增高的葡萄糖代谢, 这可能与针刺改善患者消化不良症状和改善患者自我内省意识有关.
总之, 针刺足少阳胆经穴可以有效改善肝郁型FD患者临床症状、提高患者生活质量, 改善患者情绪状态. 针刺足少阳胆经穴对肝郁型FD的治疗效应可能与改善FD患者边缘系统为主脑功能活动异常, 调节与病情相关的脑岛、ACC和小脑功能有关.
有研究证实, 针刺足少阳胆经穴能显著改善功能性消化不良(FD)患者症状, 以边缘系统为主的中枢神经系统功能异常可能是FD的重要病理特征. 因此, 本研究通过正电子发射计算机断层扫描(PET-CT)技术, 探讨针刺足少阳胆经穴对FD的治疗效应是否与调控边缘系统异常有关.
王富春, 教授, 长春中医药大学
针刺治疗FD疗效确切, 但其中枢作用机制尚不清楚. 目前运用多种神经影像学技术进行研究已成为针刺研究的热点之一.
已有的影像学研究证实, 针刺可能是通过抑制默认脑功能网络(包括边缘系统), 激活躯体感觉皮层来发挥调节作用. 然而, 不同疾病具有不同的中枢响应特征. 目前, 针刺影像学研究的疾病主要集中在疼痛、功能性疾病、情绪认知障碍等.
本文选取针刺治疗FD疗效确切的1组足少阳胆经穴, 而不是单纯针刺单一穴位, 研究设计更贴近临床, 结果更能充分体现针灸临床疗效的中枢机制.
本文从疗效有效的针刺选穴入手, 观察针刺足少阳胆经穴对FD患者脑葡萄糖代谢的影响, 探讨针刺足少阳胆经穴治疗FD的中枢机制, 可为针刺治疗FD的临床运用提供可视化的试验依据.
正电子发射计算机断层扫描(PET-CT): 目前应用较广泛的神经影像学技术之一, 主要是通过注射示踪显影剂观察特定部位的萄葡糖代谢, 进而反映其功能影像学的变化.
本文通过观察针刺对功能性消化不良患者脑功能的影响, 从一个侧面提示了针刺治疗FD的中枢机制, 实验设计比较完善, 采用的观察方法也比较先进, 学术价值较高.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Ghoshal UC, Singh R, Chang FY, Hou X, Wong BC, Kachintorn U. Epidemiology of uninvestigated and functional dyspepsia in Asia: facts and fiction. J Neurogastroenterol Motil. 2011;17:235-244. [PubMed] [DOI] |
| 2. | Brook RA, Kleinman NL, Choung RS, Melkonian AK, Smeeding JE, Talley NJ. Functional dyspepsia impacts absenteeism and direct and indirect costs. Clin Gastroenterol Hepatol. 2010;8:498-503. [PubMed] [DOI] |
| 3. | Chang JY, Locke GR, McNally MA, Halder SL, Schleck CD, Zinsmeister AR, Talley NJ. Impact of functional gastrointestinal disorders on survival in the community. Am J Gastroenterol. 2010;105:822-832. [PubMed] [DOI] |
| 4. | Ma TT, Yu SY, Li Y, Liang FR, Tian XP, Zheng H, Yan J, Sun GJ, Chang XR, Zhao L. Randomised clinical trial: an assessment of acupuncture on specific meridian or specific acupoint vs. sham acupuncture for treating functional dyspepsia. Aliment Pharmacol Ther. 2012;35:552-561. [PubMed] [DOI] |
| 5. | Vandenberghe J, Dupont P, Van Oudenhove L, Bormans G, Demyttenaere K, Fischler B, Geeraerts B, Janssens J, Tack J. Regional cerebral blood flow during gastric balloon distention in functional dyspepsia. Gastroenterology. 2007;132:1684-1693. [PubMed] [DOI] |
| 6. | Van Oudenhove L, Vandenberghe J, Dupont P, Geeraerts B, Vos R, Dirix S, Van Laere K, Bormans G, Vanderghinste D, Demyttenaere K. Regional brain activity in functional dyspepsia: a H(2)(15)O-PET study on the role of gastric sensitivity and abuse history. Gastroenterology. 2010;139:36-47. [PubMed] [DOI] |
| 7. | Van Oudenhove L, Vandenberghe J, Dupont P, Geeraerts B, Vos R, Dirix S, Bormans G, Vanderghinste D, Van Laere K, Demyttenaere K. Abnormal regional brain activity during rest and (anticipated) gastric distension in functional dyspepsia and the role of anxiety: a H(2)(15)O-PET study. Am J Gastroenterol. 2010;105:913-924. [PubMed] [DOI] |
| 8. | Zeng F, Qin W, Liang F, Liu J, Tang Y, Liu X, Yuan K, Yu S, Song W, Liu M. Abnormal resting brain activity in patients with functional dyspepsia is related to symptom severity. Gastroenterology. 2011;141:499-506. [PubMed] [DOI] |
| 9. | Brun R, Kuo B. Functional dyspepsia. Therap Adv Gastroenterol. 2010;3:145-164. [PubMed] [DOI] |
| 10. | Ringel Y. New directions in brain imaging research in functional gastrointestinal disorders. Dig Dis. 2006;24:278-285. [PubMed] [DOI] |
| 11. | Baklavadzhian OG, Nersesian LB, Avetisian EA, Avetisian IN, Arshakian AV, Bagdasarian KG, Eganova VS, Pogosian NL. [The neuronal organization of the limbic (cingulo-)-visceral reflex arc]. Usp Fiziol Nauk. 2000;31:11-23. [PubMed] |
| 12. | Suyama S, Takano E, Iwasaki Y, Nakata M, Yada T. [Roles and functional interplay of the gut, brain stem, hypothalamus and limbic system in regulation of feeding]. Nihon Rinsho. 2009;67:277-286. [PubMed] |
| 13. | Van Oudenhove L, Demyttenaere K, Tack J, Aziz Q. Central nervous system involvement in functional gastrointestinal disorders. Best Pract Res Clin Gastroenterol. 2004;18:663-680. [PubMed] [DOI] |
| 14. | Derbyshire SW. A systematic review of neuroimaging data during visceral stimulation. Am J Gastroenterol. 2003;98:12-20. [PubMed] [DOI] |
| 15. | Phillips ML, Gregory LJ, Cullen S, Coen S, Ng V, Andrew C, Giampietro V, Bullmore E, Zelaya F, Amaro E. The effect of negative emotional context on neural and behavioural responses to oesophageal stimulation. Brain. 2003;126:669-684. [PubMed] [DOI] |
| 16. | Mayer EA, Aziz Q, Coen S, Kern M, Labus JS, Lane R, Kuo B, Naliboff B, Tracey I. Brain imaging approaches to the study of functional GI disorders: a Rome working team report. Neurogastroenterol Motil. 2009;21:579-596. [PubMed] [DOI] |
| 17. | Aziz Q, Thompson DG, Ng VW, Hamdy S, Sarkar S, Brammer MJ, Bullmore ET, Hobson A, Tracey I, Gregory L. Cortical processing of human somatic and visceral sensation. J Neurosci. 2000;20:2657-2663. [PubMed] |
| 19. | Allen G, Buxton RB, Wong EC, Courchesne E. Attentional activation of the cerebellum independent of motor involvement. Science. 1997;275:1940-1943. [PubMed] [DOI] |
| 20. | Berman S, Munakata J, Naliboff BD, Chang L, Mandelkern M, Silverman D, Kovalik E, Mayer EA. Gender differences in regional brain response to visceral pressure in IBS patients. Eur J Pain. 2000;4:157-172. [PubMed] [DOI] |