修回日期: 2012-07-10
接受日期: 2012-07-20
在线出版日期: 2012-08-08
目的: 研究核转录因子κB(Nuclear factor kappa B, NF-κB)在鼠肝纤维化组织中的表达及其与α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、Ⅲ型胶原相关性.
方法: 32只♂清洁级SD大鼠随机分为正常对照组8只和模型组24只, 用CCl4皮下注射法制备肝纤维化模型组, 免疫组化和RT-PCR方法联合检测NF-κB、α-SMA、Ⅲ型胶原蛋白及基因在肝纤维化组织中的动态表达, 并对3者表达作相关性分析.
结果: 正常对照组肝组织中NF-κB、α-SMA及Ⅲ型胶原的蛋白及基因均有微量表达; CCl4注射后2、4和6 wk肝组织NF-κB、α-SMA及Ⅲ型胶原的蛋白及基因表达呈明显递增趋势(P<0.05), 2 wk后3者表达呈显著正相关(P<0.05).
结论: NF-κB表达随着肝纤维化程度的加重而增强, 在肝纤维化的发生和发展中起重要作用.
引文著录: 朱净, 范建荣, 潘亮, 黄华, 肖明兵, 江枫, 陆翠华. NF-κB在鼠肝纤维化组织中的表达及其与α-SMA、Ⅲ型胶原的相关性. 世界华人消化杂志 2012; 20(22): 2081-2085
Revised: July 10, 2012
Accepted: July 20, 2012
Published online: August 8, 2012
AIM: To investigate the correlation of expression of nuclear factor κB with that of α-smooth muscle actin (α-SMA) and collagen Ⅲ in hepatic fibrosis in rats.
METHODS: Thirty-two male SD rats of SPF grade were divided randomly into control group and model group. Hepatic fibrosis was induced in rats by injecting carbon tetrachloride. The mRNA and protein expression of NF-κB, α-SMA, and collagen Ⅲ was examined using reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemistry, respectively. The correlation of NF-κB expression with α-SMA and collagen Ⅲ expression was then analyzed.
RESULTS: NF-κB, α-SMA and collagen Ⅲ were lowly expressed in normal liver tissue. After injection of carbon tetrachloride, the expression of NF-κB, α-SMA and collagen Ⅲ mRNAs and proteins began to increase at week 2 and was significantly higher at weeks 4 and 6 (both P < 0.05), showing a gradually rising trend. There was a positive correlation between the expression of NF-κB and that of α-SMA and collagen Ⅲ (both P < 0.05).
CONCLUSION: NF-κB plays an important role in the pathogenesis of hepatic fibrosis.
- Citation: Zhu J, Fan JR, Pan L, Huang H, Xiao MB, Jiang F, Lu CH. Correlation of nuclear factor κB expression with α-SMA and collagen Ⅲ expression in hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(22): 2081-2085
- URL: https://www.wjgnet.com/1009-3079/full/v20/i22/2081.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i22.2081
肝纤维化是慢性肝损伤所共有的病理改变, 肝星状细胞(hepatic stellate cell, HSC)的活化在肝纤维化发生发展中起主导作用, 是肝纤维化产生与发展的中心环节[1]. 核转录因子κB(Nuclear factor kappa B, NF-κB)是1986年由Sen和Bltimore在成熟B淋巴细胞中发现的一种重要转录因子, 因其能够与B细胞免疫球蛋白的κ链基因的增强子B序列(GGGACTTTCC)特异结合而得名. NF-κB激活后可刺激多种因子的产生, 促进HSC的活化, 从而参与肝脏的急慢性炎症或纤维化过程[2,3]. 为了进一步研究NF-κB在肝纤维化组织中的动态表达及其与α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、Ⅲ型胶原表达的相关性, 我们用CCl4皮下注射法制备肝纤维化模型, RT-PCR、免疫组织化学联合检测NF-κB、α-SMA及Ⅲ型胶原在肝纤维化组织中的动态表达.
♂清洁级SD大鼠32只, 体质量150-250 g, 南通大学动物实验中心提供, 合格证号: 2022666, 在标准饲养条件下进行饲养; 兔抗大鼠NF-κB、α-SMA与Ⅲ型胶原多克隆抗体均购自武汉博士得生物工程公司; 两步法RT-PCR试剂盒为上海杰美生物工程有限公司产品.
1.2.1 分组及取材: 32只大鼠随机分成正常对照组(8只)和模型组(24只). 模型组按3 mL/kg给予600 mL/L CCl4溶液(橄榄油配制)皮下注射, 每周2次, 共6 wk制备肝纤维模型[4,5]. 正常对照组同法皮下注射橄榄油. 模型组分批(8只/次)于2、4和6 wk末处死, 处死时距最后一次CCl4注射时间为72 h, 正常对照组第6 wk末处死, 取肝组织, 部分置-80 ℃冰箱保存待作RT-PCR检测; 另一部分以10%甲醛固定, 用于组化及病理学观察. 4 wk末模型组大鼠死亡1只.
1.2.2 免疫组织化学检测: Envision二步法免疫组化检测NF-κB、α-SMA和Ⅲ型胶原蛋白的表达, 综合考虑染色强度和阳性细胞数. 染色强度分数标准: 0分(无着色); 1分(淡黄色); 2分(棕黄色); 3分(棕褐色). 同样物镜倍数下计数阳性细胞数: 一个视野内着色细胞0分(0%); 1分(1-25%); 2分(26-50%); 3分(51-75%); 4分(76-100%). 两项得分相加: 0-2分为阴性表达"-"; 3-4分为"+"; 5-6分为"++"; 7分为"+++"[6].
1.2.3 RT-PR检测: 以Primer5软件设计NF-κB、α-SMA、Ⅲ型胶原及内参GAPDH引物各一对, 其序列分别为: NF-κB: 5'GCCCTCGTGGACAGCACCAC3', 5'GGTTTCCGGGGTGCGGAAGG3'; α-SMA: 5'CATTCCTGCTCGTGGCGGGG3', 5'CGGGGCAGCCTTGTCCCTTG3'; Ⅲ型胶原: 5'CCACCCTGAACTCAAGAGC3', 5'TGAACTGAAAGCCACCATT3'; GAPDH: 5'AACGACCCCTTCATTGAC3', 5'TCCACGACATACTCAGCAC3'. 产物大小分别为564、339、212及191 bp, 由上海生工生物有限公司设计与合成. TRizol法提取肝组织总RNA, 逆转录cDNA后行PCR扩增. PCR产物经2%琼脂糖凝胶电泳, 观察扩增条带. 将产物条带的电泳图谱用摄像仪扫入电脑, 使用"凝胶分析软件"对条带进行分析, 读取积分吸光度值(IA值), 以NF-κB、α-SMA及Ⅲ型胶原IA值/GAPDH平均IA值表示NF-κB、α-SMA及Ⅲ型胶原的相对表达量.
统计学处理 所有数据由Stata7.0统计软件进行分析. 组化结果中各组间NF-κB、α-SMA与Ⅲ型胶原蛋白表达强度的比较采用秩和检验, 模型组3者表达强度间的相关分析采用Spearman等级相关分析; 半定量RT-PCR结果数据以mean±SD表示, 多组间的比较采用方差分析, 组间两两比较采用q检验, 模型组NF-κB、α-SMA与Ⅲ型胶原半定量RT-PCR结果间的相关分析采用Person相关分析. 以P<0.05表示差异有统计学意义.
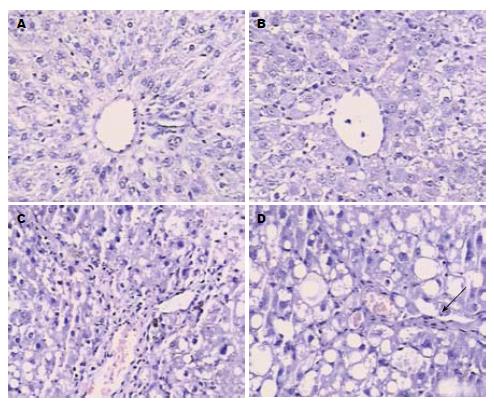
正常对照组SD大鼠肝脏无异常. 模型组2 wk, 小片肝细胞坏死、炎症细胞浸润和轻度纤维组织增生; 4 wk时肝小叶大片肝细胞坏死、明显脂肪变性并有较多纤维间隔形成; 6 wk时小叶结构紊乱、胶原纤维增生(图1D箭头所示)明显、有大量纤维间隔形成并且假小叶明显(图1).
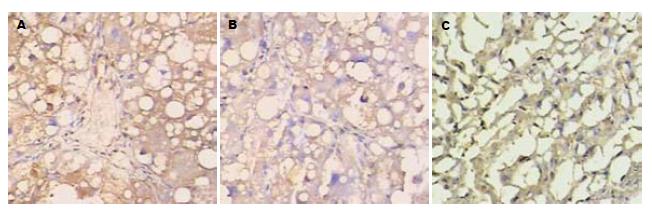
正常对照组肝组织NF-κB、α-SMA及Ⅲ型胶原微量表达. 造模2 wk后3者表达开始增强, NF-κB主要分布在肝细胞核内, α-SMA表达的部位主要于肝细胞的胞浆内, 而Ⅲ型胶原主要表达在汇管区和中央静脉管壁周围, 至6 wk 8例大鼠中3者均为强阳性表达(表1和图2). Spearman等级相关分析显示模型组NF-κB表达与α-SMA(r = 0.7950, P = 0.000)及Ⅲ型胶原(r = 0.7214, P = 0.000)表达呈明显正相关性.
在正常对照组和各肝纤维化模型组, 均扩增出564、339、212及191 bp的NF-κB、α-SMA、Ⅲ型胶原及内参GAPDH基因片段, 经灰度扫描后半定量分析结果显示, NF-κB、α-SMA及Ⅲ型胶原mRNA在模型组2、4和6 wk表达逐渐增强, 与正常对照组比较差异均具有统计学意义(P<0.05), 且模型各组间的两两比较差异亦均有统计学意义. Person相关分析显示模型组NF-κB半定量RT-PCR结果与α-SMA(r = 0.492, P = 0.000)及Ⅲ型胶原(r = 0.835, P = 0.000)结果有相关性, 亦呈明显正相关(表2).
肝纤维化的本质是肝内细胞外基质(extracellular matrix, ECM)的沉积增加和成分的改变, ECM不仅数量增多, 组成成分也发生改变, 低密度的基底膜变成间质性疤痕状膜, 且含有大量胶原纤维[7]. 其中Ⅲ型胶原可达到正常时的3-4倍. 该过程与大量细胞因子释放激活HSC, 使其转化为肌成纤维细胞密切相关, 而肌成纤维细胞作为一种特殊的成纤维细胞, 在其转化并导致纤维化形成过程中α-SMA表达常随着增强[8,9], 检测α-SMA常可作为其产生的标志[10]. 本研究结合以往研究[4,5], 采用经典的CCl4复制肝纤维化模型, 其在病理生理方面与人体肝纤维化的过程比较相似, 同时具有制模方便、时间短和成模率高的特点. 结果显示: 模型组SD大鼠2 wk时肝小叶小片肝细胞坏死, 炎症细胞浸润, 肝细胞浆疏松样变, 散在点灶状坏死, 轻度纤维组织增生, 少数见纤细的纤维间隔. 模型组SD大鼠第4周时肝小叶大片肝细胞坏死, 可见嗜酸性坏死及桥接坏死, 肝细胞呈明显的脂肪变性, 有较多纤维间隔形成, 胶原纤维由汇管区深入小叶内, 但没包裹. 模型组SD大鼠第6周时小叶结构紊乱, 胶原纤维增生明显, 有大量纤维间隔形成, 假小叶明显, 可见许多脂肪变性. 随着造模时间的延长, α-SMA及Ⅲ型胶原基因及蛋白表达亦逐渐增强, 至6 wk达最高峰. 造模过程中仅第4周出现1例大鼠死亡, 表明肝纤维化模型制备有效, 成功模拟了肝纤维化发生发展过程.
NF-κB是一种具有多向性调节作用的蛋白质因子, 在受到氧自由基、TNF-α、IL-1、LPS及紫外线等刺激下NF-κB可被激活, 能够调控包括细胞因子、趋化因子、生长因子和炎性介质等多种基因的表达, 引发炎症反应, 其中也包括了与肝纤维化密切相关的转化生长因子β1(transforming growth factor-β1, TGF-β1)的表达增强[2,3]. TGF-β1除能调节其他促纤维化因子表达增强外, 尚能直接活化胶原启动子, 并增加ECM蛋白如胶原和纤维结合素的信号等来促进肝纤维化的发生[11]. Friedman[12]研究显示NF-κB还是巨噬细胞潜在的调节因子, 巨噬细胞对HSC的作用具有两面性, 在纤维化进程中促进其活化, 在恢复期可使活化的星状细胞凋亡, NF-κB对肝细胞灵敏短暂的信号调节可引起凋亡和生长两种相反的作用. Farrell等[13]在研究非酒精性脂肪变性致肝纤维化过程中发现, NF-κB是关键性的促炎因子, 其表达的增强可促进多种炎症因子的活化. 表明NF-κB与肝纤维化的发生发展密切相关. 本研究中正常大鼠肝组织中NF-κB仅少量表达, CCl4注射2 wk后, NF-κB基因及蛋白水平随着CCl4注射时间的延长及肝纤维化程度的加重表达逐渐增加, 至6 wk时达到最高峰, 且在大鼠纤维化发展过程中NF-κB基因及蛋白表达水平与α-SMA及Ⅲ型胶原基因及蛋白表达水平均呈显著正相关, 进一步提示其在肝纤维化过程中的重要作用.
有研究表明, 白桦脂酸(betulinic acid, BA)可明显抑制Toll样受体4(Toll-like receptor 4, TLR4)、髓样分化因子88(myeloid differentiation factor 88, MyD88)及NF-κB活性, 通过调节TLR4/MyD88/NF-κB信号通路达到预防及治疗肝纤维化的作用[14]. β激酶抑制剂(IKK2 inhibitor, IMD)[15]、NF-κB的抑制剂如粉防己碱(Tetrandine)[16]均可降低肝纤维化的程度. 进一步证明NF-κB与肝纤维化发病机制密切相关, NF-κB可能成为肝纤维化新的治疗靶点.
肝纤维化是肝脏对慢性损伤的一种修复反应, NF-κB可通过调控TNF-α、IL-1等细胞因子的转录参与调控肝细胞的凋亡和增殖, 同时还促进肝星状细胞(HSC)的活化, 从而参与肝脏的急慢性炎症或纤维化过程, 使其与肝病的关系日益受到关注.
吴君, 主任医师, 贵阳医学院附属医院感染科
HSC增殖活化是肝纤维化发生发展的中心环节, 通过抑制HSC活化从而减少肝内细胞外基质(ECM)的合成与分泌是肝纤维化治疗研究的主要方向, 阻断NF-κB的活性及过度产生可能是肝纤维化治疗的一种很有希望的策略.
近来已证实, NF-κB可通过增强转化生长因子β1(TGF-β1)的表达、调节巨噬细胞功能及促进炎症发展等多途径参与肝纤维化的发生发展过程.
NF-κB基因及蛋白水平随着随着CCl4注射时间的延长及肝纤维化程度的加重表达逐渐增加, 且其表达水平与α-SMA及Ⅲ型胶原基因及蛋白表达水平均呈显著正相关, 提示在纤维化发生过程中, NF-κB的高表达可加速纤维化的进程.
NF-κB基因及蛋白水平的检测, 有助于判断纤维化进程; NF-κB为肝纤维化的治疗提供了新的靶点.
本文探讨了NF-κB在鼠肝纤维化组织中的表达及其与α-SMA和Ⅲ型胶原相关性, 实验结果客观, 有一定的学术价值.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Tacke F, Weiskirchen R. Update on hepatic stellate cells: pathogenic role in liver fibrosis and novel isolation techniques. Expert Rev Gastroenterol Hepatol. 2012;6:67-80. [PubMed] [DOI] |
| 2. | Li J, Hu W, Baldassare JJ, Bora PS, Chen S, Poulos JE, O'Neill R, Britton RS, Bacon BR. The ethanol metabolite, linolenic acid ethyl ester, stimulates mitogen-activated protein kinase and cyclin signaling in hepatic stellate cells. Life Sci. 2003;73:1083-1096. [PubMed] [DOI] |
| 3. | Yang H, Zhao LF, Zhao ZF, Wang Y, Zhao JJ, Zhang L. Heme oxygenase-1 prevents liver fibrosis in rats by regulating the expression of PPARγ and NF-κB. World J Gastroenterol. 2012;18:1680-1688. [PubMed] [DOI] |
| 4. | 陆 翠华, 陆 静贤, 华 国平, 朱 净, 王 华, 黄 介飞, 顾 美珍, 周 倩, 倪 润洲. 反义抑制结缔组织生长因子对实验性肝纤维化的影响. 中华肝脏病杂志. 2007;15:118-121. |
| 5. | 许 晶, 朱 净, 潘 亮, 陆 静贤, 肖 明兵, 黄 华, 倪 润洲, 陆 翠华. 瘦素在肝纤维化组织中的表达及其与肝星状细胞活化的关系. 世界华人消化杂志. 2009;17:2127-2130. [DOI] |
| 6. | Xie L, Ni WK, Chen XD, Xiao MB, Chen BY, He S, Lu CH, Li XY, Jiang F, Ni RZ. The expressions and clinical significances of tissue and serum galectin-3 in pancreatic carcinoma. J Cancer Res Clin Oncol. 2012;138:1035-1043. [PubMed] [DOI] |
| 7. | Manning DS, Afdhal NH. Diagnosis and quantitation of fibrosis. Gastroenterology. 2008;134:1670-1681. [PubMed] [DOI] |
| 8. | Tutau F, Rodríguez-Ortigosa C, Puche JE, Juanarena N, Monreal I, García Fernández M, Clavijo E, Castilla A, Castilla-Cortázar I. Enhanced actions of insulin-like growth factor-I and interferon-alpha co-administration in experimental cirrhosis. Liver Int. 2009;29:37-46. [PubMed] [DOI] |
| 9. | Hegazy SK, El-Bedewy M, Yagi A. Antifibrotic effect of aloe vera in viral infection-induced hepatic periportal fibrosis. World J Gastroenterol. 2012;18:2026-2034. [PubMed] [DOI] |
| 10. | Sousa AM, Liu T, Guevara O, Stevens J, Fanburg BL, Gaestel M, Toksoz D, Kayyali US. Smooth muscle alpha-actin expression and myofibroblast differentiation by TGFbeta are dependent upon MK2. J Cell Biochem. 2007;100:1581-1592. [PubMed] [DOI] |
| 11. | Tang M, Potter JJ, Mezey E. Activation of the human alpha1(I) collagen promoter by leptin is not mediated by transforming growth factor beta responsive elements. Biochem Biophys Res Commun. 2003;312:629-633. [PubMed] [DOI] |
| 12. | Friedman SL. Mac the knife? Macrophages- the double-edged sword of hepatic fibrosis. J Clin Invest. 2005;115:29-32. [PubMed] |
| 13. | Farrell GC, van Rooyen D, Gan L, Chitturi S. NASH is an Inflammatory Disorder: Pathogenic, Prognostic and Therapeutic Implications. Gut Liver. 2012;6:149-171. [PubMed] [DOI] |
| 14. | Wan Y, Wu YL, Lian LH, Xie WX, Li X, Ouyang BQ, Bai T, Li Q, Yang N, Nan JX. The anti-fibrotic effect of betulinic acid is mediated through the inhibition of NF-κB nuclear protein translocation. Chem Biol Interact. 2012;195:215-223. [PubMed] [DOI] |
| 15. | Wei J, Shi M, Wu WQ, Xu H, Wang T, Wang N, Ma JL, Wang YG. IκB kinase-beta inhibitor attenuates hepatic fibrosis in mice. World J Gastroenterol. 2011;17:5203-5213. [PubMed] [DOI] |
| 16. | Hsu YC, Chiu YT, Cheng CC, Wu CF, Lin YL, Huang YT. Antifibrotic effects of tetrandrine on hepatic stellate cells and rats with liver fibrosis. J Gastroenterol Hepatol. 2007;22:99-111. [PubMed] [DOI] |