修回日期: 2012-07-04
接受日期: 2012-07-20
在线出版日期: 2012-08-08
目的: 研究高温43 ℃对多药耐药基因表达产物P-gp、MRP、LRP在蛋白水平上的影响及其生物学意义, 更深入地了解热效应逆转耐药的机制.
方法: 采用免疫细胞化学染色法、RT-PCR以及Western blot方法, 检测在不同温度和不同药物作用下, 人胃癌耐药细胞株SGC7901/ADM和对照的人胃癌敏感细胞SGC7901株中, 与人胃癌多药耐药相关的分子MDR1、P-gp、MRP、LRP在蛋白水平上的表达差异.
结果: 采用免疫细胞化学染色法检测人胃癌耐药株SGC7901/ADM细胞, 发现高温43 ℃ 60 min处理可使P-gp蛋白表达下调率(down-regulated rate, DRR)31.78%(P = 0.016), 而MRP表达DRR为20.22%(P = 0.037), 差异有统计学意义, LRP未表达. 采用Western blot法在SGC7901细胞中未检测出P-gp蛋白表达, 而SGC7901/ADM细胞中P-gp高表达; 在ADM和CDDP处理组细胞中, 高温43 ℃时P-gp的表达量较37 ℃时DRR分别为45.65%(P = 0.007)、17.95%(P = 0.021), 差异有显著学意义; TAX处理组DRR为11.90%, 差异无显著学意义(P = 0.065).
结论: 高温43 ℃的短期处理对人胃癌SGC7901/ADM细胞中P-gp和MRP多药耐药蛋白的表达有一定的抑制作用, 可能是逆转耐药的机制之一.
引文著录: 彭楠, 焦伟国, 黎春华, 陈蔚, 王秋华, 李晓瑛. 高温对SGC7901/ADM细胞多药耐药蛋白表达的影响和意义. 世界华人消化杂志 2012; 20(22): 2075-2080
Revised: July 4, 2012
Accepted: July 20, 2012
Published online: August 8, 2012
AIM: To observe the effect of hyperthermia at 43 ℃ on the expression of multidrug resistance-related markers, MDR1, MRP, and LRP in adriamycin (ADM)-resistant human gastric cancer cell line SGC-7901/ADM, and to determine the possible mechanisms underlying the reversal effect of hyperthermia on multidrug resistance.
METHODS: The expression of multidrug resistance molecules MDR1, P-gp, MRP, and LRP in SGC7901/ADM cells treated by hyperthermia at 43°C was assayed by immunocytochemistry, Western blot, and RT-PCR.
RESULTS: The expression of P-gp and MRP was reduced by 31.78% (P = 0.016) and 20.22% (P = 0.037), respectively, in SGC7901/ADM cells exposed to high temperature at 43 ℃ for 60 min, but LRP expression cannot be measured by immunocytochemistry. P-gp expression could not be detected in ADM-sensitive human gastric cancer cell line SGC7901 by Western blot; however, high expression of P-gp was detected in SGC7901/ADM cells. The expression of P-gp could be decreased by high temperature at 43 ℃ in all drug groups, and the expression of P-gp was reduced by 5.65% (P = 0.007), 17.95% (P = 0.021), 11.90% (P = 0.065) in ADM, CDDP and TAX groups, respectively.
CONCLUSION: High temperature at 43 ℃ could partially inhibit the expression of multidrug resistance-related molecules P-gp and MRP in ADM-resistant human gastric cancer cell line SGC7901/ADM.
- Citation: Peng N, Jiao WG, Li CH, Chen W, Wang QH, Li XY. Effect of hyperthermia on the expression of multidrug resistance markers in adriamycin-resistant human gastric cancer cell line SGC-7901/ADM. Shijie Huaren Xiaohua Zazhi 2012; 20(22): 2075-2080
- URL: https://www.wjgnet.com/1009-3079/full/v20/i22/2075.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i22.2075
肿瘤热疗是继手术、化疗、放疗、免疫治疗后的又一种肿瘤治疗手段, 基础研究和临床治疗中发现, 热疗与放疗或/和化疗有协同抗肿瘤的作用[1,2], 即使对一些晚期肿瘤, 放化疗无效时, 联合热疗辅助治疗, 也能取得较好的疗效[3,4]. 因此, 我们设想高温可能具有逆转肿瘤多药耐药性的机制. 在我们前期的体外实验研究已经发现, 高温43 ℃可降低人胃癌耐药细胞株SGC7901/ADM的生存率, 不同程度逆转SGC7901/ADM耐药细胞对5-FU、ADM、CDDP、TAX的耐药性[5]. 为此我们进一步探究高温43 ℃对多药耐药基因表达产物P-gp、MRP、LRP在蛋白水平上的影响及其生物学意义, 从而对高温可以部分逆转胃癌SGC-7901/ADM细胞耐药机制有更深入的了解. 本实验采用的手段为免疫细胞化学染色法、RT-PCR以及Western blot方法, 检测在不同温度和不同药物作用下, 人胃癌耐药细胞株SGC7901/ADM和对照的人胃癌敏感细胞SGC7901株中, 可能与人胃癌多药耐药相关的分子MDR1、P-gp、MRP、LRP在蛋白水平上的表达.
RPMI 1640(GIBCO公司产品); 新生牛血清(杭州四季青公司); 胰蛋白酶(美国Sigma公司); HEPES(美国Sigma公司); 紫杉醇(TAX)购自美国百时美施贵宝公司; 5-氟尿嘧啶(5-FU)购自上海旭东海普药业; 顺铂(DDP)购自齐鲁制药公司; 阿霉素(ADM)购自齐鲁制药公司. 以上药物配成×100保存液, -20 ℃分装保存. P-gp抗体、MRP抗体、LRP抗体购自美国signet公司; 各型二抗均购自北京中山公司, 使用稀释度1:5 000(细胞组织化学法用)或1:10 000(Western blot法用). RNA提取试剂盒购自鼎国生物有限公司; 组织化学试剂盒购自中山公司, 该试剂盒提供封闭血清、二抗、显色底物溶液(AEC显色)及封片剂. 以下试剂自备: 固定剂(10%中性福尔马林用10 mmol/L PBS配置)、过氧化物酶灭活液(30%过氧化氢:甲醇 = 1:9)、PBST(10 mmol/L PBS pH 7.4+0.05% Tween-20)、坚固红复染液、BCIP/NBT显色液、免疫组织化学用PAP笔、封片剂及各型一抗. BCA蛋白质定量试剂盒, 包含BSA标准品、Cu2+盐溶液及BCA溶液; 4×蛋白质电泳上样缓冲液(100 mmol/L Tris-HCl pH 6.8), 200 mmol/L二硫苏糖醇, 4%SDS, 0.2%溴酚蓝, 20%的甘油. 低分子量蛋白质标准Pharmacia biotec公司产品.
SW-CJ-IF超净工作台(苏州净化设备厂); IMT2-21型倒置显微镜、BH-2型双目显微镜(日本OLYMPUS); BNA-311型培养箱(日本Tabai Espec产品); 电热恒温水浴箱(上海医疗仪器厂); 台式离心机(德国Beckman公司); 流式细胞仪(美国BD公司); HPLAS-100彩色图像分析系统(美国惠普公司); BIO-RAD转移槽、BIO-RAD PCR仪和BIO-RAD电泳槽均为美国伯乐公司; Sanyo Ultra low低温冰箱(日本三洋公司); Thermo液氮罐(美国Thermo公司).
1.2.1 细胞株和实验分组: 人胃癌细胞株SGC7901/S(亲代)及耐阿霉素细胞株SGC7901/ADM均由中国人民解放军第四军医学消化病研究所樊代明院士惠赠. 细胞长期培养于RPMI 1640加新生牛血清的培养液中. 对照组: 37 ℃组、阿霉素(ADR)组、顺铂组(CDDP)、5-氟尿嘧啶(5-FU)组、紫杉醇(Tax)组. 实验组: 43 ℃ 60 min+ADR组、CDDP组、5-FU组、Tax组. 抗肿瘤药物在人体的血浆高峰浓度: ADR 0.4 mg/L, Tax 6 mg/L, CDDP 3.0 mg/L, 5-FU 10 mg/L.
1.2.2 RT-PCR检测: 按照RNA提取试剂盒提取总RNA, 经琼脂糖凝胶电泳鉴定其完整性, 通过紫外分光光度计测定260 nm与280 nm处吸光度(A)值, 计算纯度和浓度. 使用PCR仪器扩增, 引物序列为β-actin: 622 bp, 上游引物: 5'-caccatggatgatgatatcgccgc-3', 下游引物: 5'-gctcggccgtggtggtgaag-3'; MDR: 520 bp, 上游引物: 5'-cgctattcaa attggcttga caag-3',下游引物: 5'-cacgtgtaaa tcctcgtata aac-3'; MRP: 276 bp, 上游引物: 5'-gggaattctggactggaatgtcacg-3', 下游引物: 5'-cgggatccaggaatatgccccgacttc-3'; LRP: 342 bp, 上游引物: 5'-gagcagttcacagtgttgtcc-3', 下游引物: 5'-aaagccaaagacagcagtgcg-3'. 取RT-PCR产物5 μL, 在1.5%琼脂糖凝胶上电泳, 溴化已锭显色, 分别取目的基因与内参基因β-actin RT-PCR产物电泳条带灰度比值, 作为目的基因mRNA相对含量.
1.2.3 免疫细胞化学染色: 每张片加50 μL正常动物非免疫血清, 室温下孵育10 min; PBS(pH 7.4)冲洗5 min, 加50 μL一抗孵育60 min; PBS冲洗3次, 每次5 min, 加1滴或50 μL生物素标记的二抗, 室温下孵育10 min; PBS同法冲洗, 加1滴或50 μL链霉菌抗生物素蛋白-AP, 室温下孵育10 min; PBS同法冲洗, 加50 μL BCIP/NBT显色液(试剂4), 观察5-15 min, 阳性显色为蓝黑色; BCIP/NBT染色后, 自来水冲洗, 坚固红复染液复染; 复染后, 蒸馏水冲洗, 脱水, 中性树胶封片. 结果采用HPLAS-100彩色图像分析系统进行分析, 表达强度用平均光度. 下调率(down-regulated rate, DRR)的计算依据公式: DRR(%) = (光强度43 ℃-光强度37 ℃)/光强度37 ℃×100%.
1.2.4 Western blot法: 实验选择温度为37 ℃、 43 ℃ 60 min; 选择药物为阿霉素组、顺铂组、紫杉醇组. 取对数生长期细胞, 细胞数以5×106为宜, 加入样品裂解液, 混匀, -80 ℃冰箱放置30 min. 12 000 r/min, 4 ℃离心30 min, 取上清液即为细胞总蛋白. 以每样品25 µg蛋白在6%聚丙烯酰胺凝胶电泳90 min, 取下凝胶, 电转膜至PVDF膜BIO-RAD转移槽, 转移膜放置于5%脱脂奶粉, 室温封闭PVDF膜1 h; 加入 20 μL一抗(1:100)孵育过夜; 洗膜, 加入二抗<HRP山羊抗兔>(1:5 000)室温2 h; 充分洗膜3次, ECL显示试剂盒显色, 对显色条带进行A值分析, 以目的基因与内参基因β-actin的A比值作为蛋白的相对表达量. 实验重复3次.
统计学处理 应用SPSS13.0软件进行统计学处理, 计量资料两组比较采用t检验.
本实验采用BCIP/NBT染色法, 蛋白阳性颜色呈蓝紫色, 复染采用坚固红颜色呈红色. 免疫细胞化学染色法检测P-gp、MRP、LRP蛋白表达(图1). 不同温度条件下, 采用抗P-gp、MRP、LRP抗体处理, 在胃癌敏感细胞株SGC-7901中, 显微镜下仅观察到非常少量的蓝紫色细胞, 而在胃癌耐药细胞株SGC-7901/ADM中, 采用抗P-gp抗体作用后, 镜下计数所有的细胞膜处都不同程度呈蓝紫色, 而且高温43 ℃对于P-gp阳性细胞率基本无影响. 但采用图像分析系统测定发光强度后发现, 高温43 ℃ 60 min处理可使P-gp蛋白表达下调31.78%, 较37 ℃组相比, P-gp表达水平的下调差异有统计学意义(P = 0.016); 采用抗MRP抗体作用后, 镜下计数发现63%的细胞都呈蓝紫色, 高温43 ℃对于MRP阳性细胞率无明显影响, 但图像分析系统检测P-gp蛋白表达水平较37 ℃时下调20.22%, 差异有显著性意义(P = 0.037). 采用抗LRP抗体检测仅观察到极少量的蓝紫色阳性细胞, 图像分析系统检测LRP蛋白表达微弱(表1).
43 ℃处理后, MDR1 mRNA表达水平下降, DRR为12.19%, 与37 ℃组相比差异有显著性意义(P = 0.031); 而经43 ℃处理后MRP mRNA表达水平亦下降, 但DRR仅为7.89%, 与37 ℃组相比差异有统计学意义(P = 0.045, 表2).
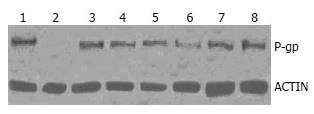
P-gp是分子量为170 kDa的一个糖蛋白, 细胞经过不同药物和温度处理后裂解并进行SDS-PAGE电泳后, 利用抗P-gp的抗体检测P-gp蛋白的表达水平, 选用β-actin作为等量上样的对照(图2). 结果显示, 在37 ℃没有任何化疗药物处理组, SGC7901细胞中检测不到P-gp蛋白的表达, 而SGC7901/ADM细胞中P-gp蛋白可以高水平的表达. 其中ADM药物添加组, 在43 ℃条件下, P-gp蛋白的表达水平较37 ℃ P-gp蛋白的表达水平下调45.65%, 差异有统计学意义(P = 0.007); 而经43 ℃作用后, CDDP组和TAX组P-gp蛋白的表达水平较37 ℃时分别下调17.95%(P = 0.021)、11.90%(P = 0.065, 表3).
肿瘤多药耐药的产生不是单一因素, 而是多种机制共同作用的结果. 出现耐药与多种耐药基因的过度表达, 使其编码的相关蛋白表达上调, 比较肯定的有P-gp、MRP、LRP蛋白等[6,7]. 对多药耐药机制的研究, 检测耐药基因和蛋白的表达, 选择性药物或降低耐药基因的表达, 均有助于增加化疗药物的敏感性, 对提高临床治疗效果具有重要的意义[8-11].
P-gp被认为是肿瘤产生多药耐药的经典途径, P-gp本身可形成单一药物通道, 并具有药泵功能, 能结合进人细胞内的药物分子, 通过能量依赖的方式将药物转移到细胞外, 也能直接从细胞膜排除药物, 由此P-gp和MDR是导致肿瘤细胞对天然来源的抗癌药物如长春碱类、鬼臼类、紫杉醇类和蒽环类药物的主要机制[12]. 临床上也发现MDR-1基因高表达与多烯紫三醇疗效差相关[13,14]. 本实验用免疫细胞化学染色法检测P-gp、MRP、LRP在人胃癌敏感株SGC7901和人胃癌耐药株SGC7901/ADM细胞中的表达, 结果发现在人胃癌敏感株SGC7901中未检出P-gp、MRP、LRP, 在人胃癌耐药株SGC7901/ADM细胞中P-gp高表达阳性率为100%, 显微镜下可见蓝紫色环绕在胃癌耐药株SGC7901/ADM细胞周围, 也证明P-gp为一种跨膜蛋白. 高温43 ℃ 60 min处理可使P-gp蛋白表达DRR 31.78%(P<0.01), MRP表达DRR为20.22%(P<0.05). 而用RT-PCR法检测发现43 ℃使MDR和MRP mRNA表达的DRR分别为12.19%、7.89%. 由此可见, 43 ℃热效应对蛋白表达降低明显, 目前还不清楚原因. 采用Western blot法在SGC7901细胞中未检测出P-gp蛋白表达, 而SGC7901/ADM细胞中P-gp高表达; 在ADM、CDDP处理组细胞中, 43 ℃时P-gp的表达量较37 ℃时DRR分别为45.65%(P<0.01)、17.95%(P<0.05), 差异有显著性意义; 而TAX处理组DRR为11.90%, 差异无显著性意义(P>0.05).
多药耐药相关蛋白(multidrug resistance associated protein, MRP)的表达增加也是多药耐药重要机制之一. MRPs主要在上皮细胞的基侧膜上表达, 是ATP能量依赖性跨膜蛋白, 具有选择性和特异性的药物外排泵. 在多种正常组织中表现为低水平表达, 但在一些肿瘤组织呈高水平表达. MRPs在肿瘤组织中的高度表达与肿瘤恶化、化疗疗效及患者的整体生存率密切相关, 如发现在胃癌中69%[15-17].
LRP为人的弯隆体主蛋白(major vault protein, MVP), 通过调节囊泡和核质的药物转运. LRP主要是使以细胞核为靶点的药物不能通过核膜孔进入细胞核, 同时也可以使细胞质中的药物进入囊泡, 最终通过胞吐机制排到细胞外. 肿瘤细胞中LRP表达增高的意义在于他能够导致一些对CDDP、CBP、烷化剂等P-gp和MRP不能介导的药物产生耐受, 使肿瘤细胞的耐药谱更为广泛.
本实验结果显示胃癌耐药细胞株SGC7901/ADM中MRP高表达, 高温43 ℃可下调MRP表达20.22%(P<0.05). 在人胃癌耐药株SGC7901/ADM细胞中LRP未表达, 这与RT-PCR法检测LRP mRNA的结果一致. 但研究认为在胃癌的多药耐药中, MRP较MDR1占有更为重要的作用[18]. 有学者对47份胃癌标本进行分析, 发现MDR1基因的定量表达与组织学类型、浸润深度、淋巴结转移与否均无明显相关性. MRP基因在早期胃癌中显著高于进展期胃癌(P<0.05), 高、中分化腺癌显著高于低、未分化腺癌(P<0.05); 而LRP基因在无淋巴结转移组胃癌组中显著高于淋巴结转移组(P<0.05). 此结果显示MRP基因表达量与胃癌的发生发展以及预后状况具有相关性, 而MDR1则无差异, LRP在淋巴转移胃癌组中表达明显上调[19].
依据耐药基因的检测结果针对不同患者实施科学的、药物适配的个体化化疗方案对胃癌治疗具有重要的指导意义. 此外, 研究多药耐药逆转剂也是当前的研究热点, 已经发现多种逆转剂和新的逆转通道, 如非甾体类抗炎药物、环孢素类、维拉帕米、中药等[20-22], 都有一定的不良反应, 限制了其临床应用. 而高温43 ℃短时间处理可降低P-gp和MRP的表达, 不良反应少, 可作为逆转多药耐药的手段, 这可能也是热化疗协同抗癌作用的机制之一.
总之, 高温43 ℃的短期处理对人胃癌SGC7901/ADM细胞中P-gp和MRP多药耐药蛋白的表达有一定的抑制作用, 可能是逆转耐药的机制之一. 高温可能在临床上作为逆转多药耐药的手段.
感谢中国人民解放军军事医学科学院钟晖研究员和中国人民解放军总医院康复医学中心索伟副主任!
临床发现热疗与放化疗有协同抗肿瘤作用, 尤其对一些中晚期放化疗耐受的患者也有效. 近年研究热疗对化疗的增敏作用成为热点.
朴云峰, 教授, 吉林大学第一临床医院消化科
目前研究已证明有效的多药耐药逆转剂, 多数因毒不良反应大而限制了其在临床中的应用.
研究表明, 高温43 ℃可降低人胃癌耐药细胞株SGC7901/ADM的生存率, 不同程度逆转SGC7901/ADM耐药细胞对5-FU、ADM、CDDP、TAX的耐药性.
本文通过研究高温对多药耐药蛋白表达的影响, 进而为热效应逆转肿瘤耐药机制提供新思路.
本文有前期工作基础, 实验设计合理, 结果可靠, 具有一定的学术价值.
编辑: 张姗姗 电编:闫晋利
| 1. | 林 世寅, 李 瑞英, 毛 慧生, 万 柏坤. 现代肿瘤热疗学-原理、方法与临床. 第1版. 北京: 学苑出版社 1997; 4, 32. |
| 7. | Scheffer GL, Schroeijers AB, Izquierdo MA, Wiemer EA, Scheper RJ. Lung resistance-related protein/major vault protein and vaults in multidrug-resistant cancer. Curr Opin Oncol. 2000;12:550-556. [PubMed] [DOI] |
| 8. | Yan F, Wang XM, Liu ZC, Pan C, Yuan SB, Ma QM. JNK1, JNK2, and JNK3 are involved in P-glycoprotein-mediated multidrug resistance of hepatocellular carcinoma cells. Hepatobiliary Pancreat Dis Int. 2010;9:287-295. [PubMed] |
| 9. | Kawasaki K, Watanabe M, Sakaguchi M, Ogasawara Y, Ochiai K, Nasu Y, Doihara H, Kashiwakura Y, Huh NH, Kumon H. REIC/Dkk-3 overexpression downregulates P-glycoprotein in multidrug-resistant MCF7/ADR cells and induces apoptosis in breast cancer. Cancer Gene Ther. 2009;16:65-72. [PubMed] [DOI] |
| 10. | Ferguson LA, Rhoads J. Multidrug-resistant and extensively drug-resistant tuberculosis: The new face of an old disease. J Am Acad Nurse Pract. 2009;21:603-609. [PubMed] [DOI] |
| 11. | 魏 学明, 顾 国利, 任 力, 熊 梅, 王 石林, 李 德昌, 宁 守斌, 熊 梅. 胃癌组织中多药耐药基因的表达特点及其对化疗的指导意义. 胃肠病学和肝病学杂志. 2009;18:988-992. |
| 12. | Gottesman MM. Mechanisms of cancer drug resistance. Annu Rev Med. 2002;53:615-627. [PubMed] [DOI] |
| 13. | Kamazawa S, Kigawa J, Kanamori Y, Itamochi H, Sato S, Iba T, Terakawa N. Multidrug resistance gene-1 is a useful predictor of Paclitaxel-based chemotherapy for patients with ovarian cancer. Gynecol Oncol. 2002;86:171-176. [PubMed] [DOI] |
| 14. | Penson RT, Oliva E, Skates SJ, Glyptis T, Fuller AF, Goodman A, Seiden MV. Expression of multidrug resistance-1 protein inversely correlates with paclitaxel response and survival in ovarian cancer patients: a study in serial samples. Gynecol Oncol. 2004;93:98-106. [PubMed] [DOI] |
| 15. | Triller N, Korosec P, Kern I, Kosnik M, Debeljak A. Multidrug resistance in small cell lung cancer: expression of P-glycoprotein, multidrug resistance protein 1 and lung resistance protein in chemo-naive patients and in relapsed disease. Lung Cancer. 2006;54:235-240. [PubMed] [DOI] |
| 16. | Ge J, Chen Z, Wu S, Chen J, Li X, Li J, Yin J, Chen Z. Expression levels of insulin-like growth factor-1 and multidrug resistance-associated protein-1 indicate poor prognosis in patients with gastric cancer. Digestion. 2009;80:148-158. [PubMed] [DOI] |
| 17. | Huang WT, Huang CC, Weng SW, Eng HL. Expression of the multidrug resistance protein MRP and the lung-resistance protein LRP in nasal NK/T cell lymphoma: further exploring the role of P53 and WT1 gene. Pathology. 2009;41:127-132. [PubMed] [DOI] |