修回日期: 2012-06-14
接受日期: 2012-06-30
在线出版日期: 2012-07-28
许多研究表明, 肝脏铁过载与肝炎、肝纤维化、肝硬化及肿瘤具有密切关系. 目前检测铁过载的方法, 如血浆铁蛋白检测、肝脏穿刺活检以及无创检查超导量子干涉仪等均具有一定的局限性, 磁共振检查技术(magnetic resonance imaging, MRI)是目前公认的, 能够无创、安全、准确的检查肝脏铁含量的方法. 本文对肝脏铁过载及MRI在肝脏铁过载中的应用进展进行综述.
引文著录: 宋晓丽, 赵俊功, 程英升. MRI评价肝脏铁过载的应用进展. 世界华人消化杂志 2012; 20(21): 1933-1938
Revised: June 14, 2012
Accepted: June 30, 2012
Published online: July 28, 2012
Many studies show that hepatic iron overload has a close association with hepatitis, hepatic fibrosis, cirrhosis, and hepatic tumors. Methods currently used for detection of hepatic iron overload, such as plasma ferritin detection, liver biopsy, and superconducting quantum interface device, have some limitations. Improvement in software and hardware has enabled MRI to become a safe, noninvasive and accurate method for detecting hepatic iron overload. This article aims to summarize the performance and application of MRI in the evaluation of hepatic iron overload.
- Citation: Song XL, Zhao JG, Cheng YS. MRI evaluation of hepatic iron overload: Recent advances. Shijie Huaren Xiaohua Zazhi 2012; 20(21): 1933-1938
- URL: https://www.wjgnet.com/1009-3079/full/v20/i21/1933.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i21.1933
肝脏铁过载与肝炎、肝纤维化、肝硬化及肿瘤具有密切关系[1-4]. 目前检测肝铁过载的主要方法有血浆铁蛋白、肝穿刺活检技术以及超导量子干涉仪(superconducting quantum interface device, SQUIDs)[5]等. 血浆铁蛋白检测不能精确反映肝脏铁含量, 尤其是严重超载患者[6]. 肝穿刺活检虽是金标准, 但是作为一种有创检查, 会产生一定并发症. 而SQUIDs设备特殊, 不能广泛应用于临床[7], 故三者在铁过载检测中的价值非常有限. 利用肝脏内铁与磁敏感性弛豫呈线性关系, 对肝脏铁进行检测并量化的磁共振(magnetic resonance imaging, MRI)弛豫技术是一项无创、简便、安全、准确的检测肝铁过载的技术, 在临床应用中显示出巨大的潜力. 这篇综述将总结肝脏铁过载以及MRI在肝脏铁过载的应用进展.
铁作为人体必需的微量元素, 广泛参与机体生命代谢活动, 如氧运输、电子传递、DNA及蛋白质的合成等. 人体每天需要吸收1-2 mg外源性铁. 人体铁代谢包括5个阶段: 吸收、转运、利用、储存和排泄[8]. 近端小肠是铁吸收的主要部位, 肝脏和网状内皮系统是铁储存的主要部位, 而铁的主要利用部位是骨髓. 外源性铁分为非血红素铁和血红素铁, 小肠吸收两者的机制不同, 非血红素铁中的Fe3+被十二指肠细胞色素b还原成Fe2+[9], 然后在二价金属离子转移蛋白(divalent metal transport 1, DMT1)介导下进入肠黏膜细胞. 而血红素铁是在血红素载体蛋白1的介导下进入黏膜细胞, 在血红素氧化酶的作用下, 游离的Fe2+释放入非血红素铁池内. 铁进入小肠黏膜细胞后, 一部分以铁蛋白的形式储存在黏膜细胞内, 另一部分被膜铁转运辅助蛋白氧化为Fe3+, 然后通过膜铁转运蛋白(ferroportin 1, FPN1)转移到血浆中[10]. FPN1广泛分布于机体多个组织, 尤其是在十二指肠细胞、肝细胞单核巨噬细胞及胎盘的合体滋养层细胞等铁转运部位大量表达.
转铁蛋白结合铁是血液中铁的主要转运形式. 铁进入血液后绝大部分与血浆中的转铁蛋白结合, 经转铁蛋白-转铁蛋白受体(transferring receptor, TFR)系统转运首先通过门脉系统到达肝, 继而转运到骨髓及其他需铁组织. 血浆中的绝大部分铁经过内吞、酸化、释放和移位等步骤进入胞质, 最终被细胞利用. 剩余部分的铁以铁蛋白和含铁血黄素的形式储存于骨髓、肝和脾的单核巨噬细胞中, 巨噬细胞内的铁可在FPN1作用下运出细胞进入血浆. 铁主要随肠道上皮细胞、胆汁、泌尿生殖道、皮肤、汗液等排出, 每天丢失总量约为1-2 mg.
由肝脏产生的富含半胱氨酸的抗菌多肽铁调素(hepcidin)[11]是一种调节组织铁储备及血清铁的主要激素, 与血浆转铁蛋白饱和度呈正相关. FPN1是铁调素的靶分子, 铁调素可与FPN1直接结合, 导致FPN1内吞和降解, 调节细胞内铁的外运[12]. 当机体的铁水平增高时肝产生的铁调素增多, 循环至小肠的铁调素结合肠上皮细胞膜的FPN1并使之降解, 继而减少肠上皮细胞内的铁向血浆转运, 因此吸收的铁大部分储存于肠上皮细胞内. 在1-2 d内肠上皮细胞衰老脱离肠上皮, 最后排除体外. 在巨噬细胞中, 铁调素通过调控FPN1的表达调节巨噬细胞铁的释放.
在正常情况下, 血浆的铁与转铁蛋白结合(由转铁蛋白受体1、转铁蛋白受体2和独立转铁蛋白受体参与), 主要被运送至骨髓参与造血, 少部分至肝脏. 衰老的红细胞主要被脾脏的巨噬细胞吞噬, 然后分解释放出铁, 这部分铁再次被转铁蛋白摄取继续参与铁的再循环. 肝脏过量的铁主要以铁蛋白的形式存在. 也可被网状内皮系统的kupffer细胞吞噬, 以含铁血黄素形式沉积在网状内皮系统内[13]. 或在肝细胞内以非转铁蛋白结合的血浆铁(non-transferrin-bound plasma iron, NTBI)形式出现(当转铁蛋白的饱和度超过45%)[14,15]. NTBI的主要靶器官是肝脏、心脏和胰腺, 他在DMT1和锌铁调控蛋白14(ZIP14)协助下以柠檬酸铁的形式被肝细胞摄取[16,17]. 肝脏摄取NTBI不受肝细胞铁过载的下调, 铁螯合剂去铁胺和去铁酮主要是针对NTBI摄取的抑制, 而不是对作为储存形式NTBI的动员和清除[18].
引起肝细胞内铁过载的疾病主要是原发性血色素沉着症等疾病, 原发性血色素沉着症是使肠道铁吸收过多, 导致肝脏以及其他器官铁过载[19]. 骨髓增生异常综合征等疾病因骨髓不能有效造血, 通过铁调素和FPN1使肠道的铁吸收增加[20]. 另外反复大量输血可以加重网状内皮系统的负担, 导致巨噬细胞吞噬的铁增加. 骨髓的抑制治疗使得造血能力降低、铁的利用率降低[21]. 这些均使转铁蛋白的饱和度增加, 进而引起血浆及肝脏等器官的NTBI升高, 最终导致组织器官铁过载. 病毒性肝硬化、酒精性肝硬化、血管内溶血等也能导致肝细胞内铁过载, 但程度较轻.
铁在生物体内表现出复杂多变的氧化、还原、磁性特征, 可影响生物活性并产生一定的毒性. 人体无主动排铁系统, 长时间铁累积可致铁中毒. 铁损伤肝脏细胞的机制可能为: (1)铁催化剂增强自由基介导的氧化应激, 产生有害自由基以及高反应羟基, 加剧细胞色素P4502E(cytochrome P2E, CYP2E)诱导的氧化应激, 导致肝细胞亚细胞膜磷脂过氧化反应, 特别是对线粒体和微粒体膜产生的过氧化损伤[22]; (2)通过干扰电子转移导致能量减少, 并影响T细胞和Kuffer细胞的功能导致肝细胞损伤; (3)在氧化亚铁的氧化反应时, 可以产生一些超铁或高铁活性基团, 损伤溶酶体膜和线粒体, 导致肝脏炎症反应和纤维化的形成[23,24]; (4)铁还可以引起DNA的损伤促进肝脏肿瘤的发生[25]. 肝脏铁过载可引起导致细胞、组织损伤[26], 最终发展为引起肝纤维化、肝硬化乃至肝癌[27]. 在我国肝硬化主要由乙型肝炎病毒(hepatitis B virus, HBV)引发, Lustbader等[28]认为, 含有大量铁的肝细胞容易被HBV感染, 有利于病毒复制, 铁与肝炎病毒具有协同毒性作用, 影响慢性肝炎患者对干扰素的应答, 影响肝炎的治疗效果.
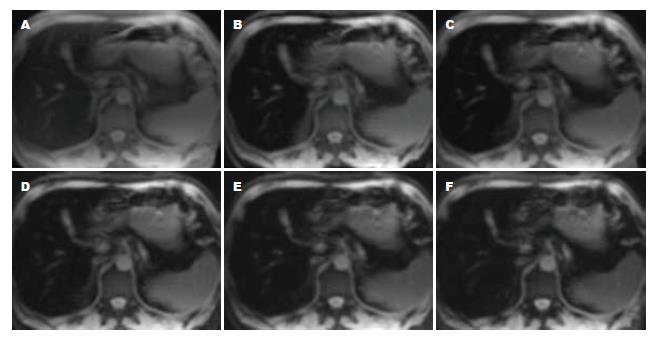
铁因有顺磁性, MRI检测组织铁是依赖于局部邻近氢质子与顺磁性铁之间的相互作用对弛豫时间产生的影响. 人体内铁蛋白及含铁血黄素具有顺磁性强化作用, 使SE(spin echo)序列横向弛豫时间T2和GRE(gradient recalled-echo)序列上的T2*缩短, 相对应地弛豫率(R2或R2*)增加[29,30]. 随着回波时间的延长, 由于铁的顺磁性作用, 肝脏信号逐渐衰减(图1)[31]. 多次屏气单次回波的快速SE序列和单次屏气多次回波的GRE序列是目前测量肝脏铁浓度(liver iron concentration, LIC)使用的主要序列, 通过快速SE序列和GRE序列分别得到回波弛豫时间T2和T2*, 进而得到弛豫率R2(1/T2)和R2*(1/T2*). 利用T2*、T2和铁浓度的负性关系实现对肝脏铁过载的评估及定量测量[32]. T2*和T2的关系可以用公式1/T2* = 1/T2+1/T2'来表达, T2'是由磁场不均匀引起的弛豫时间变化, 这也证明T2*对磁场不均匀更加敏感[33]. 但是, 也有相关文献报道R2和R2*肝脏铁过载测量方面具有相同敏感性, 测量结果与穿刺结果的相关性基本平行[34].
肝R2和R2*都可以用来评估肝脏铁过载, 且均具有一定的优点及局限性[35]. 快速SE序列扫描时间较长, 易受呼吸运动影响, 需要呼吸门控, 图像质量易受到影响, 导致测量结果的准确性降低. 但是在肝脏纤维化及肝脏炎症等情况下, R2与肝脏铁浓度保持高度的相关性, 而R2*的测量则会受到一定影响, 并且R2在一定程度上可以反映心脏铁沉积的情况[36]. GRE序列具有可以较快速的获得图像、对磁场的不均匀更加敏感以及不易受呼吸运动影响等优点. 因此, 在临床上, 单次屏气多次回波的GRE序列更为常用, 这种方法的测量结果更为准确, 具有良好的可比性和可重复性[37].
在MRI序列的不同回波时间下产生多幅图像, 通过测量肝脏感兴趣区域的信号强度, 测量感兴趣区信号强度时要避免肝内管道系统走形的区域, 不同回波时间下测得的信号强度呈指数衰减, 继而进一步通过相应软件分析信号强度得到肝脏的R2(1/T2)和R2*(1/T2*)[38], 并对LIC进行量化. Anderson公式(loge LIC = 2.65-1. 07loge T2*)[39]或Wood公式(LIC = 0.0254×R2*+0.202)[40]表明了T2*和R2*与LIC的定量关系, 这些铁浓度校验公式均来源于配对的磁共振活检标本. 另外, 还可以利用肝脏与其他器官组织(不易铁过载组织, 如竖脊肌)的信号比实现肝脏铁浓度的测量, 在网站http:/http://www. radio.univrennesl. fr/Sourse/EN/HemoRseult. htmly提供了相应换算系统, 这是较早的利用MRI评估LIC的方法, 目前逐步被T2和T2*替代.
目前, 1.5T磁共振成像技术是比较成熟的肝脏铁过载的测量技术. 随着MRI的不断发展, 3.0T磁共振成像技术亦逐渐应用于临床中. 虽然随着场强的提高, 图像的信噪比得以提高, 但是图像伪影也会随之增多, 并且在严重铁过载的患者中, 由于信号衰减速度较快, 场强高的磁共振设备在信号捕捉方面显示出不足, 这些不足可以通过缩短最短TE时间以及回波间隔、较小的翻转角度来尽量弥补.
值得注意的是, 并不是所有形式的铁都具有相同的顺磁性能力. 血池型铁, 虽然对机体有害, 磁力确是寂静的, 不易被检测出. 作为防御循环铁的最初防线, 铁蛋白在细胞浆内自由弥散时只能被MRI微弱地检测到. 当铁蛋白积聚或其崩解产物-含铁血黄素, 对组织的R2和R2*产生压倒性的影响. 含铁血黄素代表铁的主要存储形式, 其浓度变化非常缓慢, 而R2*主要是由含铁血黄素浓度决定[19], R2则保存了对溶解铁蛋白的敏感性, 这也更好地说明了临床上为什么静脉注射去铁胺后患者的心律失常很快被抑制、心功能很快得到改善而心脏组织的铁沉积减低很晚才能被R2反映出来. 当然, 应用"降低R2"的技术可以分开估算铁蛋白和含铁血黄素的浓度.
通过定量测定静脉切开的放血量, 人们发现血浆铁蛋白和机体铁的总的储存量密切相关. 虽然尚不知血浆铁蛋白是如何产生的, 但是目前他仍然是评估机体铁总的储存量的最便捷方法, 不过这一方法的测量结果容易受到炎症、感染和恶性肿瘤的影响, 因此在临床上的应用受到限制[41]. 肝脏穿刺活检是肝脏铁过载测量的金标准, 可以直接反应肝脏的铁过载情况, 检测肝脏铁过载情况, 指导螯合治疗. 但是作为一项有创检查有产生并发症的可能. 由于肝脏不同部位铁沉积量不同, 更是需要对肝脏进行多点穿刺才能使检测结果更加准确, 这样大大增加了并发症的发生率. 另外, 需要多次穿刺才能对肝脏铁过载情况进行检测, 指导螯合治疗. 肝脏穿刺活检虽然是肝脏铁过载检测金标准, 但是在临床上的应用具有很大的局限性[42,43].
磁共振作为一种无创检查技术, 在检测肝脏铁过载中的价值逐渐被重视. 他能够有效测量不同疾病中肝脏铁浓度, 对肝脏铁过载程度进行分级评估, 进而评估病情的发展以及监测铁过载螯合治疗的效果. 许多研究表明测量横向弛豫率R2*(1/T2*)并应用相关软件对其进行量化, 最终得出的肝脏铁浓度结果与肝脏活检结果有高度的相关性[44]. Gianesin等[45]在97位铁过载病患中证实横向弛豫率R2*与肝穿刺活检的相关系数(r) = 0.72. St Pierre等[46]在100多例铁过载患者中检测肝脏的R2*值, 发现R2*值与铁水平呈显著相关相关系数(r) = 0.981, 可预测的误差与肝穿刺活检相当. Hankins等[47]在43位患者中(包括镰刀细胞贫血患者、重度地中海贫血患者以及骨髓异常增殖综合患者)中证实横向弛豫率R2*与肝穿刺活检的相关系数(r) = 0.96-0.98, 说明磁共振是一种安全、有效的检测肝脏铁过载的检查技术. MRI能评估整个器官的铁浓度并准确测量LIC, 这种能力在具有不同铁来源的铁过载患者中尤为突出. MRI还可用于显示体内铁过载的三维分布情况. 通过对LIC的检测, 可以对肝纤维化程度进行分级. 评估体内铁总量, 体内铁总量(mg/g) = 10.6×LIC(mg/g干重)[48], Brown等[49]报道在40名患者中采用R2对患者LIC进行监测, 指导临床及时进行铁螯合治疗, 进而降低患者机体铁过载, 提高患者的生存率; 评估铁剂螯合治疗的效果, 指导临床治疗, 还可以确定肝脏铁浓度对心脏以及其他器官的影响. Kirk等[50]研究表明当LIC>15 mg/g干重时, 发生心力衰竭的几率会增高. Cassinerio等[51]报道27名地中海贫血患者在接受规律不同铁螯合治疗后, 心脏的T2*明显上升, 左心室射血分数也得到一定提高.
磁共振是一种无创检查方法, 在临床应用上较其他检查方法具有一定优势. 然而, MRI在肝脏那个铁过载评估方面仍存在一定局限性. 首先, MRI检查不能直接反映肝脏铁浓度, 得到的肝脏铁浓度是间接测量结果; 其次, 肝脏纤维化以及脂肪变性会对测量结果产生影响, Joe等[52]报道双源CT检测肝脏铁可以避免脂肪变性对检测结果的影响; 再次, 随着肝脏铁浓度的上升, 肝脏信号的衰减速率会加快, 磁共振对衰减信号的捕捉能力会下降, 在1.5T磁共振上肝铁浓度的检测上限是30-40 mg/g干重[53]. 此外, 不同场强的磁共振设备对信号的获取会产生不同影响. 文献报道, 1.5T与3.0T测量得出的T2*近似2倍的关系[18], 但是目前此方面的研究较少, 这个结论还需要进一步证实. 我们在3.0T设备的初步应用结果表现, 与1.5T设备相比, 虽然图像信噪比得以提高, 但是缺乏相应的软件将T2*量化为肝脏铁浓度, 因此高场强MRI设备检测肝脏铁浓度的技术需要进一步改进. 最后, 儿童及老年患者往往因配合欠佳, 在进行MRI检查时受到一定限制.
肝脏铁过载可导致肝纤维化和肝硬化, 甚至可诱导肿瘤. 血浆铁蛋白浓度测定、肝穿刺活检技术以及无创检查SQUIDs在肝铁过载铁沉积量的测量中的价值非常有限. MRI具有无创、简便、安全、准确等优势, 更加适合用来对肝脏铁过载进行评估和指导治疗, 从而达到提高治疗疗效、提高患者生存质量的效果. 相信随着铁代谢分子生物学的深入和MRI软、硬件的完善, 用MRI来评价铁过载将越来越普遍.
肝脏铁过载与肝炎、肝纤维化、肝硬化及肿瘤具有密切关系, 目前监测铁过载的方法, 如血浆铁蛋白检测、肝脏穿刺活检以及无创检查超导量子干涉仪等均具有一定的局限性而应用受限.
官泳松, 教授, 四川大学华西医院放射科
磁共振成像技术(MRI)对肝脏铁过载具有无创、安全、简便、重复性好等特点, 在临床应用中显示出巨大的潜力.
本文介绍并指出MRI技术已逐渐成为一种安全、有效检测肝脏铁含量的方法, 能够有效测量不同疾病中肝脏铁浓度, 对肝脏铁过载程度进行分级评估, 进而评估病情的发展以及评估肝脏铁过载螯合治疗效果, 预防并发症的产生.
T2、R2(1/T2): T2多次屏气单次回波SE序列的弛豫时间, T2值与肝脏的铁沉积严重程度呈负相关. R2与T2互为倒数关系, 为弛豫率, R2值与肝脏的铁沉积严重程度呈正相关; T2*、R2*(1/T2*): T2*单次屏气多次回波GRE序列的弛豫时间, T2*值与肝脏的铁沉积严重程度呈负相关. R2*与T2*互为倒数关系, 为弛豫率, R2*值与肝脏的铁沉积严重程度呈正相关.
本文主要对肝脏铁过载及MRI在肝脏铁过载中的应用进展进行综述, 内容较丰富, 对肝脏病的防治有一定的临床应用价值.
编辑: 张姗姗 电编:鲁亚静
| 1. | Lim RP, Tuvia K, Hajdu CH, Losada M, Gupta R, Parikh T, Babb JS, Taouli B. Quantification of hepatic iron deposition in patients with liver disease: comparison of chemical shift imaging with single-echo T2*-weighted imaging. AJR Am J Roentgenol. 2010;194:1288-1295. [PubMed] [DOI] |
| 2. | Eisenbach C. HFE Gene Mutations, Iron Overload and Cryptogenic Liver Cirrhosis. Hepat Mon. 2012;12:209-210. [PubMed] [DOI] |
| 3. | Szurowska E, Sikorska K, Izycka-Swieszewska E, Nowicki T, Romanowski T, Bielawski KP, Studniarek M. The role of MR imaging in detection of hepatic iron overload in patients with cirrhosis of different origins. BMC Gastroenterol. 2010;10:13. [PubMed] [DOI] |
| 4. | 刘 敏, 汪 之顼, 谷 贻光, 荫 士安. 铁过量对慢性疾病的影响. 国外医学: 老年医学分册. 2005;26:82-85. |
| 6. | Fischer R, Harmatz PR. Non-invasive assessment of tissue iron overload. Hematology Am Soc Hematol Educ Program. 2009;215-221. [PubMed] [DOI] |
| 7. | Angelucci E, Barosi G, Camaschella C, Cappellini MD, Cazzola M, Galanello R, Marchetti M, Piga A, Tura S. Italian Society of Hematology practice guidelines for the management of iron overload in thalassemia major and related disorders. Haematologica. 2008;93:741-752. [PubMed] [DOI] |
| 8. | Siddique A, Kowdley KV. Review article: the iron overload syndromes. Aliment Pharmacol Ther. 2012;35:876-893. [PubMed] [DOI] |
| 10. | Graham RM, Chua AC, Herbison CE, Olynyk JK, Trinder D. Liver iron transport. World J Gastroenterol. 2007;13:4725-4736. [PubMed] |
| 11. | Ganz T, Nemeth E. The hepcidin-ferroportin system as a therapeutic target in anemias and iron overload disorders. Hematology Am Soc Hematol Educ Program. 2011;2011:538-542. [PubMed] |
| 12. | Schmidt PJ, Fleming MD. Transgenic HFE-dependent induction of hepcidin in mice does not require transferrin receptor-2. Am J Hematol. 2012;87:588-595. [PubMed] [DOI] |
| 13. | Hankins JS, Smeltzer MP, McCarville MB, Aygun B, Hillenbrand CM, Ware RE, Onciu M. Patterns of liver iron accumulation in patients with sickle cell disease and thalassemia with iron overload. Eur J Haematol. 2010;85:51-57. [PubMed] |
| 14. | Kohgo Y, Ikuta K, Ohtake T, Torimoto Y, Kato J. Body iron metabolism and pathophysiology of iron overload. Int J Hematol. 2008;88:7-15. [PubMed] [DOI] |
| 15. | Brissot P, Ropert M, Le Lan C, Loréal O. Non-transferrin bound iron: A key role in iron overload and iron toxicity. Biochim Biophys Acta. 2012;1820:403-410. [PubMed] |
| 16. | Prus E, Fibach E. Uptake of non-transferrin iron by erythroid cells. Anemia. 2011;2011:945289. [PubMed] |
| 17. | Hider RC, Silva AM, Podinovskaia M, Ma Y. Monitoring the efficiency of iron chelation therapy: the potential of nontransferrin-bound iron. Ann N Y Acad Sci. 2010;1202:94-99. [PubMed] [DOI] |
| 18. | Pepe A, Meloni A, Capra M, Cianciulli P, Prossomariti L, Malaventura C, Putti MC, Lippi A, Romeo MA, Bisconte MG. Deferasirox, deferiprone and desferrioxamine treatment in thalassemia major patients: cardiac iron and function comparison determined by quantitative magnetic resonance imaging. Haematologica. 2011;96:41-47. [PubMed] [DOI] |
| 19. | Musallam KM, Cappellini MD, Wood JC, Taher AT. Iron overload in non-transfusion-dependent thalassemia: a clinical perspective. Blood Rev. 2012;26 Suppl 1:S16-S19. [PubMed] [DOI] |
| 20. | Sockel K, Ehninger G, Hofbauer LC, Platzbecker U. Optimizing management of myelodysplastic syndromes post-allogeneic transplantation. Expert Rev Hematol. 2011;4:669-680. [PubMed] [DOI] |
| 21. | Greenberg P, Cox C, LeBeau MM, Fenaux P, Morel P, Sanz G, Sanz M, Vallespi T, Hamblin T, Oscier D. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood. 1997;89:2079-2088. [PubMed] |
| 22. | Zaccone V, Gasbarrini G. [From iron accumulation to organ damage]. Minerva Med. 2012;103:123-140. [PubMed] |
| 23. | 韩 巍, 王 朝旭. 铁负荷与人体健康. 国外医学: 卫生学分册. 2008;35:52-56. |
| 25. | Gopakumar G, Belanzoni P, Baerends EJ. Hydroxylation catalysis by mononuclear and dinuclear iron oxo catalysts: a methane monooxygenase model system versus the Fenton reagent Fe(IV)O(H2O)5(2+). Inorg Chem. 2012;51:63-75. [PubMed] [DOI] |
| 26. | Deugnier Y, Turlin B. Pathology of hepatic iron overload. Semin Liver Dis. 2011;31:260-271. [PubMed] [DOI] |
| 27. | Andrews NC. Disorders of iron metabolism. N Engl J Med. 1999;341:1986-1995. [PubMed] [DOI] |
| 28. | Lustbader ED, Hann HW, Blumberg BS. Serum ferritin as a predictor of host response to hepatitis B virus infection. Science. 1983;220:423-425. [PubMed] [DOI] |
| 29. | Chandarana H, Lim RP, Jensen JH, Hajdu CH, Losada M, Babb JS, Huffman S, Taouli B. Hepatic iron deposition in patients with liver disease: preliminary experience with breath-hold multiecho T2*-weighted sequence. AJR Am J Roentgenol. 2009;193:1261-1267. [PubMed] [DOI] |
| 30. | Ghugre NR, Coates TD, Nelson MD, Wood JC. Mechanisms of tissue-iron relaxivity: nuclear magnetic resonance studies of human liver biopsy specimens. Magn Reson Med. 2005;54:1185-1193. [PubMed] [DOI] |
| 31. | Henninger B, Kremser C, Rauch S, Eder R, Zoller H, Finkenstedt A, Michaely HJ, Schocke M. Evaluation of MR imaging with T1 and T2* mapping for the determination of hepatic iron overload. Eur Radiol. 2012; May 30. [Epub ahead of print]. [PubMed] [DOI] |
| 32. | Kim D, Jensen JH, Wu EX, Sheth SS, Brittenham GM. Breathhold multiecho fast spin-echo pulse sequence for accurate R2 measurement in the heart and liver. Magn Reson Med. 2009;62:300-306. [PubMed] [DOI] |
| 33. | Queiroz-Andrade M, Blasbalg R, Ortega CD, Rodstein MA, Baroni RH, Rocha MS, Cerri GG. MR imaging findings of iron overload. Radiographics. 2009;29:1575-1589. [PubMed] [DOI] |
| 34. | Song R, Lin W, Chen Q, Asakura T, Wehrli FW, Song HK. Relationships between MR transverse relaxation parameters R*(2), R(2) and R'(2) and hepatic iron content in thalassemic mice at 1.5 T and 3 T. NMR Biomed. 2008;21:574-580. [PubMed] [DOI] |
| 35. | Juchems MS, Cario H, Schmid M, Wunderlich AP. Liver iron content determined by MRI: spin-echo vs. gradient-echo. Rofo. 2012;184:427-431. [PubMed] [DOI] |
| 36. | Fernandes JL, Sampaio EF, Verissimo M, Pereira FB, da Silva JA, de Figueiredo GS, Kalaf JM, Coelho OR. Heart and liver T2 assessment for iron overload using different software programs. Eur Radiol. 2011;21:2503-2510. [PubMed] [DOI] |
| 37. | McCarville MB, Hillenbrand CM, Loeffler RB, Smeltzer MP, Song R, Li CS, Hankins JS. Comparison of whole liver and small region-of-interest measurements of MRI liver R2* in children with iron overload. Pediatr Radiol. 2010;40:1360-1367. [PubMed] [DOI] |
| 38. | Tziomalos K, Perifanis V. Liver iron content determination by magnetic resonance imaging. World J Gastroenterol. 2010;16:1587-1597. [PubMed] [DOI] |
| 39. | Anderson LJ, Holden S, Davis B, Prescott E, Charrier CC, Bunce NH, Firmin DN, Wonke B, Porter J, Walker JM. Cardiovascular T2-star (T2*) magnetic resonance for the early diagnosis of myocardial iron overload. Eur Heart J. 2001;22:2171-2179. [PubMed] [DOI] |
| 40. | Wood JC, Enriquez C, Ghugre N, Tyzka JM, Carson S, Nelson MD, Coates TD. MRI R2 and R2* mapping accurately estimates hepatic iron concentration in transfusion-dependent thalassemia and sickle cell disease patients. Blood. 2005;106:1460-1465. [PubMed] [DOI] |
| 41. | Büyükaşik NS, Nadır I, Akin FE, Cakal B, Kav T, Ersoy O, Büyükaşik Y. Serum iron parameters in cirrhosis and chronic hepatitis: detailed description. Turk J Gastroenterol. 2011;22:606-611. [PubMed] |
| 42. | Crisponi G, Ambu R, Cristiani F, Mancosu G, Nurchi VM, Pinna R, Faa G. Does iron concentration in a liver needle biopsy accurately reflect hepatic iron burden in beta-thalassemia? Clin Chem. 2000;46:1185-1188. [PubMed] |
| 43. | Villeneuve JP, Bilodeau M, Lepage R, Côté J, Lefebvre M. Variability in hepatic iron concentration measurement from needle-biopsy specimens. J Hepatol. 1996;25:172-177. [PubMed] [DOI] |
| 44. | Vasanawala SS, Yu H, Shimakawa A, Jeng M, Brittain JH. Estimation of liver T2 in transfusion-related iron overload in patients with weighted least squares T2 IDEAL. Magn Reson Med. 2012;67:183-190. [PubMed] [DOI] |
| 45. | Gianesin B, Zefiro D, Musso M, Rosa A, Bruzzone C, Balocco M, Carrara P, Bacigalupo L, Banderali S, Rollandi GA. Measurement of liver iron overload: noninvasive calibration of MRI-R2* by magnetic iron detector susceptometer. Magn Reson Med. 2012;67:1782-1786. [PubMed] [DOI] |
| 46. | St Pierre TG, Clark PR, Chua-anusorn W, Fleming AJ, Jeffrey GP, Olynyk JK, Pootrakul P, Robins E, Lindeman R. Noninvasive measurement and imaging of liver iron concentrations using proton magnetic resonance. Blood. 2005;105:855-861. [PubMed] [DOI] |
| 47. | Hankins JS, McCarville MB, Loeffler RB, Smeltzer MP, Onciu M, Hoffer FA, Li CS, Wang WC, Ware RE, Hillenbrand CM. R2* magnetic resonance imaging of the liver in patients with iron overload. Blood. 2009;113:4853-4855. [PubMed] [DOI] |
| 48. | Angelucci E, Brittenham GM, McLaren CE, Ripalti M, Baronciani D, Giardini C, Galimberti M, Polchi P, Lucarelli G. Hepatic iron concentration and total body iron stores in thalassemia major. N Engl J Med. 2000;343:327-331. [PubMed] [DOI] |
| 49. | Kirk P, Roughton M, Porter JB, Walker JM, Tanner MA, Patel J, Wu D, Taylor J, Westwood MA, Anderson LJ. Cardiac T2* magnetic resonance for prediction of cardiac complications in thalassemia major. Circulation. 2009;120:1961-1968. [PubMed] [DOI] |
| 50. | Brown GC, Patton WN, Tapp HE, Taylor DJ, St Pierre TG. Spin-density-projection-assisted R2 magnetic resonance imaging of the liver in the management of body iron stores in patients receiving multiple red blood cell transfusions: an audit and retrospective study in South Australia. Intern Med J. 2012; May 30. [Epub ahead of print]. [PubMed] [DOI] |
| 51. | Cassinerio E, Roghi A, Pedrotti P, Brevi F, Zanaboni L, Graziadei G, Pattoneri P, Milazzo A, Cappellini MD. Cardiac iron removal and functional cardiac improvement by different iron chelation regimens in thalassemia major patients. Ann Hematol. 2012; May 10. [Epub ahead of print]. [PubMed] [DOI] |
| 52. | Joe E, Kim SH, Lee KB, Jang JJ, Lee JY, Lee JM, Han JK, Choi BI. Feasibility and accuracy of dual-source dual-energy CT for noninvasive determination of hepatic iron accumulation. Radiology. 2012;262:126-135. [PubMed] [DOI] |
| 53. | Wood JC. Impact of iron assessment by MRI. Hematology Am Soc Hematol Educ Program. 2011;2011:443-450. [PubMed] |