修回日期: 2012-05-22
接受日期: 2012-06-01
在线出版日期: 2012-07-18
目的: 探讨沉香化气胶囊对糖尿病(diabetes mellitus, DM)大鼠小肠Cajal间质细胞(intersti-
tial cells of Cajal, ICC)、肌间神经丛的影响.
方法: 将健康♂SD大鼠分为正常对照组、DM模型组、DM模型+中药组. 大鼠一次性腹腔注射(ip)链脲佐菌素(STZ, 60 mg/kg)造模, 选取成功模型, DM模型+中药组每天给予中药灌胃, 模型组和正常对照组每天给予同等容量的蒸馏水, 持续灌胃4 wk. 所有大鼠干预4 wk结束后, 给予印度墨汁灌胃测定小肠传输速率, 利用免疫组织化学和图像分析观察十二指肠c-Kit、突触素(synaptophysin, Syn)、蛋白基因产物9.5(protein gene product 9.5, PGP9.5)的表达.
结果: 灌胃4 wk后, DM模型+中药组小肠传输速率均比DM模型组明显增加(71.26±5.22 vs 45.52±6.42, P<0.01), 仍低于对照组(71.26±5.22 vs 80.40±7.33, P<0.05); DM模型+中药组c-Kit、突触素、PGP9.5的阳性产物面积和吸光度值均比DM模型组明显增加(443.28±24.40 vs 358.83±35.03, 832.33±58.78 vs 488.83±58.56, 889.17±82.75 vs 445.17±64.06, 0.16±0.02 vs 0.13±0.02, 0.25±0.02 vs 0.16±0.01, 0.24±0.02 vs 0.15±0.01, 均P<0.01), 仍低于正常对照组(443.28±24.40 vs 557.28±42.35, P<0.01; 832.33±58.78 vs 937.67±101.23, P<0.05; 889.17±82.75 vs 1050.50±90.22, P<0.01; 0.16±0.02 vs 0.18±0.02, P<0.05; 0.25±0.02 vs 0.29±0.03, P<0.01; 0.24±0.02 vs 0.27±0.02, P<0.01).
结论: 沉香化气胶囊可以促进糖尿病大鼠小肠肌间神经丛c-Kit、突触素和PGP9.5的表达, 提示对受损的DM大鼠小肠ICC、肌间神经丛有部分恢复作用, 从而对糖尿病大鼠的胃肠动力障碍有一定的改善效应.
引文著录: 陈凤琴, 余跃, 薛丹, 王巧民. 沉香化气胶囊对糖尿病大鼠小肠ICC和肌间神经丛的影响. 世界华人消化杂志 2012; 20(20): 1858-1862
Revised: May 22, 2012
Accepted: June 1, 2012
Published online: July 18, 2012
AIM: To explore the protection of Chenxiang Huaqi Capsules against the impairment of interstitial cells of Cajal (ICC) and myenteric plexus in the intestine of diabetic rats.
METHODS: Healthy male SD rats were randomly divided into three groups: control group, diabetes mellitus (DM) group, and DM + Chinese herb group (DM + CH group). DM was induced in rats by a single intraperitoneal injection of streptozotocin (STZ, 60 mg/kg). The DM + CH group was given herb 15.75 g/(kg•d), while the DM group and control group were given equal volumes of distilled water. Four weeks after intervention, all rats were given Indian ink by lavage for determining the small intestinal transit rate. The expression of c-Kit, synaptophysin, and PGP9.5 was studied by immunohistochemistry and quantified using an image analyzer.
RESULTS: Four weeks after treatment, the small intestine transit rate was increased obviously in the DM + CH group compared to the DM group (71.26 ± 5.22 vs 45.52 ± 6.42, P < 0.01), but was still lower than that in the control group (71.26 ± 5.22 vs 80.40 ± 7.33, P < 0.05). The total area and mean optical density value of c-Kit-positive products in the myenteric plexus were significantly increased in the DM + CH group compared to the DM group (443.28 ± 24.40 vs 358.83 ± 35.03, P < 0.01; 0.16 ± 0.02 vs 0.13 ± 0.02, P < 0.01), but were still lower than those in the control group (443.28 ± 24.40 vs 557.28 ± 42.35, P < 0.01; 0.16 ± 0.02 vs 0.18 ± 0.02, P < 0.05). Similar results were also obtained for synaptophsin- and PGP9.5-positive products.
CONCLUSION: Chenxiang Huaqi Capsules may improve intestinal motility by partially reversing abnormal changes in the intestinal ICC and expression of c-Kit, synaptophysin and PGP9.5 in diabetic rats.
- Citation: Chen FQ, Yu Y, Xue D, Wang QM. Effect of Chenxiang Huaqi Capsules on interstitial cells of Cajal and myenteric plexus in the intestine of diabetic rats. Shijie Huaren Xiaohua Zazhi 2012; 20(20): 1858-1862
- URL: https://www.wjgnet.com/1009-3079/full/v20/i20/1858.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i20.1858
胃肠动力障碍是糖尿病(diabetes mellitus, DM)重要的并发症之一, 其发病率为25%-76%[1], 严重影响患者生活质量. 研究显示胃肠动力障碍与Cajal间质细胞(interstitial cells of Cajal, ICC)、肠神经系统(enteric nervous system, ENS)和平滑肌细胞(smooth muscle cells, SMC)的功能密切相关[2,3]. 沉香化气胶囊原载清代方书《增补万病回春》, 主要作用为理气疏肝, 消积和胃. 目前已广泛应用于临床, 厉兰娜等[4]应用沉香化气胶囊治疗40例功能性消化不良患者, 结果发现患者胃排空时间明显缩短, 总有效率为92.5%, 且患者胃饱胀、嗳气、泛酸、排便不畅等症状明显好转. 蔡震寨等对便秘型肠易激综合征[5]和功能性消化不良[6]的研究发现, 患者经沉香化气胶囊治疗4 wk后, 有关肠道气体的相关症状明显改善, 患者肠道容积积分与治疗前比较明显减少(P<0.05), 提示沉香化气胶囊能促进患者肠道气体的排出. 尽管沉香化气胶囊对胃肠动力有一定的改善作用, 但沉香化气胶囊改善胃肠动力的作用机制不甚明确. 本实验通过观察沉香化气胶囊对DM大鼠小肠c-Kit、突触素和PGP9.5表达的变化, 旨在探讨其调控DM胃肠动力障碍的作用机制, 为临床治疗提供理论依据.
健康成年♂SD大鼠36只, 体质量180-210 g, 由安徽医科大学实验中心提供. 实验前在同一环境中至少饲养1 wk, 自由进食、进水, 保持光照周期12 h/12 h. 沉香化气胶囊(由沉香、木香、广藿香、香附、砂仁、莪术等组成)购自杭州胡庆余堂药业有限公司(国药准字Z20010066, 批号100905, 0.45 g/粒), 链脲佐菌素(Streptozotocin, STZ, 北京华迈科生物技术有限责任公司), 精蛋白锌胰岛素注射液(江苏万邦生化医药股份有限公司); 罗氏血糖仪器(ACCU-CHEK®Performa, Germany), 血糖试纸(ACCU-CHEK®Performa, Germany), 印度墨水(Solarbio cat, No.18060); 突触素单克隆一抗(美国Santa Cruz公司), PGP9.5单克隆一抗(英国Abcam公司), c-Kit多克隆一抗(美国Santa Cruz公司); SP法免疫组织化学试剂盒(北京中杉金桥公司).
1.2.1 糖尿病大鼠模型造模及分组: 36只SD大鼠自由饮水、进食, 12 h/12 h昼夜适应性喂养1 wk后, 随机分为实验组(26只), 正常对照组(10只). 其中实验组按60 mg/kg的注射量称取STZ, 溶于柠檬酸缓冲液配制为10 g/L浓度的STZ溶液, 进行腹腔注射. 72 h及1 wk后尾静脉采血, 以血糖持续1 wk≥16.9 mmol/L[7]者为DM大鼠模型建立, 共成模20只. 将成模大鼠随机分为两组: DM+中药组和DM组. 根据《中药药理研究方法学》[大鼠剂量 = 人剂量×35(人转换因子)/6(大鼠转换因子)]计算出人鼠等效剂量为15.75 g/(kg·d)[8,9], DM组和正常对照组给以同等容量的蒸馏水灌胃, 每日1次, 每周给药7次, 共4 wk[10].
1.2.2 一般状况: 造模成功后观察饮食、饮水、粪便、毛色及精神状况, 每周称重.
1.2.3 血糖值测定: 造模成功后, 持续给药4 wk, 每周测定各组大鼠血糖值.
1.2.4 小肠传输速率测定: 造模成功, 给药4 wk末, 各组大鼠禁食不禁水24 h, 次日分别经口灌入印度墨汁0.5 mL, 30 min后水合氯醛(3 mL/kg)腹腔注射, 麻醉大鼠后处死, 用生理盐水冲洗血液[11], 取出全胃肠道, 计算无张力下小肠传输速率(墨水前端至幽门括约肌距离/小肠全长×100%).
1.2.5 小肠PGP9.5、突触素、c-Kit免疫组织化学染色: 取近端十二指肠约0.5 cm, 4%多聚甲醛固定, 石蜡包埋, 切片, 片厚3 μm. 免疫组织化学染色程序如下: (1)切片脱蜡至水, 3%H2O2室温5-10 min灭活内源性酶, 蒸馏水洗3次; (2)微波抗原修复: 将切片浸入0.01 mol/L枸橼酸盐缓冲液(pH 6.0)中热修复20 min, 室温冷却后, PBS洗3次, 每次3 min; (3)滴加正常山羊血清封闭液, 室温12 min, 去多余液体; (4)滴加一抗: 突触素单克隆抗体浓度为1:150, PGP9.5单克隆抗体浓度为1:150, c-Kit多克隆抗体浓度为1:300, 4 ℃孵育过夜; (5)37 ℃温箱孵育45 min, PBS同上洗3次; (6)生物素化山羊抗大鼠二抗(生物素化山羊抗兔二抗)37 ℃孵育12 min, PBS同上洗3次; (7)辣根酶标记链霉卵白素试剂37 ℃孵育12 min, PBS同上洗3次; (8)DAB显色, 光学显微镜下观察出现棕色阳性产物时终止反应, 蒸馏水洗、苏木素复染、脱水、透明、封片. 在光镜下观察, 比较正常组、中药组和模型组切片肌间神经丛内突触素、PGP9.5和c-Kit免疫反应阳性产物. 每张切片随机选取5个肌间神经丛的高倍视野, 使用形态学图像分析系统(JEOR 80ID, version 6.0)测定免疫反应阳性产物的面积和平均吸光度(A)值.
统计学处理 数据均以mean±SD表示, 应用SPSS17.0统计软件进行处理, 多组资料间比较采用LSD检验分析.
造模成功后, DM大鼠出现多饮、多食、多尿、消瘦、精神萎靡、行动迟缓、毛色干枯无光泽. 给药4 wk后, DM+中药组较DM组大鼠多饮、多食、多尿症状减轻, 体质量明显增加(P<0.01), 精神状态好转, 但DM+中药组体质量仍比正常组降低(P<0.05, 表1).
4 wk后, DM组的血糖显著高于正常对照组(P<0.01), DM+中药组比DM组的血糖值显著降低(P<0.01), 仍高于正常对照组(P<0.01, 表1).
4 wk后, DM组的小肠传输速率明显低于正常对照组(P<0.01), DM+中药组的传输速率比DM组显著增加(P<0.01), 仍低于正常对照组(P<0.05, 表1).
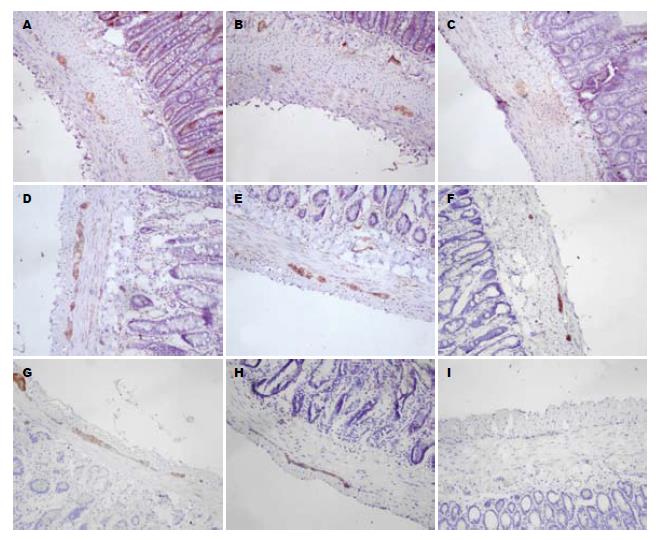
免疫组织化学结果显示各组小肠肌间神经丛内均可见到c-Kit、突触素、PGP9.5免疫反应阳性细胞, 阳性产物呈棕黄色. DM组c-Kit、突触素、PGP9.5平均阳性产物面积和吸光度(A)值明显减少, DM+中药组c-Kit、突触素、pGP9.5阳性产物面积和平均A值较模型组显著增加, 但仍低于正常对照组(表2, 图1).
| c-Kit | 突触素 | PGP9.5 | ||||
| 阳性产物面积 | 平均吸光度值 | 阳性产物面积 | 平均吸光度值 | 阳性产物面积 | 平均吸光度值 | |
| 正常组 | 557.28±42.35 | 0.1796±0.0208 | 937.67±101.23 | 0.2927±0.0319 | 1050.50±90.22 | 0.2722±0.0162 |
| DM+中药组 | 443.28±24.40d | 0.1622±0.0200c | 832.33±58.78c | 0.2446±0.0166d | 889.17±82.75d | 0.2363±0.0149d |
| DM组 | 358.83±35.03b | 0.1279±0.0176b | 488.83±58.56b | 0.1639±0.0091b | 445.17±64.06b | 0.1536±0.0108b |
临床和实验证明DM患者存在胃肠动力障碍[1,3,12], 胃肠动力障碍是DM患者的常见并发症之一, DM胃肠动力障碍的病理生理特点是: 胃肠张力和收缩力低下、蠕动减慢、排空延迟[12]. 前期研究发现DM小鼠存在小肠传输速率的下降, 并且外源性干细胞因子对DM小鼠小肠动力障碍有一定的改善作用[13]. 本研究的重点在于观察DM大鼠是否存在小肠动力障碍以及沉香化气胶囊对DM大鼠的小肠动力障碍是否有改善作用. 经过研究发现, DM组大鼠小肠传输速率明显低于正常组, 中药持续灌胃干预4 wk后, DM+中药组比DM组的大鼠小肠传输速率明显增加, 但仍比正常对照组低, 这表明沉香化气胶囊能改善DM大鼠的小肠动力, 促进小肠传输. 此外, 光镜下可见DM+中药组的c-Kit、突触素、PGP9.5阳性产物表达的面积和平均吸光度(A)值均比DM组增加, 但低于正常对照组. 这表明沉香化气胶囊可以部分恢复DM大鼠受损的小肠ICC、肌间神经丛. 提示沉香化气胶囊通过促进DM大鼠小肠ICC、肠神经系统的恢复, 从而改善DM大鼠胃肠动力障碍.
沉香化气胶囊原载清代方书《增补万病回春》, 主要作用为理气疏肝, 消积和胃. 沉香、木香、莪术行气止痛, 藿香、砂仁温中化湿, 香附疏肝解郁, 陈皮理气健脾, 燥湿化痰, 神曲、麦芽消食和胃, 甘草调和诸药. 吴承艳等[14]研究表明木香可显著增强小鼠胃肠推进运动, 使离体大鼠回肠收缩幅度明显增大, 有促胃肠动力及止痛作用. 李伟等[15]研究发现陈皮能促进小鼠胃排空和肠推进, 其促进肠推进作用可能与胆碱能M受体有关. 同时, 蔡振寨等临床研究发现经沉香化气胶囊治疗后, 肠易激综合征[5]、功能性消化不良[6]的患者腹痛、腹胀等症状明显好转, 腹痛腹胀症状积分明显下降, 治疗后肠道气体也明显减少. 这与我们的研究结果是一致的.
胃肠运动功能的正常发挥需要ICC、肠神经系统和平滑肌细胞的共同参与, 他们中任何一个受到损伤都会使胃肠功能受到不同程度的影响. ICC是胃肠道慢波活动的起搏细胞, 参与基本电节律的传播和神经信息传递等, 同平滑肌细胞和神经相互连接成网络共同调节胃肠道运动[16,17]. 多种疾病与ICC数量减少和超微结构破坏有关, 例如便秘[18]、多器官功能障碍综合征[19]等, 同时多项临床和实验研究显示, DM患者或动物肠道ICC(c-Kit阳性细胞)数量与正常组相比明显下降, 并且给予外源性干细胞因子有利于ICC恢复[1,20].
肠神经系统主要由胃肠道壁内微小神经节内所含有的各类神经元和节间索组成, 是一个结构和功能独特的系统. 突触素抗体能选择性标记胃肠道肌间神经丛的突触和肌层的神经肌肉接头, 是评价胃肠动力功能单元的重要指标[21]. PGP9.5是目前应用较为广泛的神经结构标志物, 他能广泛表达于运动和感觉神经元的前体细胞以及其他的神经细胞, 在神经细胞的生长和分化中作用至关重要[22]. 多项研究显示肠神经系统的损伤与胃肠传输速率的调控有一定程度的关系, Li等[23]研究结果显示DM大鼠肌间神经丛突触素和PGP9.5的阳性表达明显低于对照组. Geramizadeh等[18]对慢性传输型便秘的研究结果发现: 与对照组相比, 便秘患者环肌层内的PGP9.5阳性细胞数量明显下降. 我们的研究结果同样显示DM大鼠小肠肌间神经丛内突触素和PGP9.5的阳性明显低于正常组, 并且给予中药4 wk后, 中药组突触素和PGP9.5的阳性高于模型对照组, 但是仍低于正常组.
目前, DM胃肠动力障碍患者主要是进行西医治疗, 西医治疗的主要方法是使用促胃肠动力药, 改善患者局部的症状, 且存在的不良反应限制了临床应用[24], 中医学的主要特点是整体观念和辨证论治, 通过改善患者的全身状态从而改善患者的胃肠功能, 在治疗DM胃肠动力障碍方面显示了广阔的发展前景.
总之, 本研究证实了DM大鼠确实存在胃肠动力障碍, 沉香化气胶囊通过部分逆转DM大鼠小肠ICC、肠神经系统的异常改变, 对DM大鼠胃肠动力障碍有一定的改善作用. 本研究提示沉香化气胶囊可能为临床治疗DM胃肠动力障碍提供新的理论依据, 其具体机制有待于进一步研究.
胃肠动力障碍是糖尿病(DM)常见的慢性并发症之一, 深入研究胃肠动力障碍的机制, 并针对此寻求有效的治疗措施成为当今研究的重点.
唐文富, 副教授, 四川大学华西医院中西医结合科
近些年, 糖尿病胃肠动力障碍的发病机制及其有效的治疗措施成为研究的热点.
Ördög等研究发现胃肠动力障碍与ICC、肠神经系统有关; 厉兰娜等研究发现沉香化气胶囊对胃肠动力改善有一定的作用.
本研究可为临床治疗糖尿病胃肠动力障碍提供新的理论依据.
本研究对揭示糖尿病并发胃肠动力障碍的中药治疗机制提供了一定的研究价值和临床意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Ordög T, Hayashi Y, Gibbons SJ. Cellular pathogenesis of diabetic gastroenteropathy. Minerva Gastroenterol Dietol. 2009;55:315-343. [PubMed] |
| 2. | Donnell AM, Doi T, Hollwarth M, Kalicinski P, Czauderna P, Puri P. Deficient alpha-smooth muscle actin as a cause of functional intestinal obstruction in childhood. Pediatr Surg Int. 2008;24:1191-1195. [PubMed] [DOI] |
| 4. | 厉 兰娜, 戴 蕾, 朱 惠芳, 余 永红, 江 汉才, 李 玉芳, 林 家乐, 陈 炜. 沉香化气胶囊治疗功能性消化不良的临床研究-附40例临床疗效观察. 浙江中医杂志. 2002;37:454-455. |
| 12. | Jung HK, Kim DY, Moon IH, Hong YS. Colonic transit time in diabetic patients--comparison with healthy subjects and the effect of autonomic neuropathy. Yonsei Med J. 2003;44:265-272. [PubMed] |
| 16. | Huizinga JD, Zarate N, Farrugia G. Physiology, injury, and recovery of interstitial cells of Cajal: basic and clinical science. Gastroenterology. 2009;137:1548-1556. [PubMed] [DOI] |
| 17. | Sanders KM, Ward SM. Interstitial cells of Cajal: a new perspective on smooth muscle function. J Physiol. 2006;576:721-726. [PubMed] [DOI] |
| 18. | Geramizadeh B, Hayati K, Rahsaz M, Hosseini SV. Assessing the interstitial cells of Cajal, cells of enteric nervous system and neurotransmitters in slow transit constipation, using immunohistochemistry for CD117, PGP9.5 and serotonin. Hepatogastroenterology. 2009;56:1670-1674. [PubMed] |
| 19. | Cai ZX, Li Y, Qi QH. Morphological changes in interstitial cells of Cajal in the deep muscular plexus and enteric motor neurons of the intestine in rats with multiple organ dysfunction syndrome. Neural Regen Res. 2010;5:635-640. [PubMed] |
| 20. | 杨 琰, 余 跃, 高 显奎, 陈 军, 王 巧民. 干细胞因子对糖尿病小鼠小肠Cajal间质细胞的影响. 胃肠病学和肝病学杂志. 2011;20:230-232. |
| 21. | 陈 军, 余 跃, 杨 琰, 高 显奎, 王 巧民. 突触在胃起搏调控胃慢波活动中的作用. 胃肠病学和肝病学杂志. 2011;20:633-636. |
| 23. | Li C, Liu S, Guan Y, Qian W, du F, Hou X. Long pulse gastric electrical stimulation induces regeneration of myenteric plexus synaptic vesicles in diabetic rats. Neurogastroenterol Motil. 2010;22:453-461, e108. [PubMed] |
| 24. | Günlemez A, Babaoğlu A, Arisoy AE, Türker G, Gökalp AS. Effect of domperidone on the QTc interval in premature infants. J Perinatol. 2010;30:50-53. [PubMed] [DOI] |