修回日期: 2012-05-15
接受日期: 2012-05-18
在线出版日期: 2012-07-18
目的: 探讨平滑肌特异性过表达过氧化物酶增殖体激活受体γ辅助激活因子1α(SMC- PGC-1α)对葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的小鼠急性结肠炎的影响.
方法: 按照SMC-PGC-1α转基因阴性/阳性(non-Tg/Tg)及诱导与否分为4组, 每组10-13只. 诱导组给予3%DSS自由饮用7 d诱导急性结肠炎, 对照组则给予正常饮用水. 通过疾病活动指数(disease activity index, DAI)评估及结肠组织病理学评分(histopathological score, HPS)来明确SMC-PGC-1α过表达对DSS诱导的小鼠急性结肠炎的影响, 并通过对结肠炎相关基因mRNA表达水平的检测来研究SMC-PGC-1α抗结肠炎的作用机制.
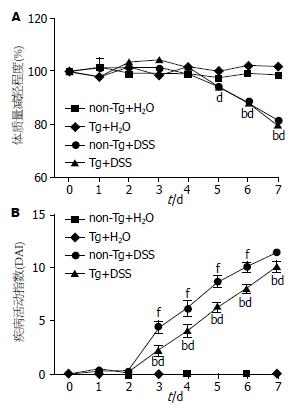
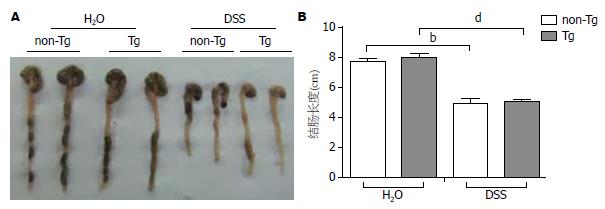
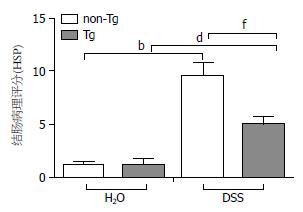
结果: 诱导组相较于对照组: (1)体质量减轻明显(P<0.01); (2)DAI明显升高(P<0.01); (3)结肠长度明显缩短(non-Tg组中5.0 cm+0.3 cm vs 7.8 cm+0.2 cm; Tg组中4.9 cm+0.1 cm vs 8.0 cm+0.3 cm, P<0.01); (4)HSP明显加重(non-Tg组中9.6+1.2 vs 1.2+0.4; Tg组中5.0+0.8 vs 1.2+0.6, P<0.01). 说明肠炎造模成功. 诱导组中, Tg组相较于non-Tg组: (1)DAI明显降低(P<0.01); (2)HPS明显减轻(5.0+0.8 vs 9.6+1.2, 5.0+0.8 vs 1.2+0.6, P<0.01); (3)TNFα基因表达水平降低(0.24+0.07 vs 0.45+0.10, P<0.05); (4)PPARγ基因表达水平增高(0.98+0.15 vs 0.41+0.07, P<0.05).
结论: SMC-PGC-1α过表达可能通过激活PPARγ, 降低炎症因子TNFα的表达, 从而在DSS诱导的急性结肠炎中对结肠起到保护作用.
引文著录: 刘一笑, 陈腾飞, 王梦雨, 崔鑫, 唐寅, 黄薇, 张玲, 刘占举, 刘国庆. 平滑肌特异性PGC-1α转基因小鼠抗急性结肠炎的效应及其机制. 世界华人消化杂志 2012; 20(20): 1824-1831
Revised: May 15, 2012
Accepted: May 18, 2012
Published online: July 18, 2012
AIM: To investigate the effect of smooth muscle-specific overexpression of peroxidase proliferator-activated receptor gamma coactivator-1α (PGC-1α) on dextran sulfate sodium (DSS)-induced acute colitis in mice.
METHODS: Two-month-old male mice were divided into four groups according to genotype (non-Tg/Tg) and treatment (H2O/DSS), 10-13 mice for each group. Mice were administered with 3% DSS in drinking water for 7 days (+DSS) to induce inflammatory bowel disease (IBD). Control groups were given normal drinking water (+H2O). At the end of the study, the symptoms and pathological changes were evaluated using disease activity index (DAI) and histopathological score (HPS) of acute colitis, respectively. The mRNA levels of inflammatory cytokines in the colon were determined.
RESULTS: Compared to control groups, DSS-treated groups had significantly decreased body weight (both P < 0.01), increased DAI (both P < 0.01) and HPS (9.6 ± 1.2 vs 1.2 ± 0.4; 5.0 ± 0.8 vs 1.2 ± 0.6, in non-Tg and Tg groups, respectively, both P < 0.01), and significantly shorter colon (5.0 cm ± 0.3 cm vs 7.8 cm ± 0.2 cm; 4.9 cm ± 0.1 cm vs 8.0 cm ± 0.3 cm, in non-Tg and Tg groups, respectively, both P < 0.01). Compared to the DSS-treated non-Tg group, the treated Tg group had significantly decreased DAI (P < 0.01), HPS (5.0 ± 0.8 vs 9.6 ± 1.2, P < 0.01) and tumor necrosis factor α (TNFα) mRNA level (0.24 ± 0.07 vs 0.45 ± 0.10, P < 0.05), and increased peroxidase proliferator-activated receptor γ (PPARγ) mRNA level (0.98 ± 0.15 vs 0.41 ± 0.07, P < 0.05).
CONCLUSION: Smooth muscle-specific overexpression of PGC-1α protects against DSS-induced acute colitis by reducing the expression of inflammatory factor TNFα, which might result from the activation of PPARγ.
- Citation: Liu YX, Chen TF, Wang MY, Cui X, Tang Y, Huang W, Zhang L, Liu ZJ, Liu G. Smooth muscle-specific overexpression of PGC-1α protects mice from acute colitis. Shijie Huaren Xiaohua Zazhi 2012; 20(20): 1824-1831
- URL: https://www.wjgnet.com/1009-3079/full/v20/i20/1824.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i20.1824
炎症性肠病(inflammatory bowel disease, IBD)是指病因未明的肠道炎症性疾病. 其发病机制尚未明确, 与环境、遗传、感染及免疫等因素相关. 临床表现以腹痛、血性腹泻及发热为主. 肠道组织病理改变以黏膜破坏、溃疡形成、组织增生、肠壁各层炎性细胞浸润等特征为主, 可累及肠壁全层, 常见于直肠和乙状结肠, 常并发梗阻、脓肿及瘘道形成、药物治疗效果差. 多数IBD患者病情反复, 迁延不愈. 因此, 明确IBD的发病机制, 寻找新的潜在基因治疗靶点, 对预防及治疗IBD具有重大理论及实际意义. 有研究发现人的结肠组织中有较高水平的过氧化物酶增殖体激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)表达[1], 在炎症通路中, PPARγ是具有抗炎作用的重要转录因子, 他从上游对炎症因子表达进行调控的作用得到广泛关注和研究. 已有不少研究结果表明给予PPARγ激动剂后有明显减轻IBD症状及降低炎症因子表达的作用[2,3], 提示PPARγ可能成为IBD的潜在治疗靶点[4]. 在一项关于共轭亚油酸对IBD起保护作用的研究中, 发现伴随PPARγ的激活, 过氧化物酶增殖体激活受体γ辅助激活因子1α(PGC-1α)的表达水平也明显升高[5]. 另一项研究表明肠上皮细胞中PGC-1α也有丰富的表达, 并能通过独立途径调节活性氧水平从而调节线粒体介导的肠上皮细胞凋亡, 对肠道起到保护作用[6]. 以上结果均提示PGC-1α可能起到抗IBD的重要作用. 结肠组织中有丰富的平滑肌组织, 人结肠分离的环状平滑肌细胞能够合成及分泌多种炎症因子[7]参与肠道炎症反应. 因此, 我们通过应用平滑肌特异性基因SM22α的启动子, 介导PGC-1α在平滑肌细胞的表达, 成功获得了在胃肠道高表达的PGC-1α的小鼠模型(SMC-PGC-1α). 进而给予葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导急性结肠炎, 通过疾病活动指数(disease activity index, DAI)评估及结肠组织病理学评分(histopathological score, HPS)来明确SMC-PGC-1α过表达对DSS诱导的小鼠急性结肠炎的影响, 并通过检测结肠组织中结肠炎相关基因mRNA表达水平来评价SMC-PGC-1α抗IBD的作用机制.
健康SPF级C57BL/6J♂小鼠48只, 其中SMC-PGC-1α转基因小鼠(Tg)26只, 同窝阴性对照小鼠22(non-Tg)只, 8周龄, 体质量20-25 g. 葡聚糖硫酸钠(DSS, 36 000-50 000 kDa, 美国MP Biochemicals公司); TRIzol Reagent(美国Invitrogen公司); RNA Transcript Kit(MML-V, 美国Promega公司); 100 bp DNA ladder(美国Promega公司); Real-time PCR Kit(日本TaKaRa公司); 蛋白酶抑制剂(cocktail, 德国Roche公司); 兔抗鼠PGC-1α多克隆抗体(美国Santa Cruz公司); HRP标记的羊抗兔二抗(中国中杉金桥生物技术有限公司); 发光液(美国Cell Signaling Technology公司). Leica显微注射操作系统; Eppendoff离心机; Bio-Rad普通PCR仪; M-G research real time PCR仪; Olympus光学显微镜.
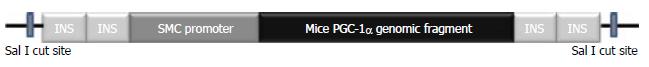
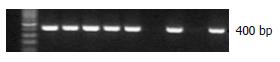
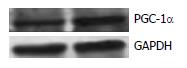
1.2.1 转基因小鼠模型的构建及鉴定: 构建带有平滑肌SMC启动子的小鼠PGC-1α表达载体, 将其线性化后(图1)通过显微注射法注入受精卵雄原核区, 目的基因随受精卵有丝分裂随机整合到基因组, 将接受注射的受精卵通过输卵管回输至假孕雌鼠, 出生的F0代小鼠通过PCR进行基因型鉴定, 阳性小鼠再与野生型C57BL/6J小鼠杂交繁育出F1代, 繁殖至F6代, 遗传背景稳定时我们对结肠组织进行PGC-1α基因及蛋白的检测, 明确PGC-1α在结肠平滑肌中的表达水平. 取材时留取结肠组织两份进行液氮冻存, 其中一份加TRIzol匀浆后进行总RNA的提取, 反转录获得cDNA后用于PGC-1α基因水平检测; 另一份组织用添加蛋白酶抑制剂的RIPA裂解液匀浆后进行组织总蛋白的提取, 通过Western blot进行PGC-1α蛋白检测. F7-F8代用于本次实验.
1.2.2 分组及模型的建立: 实验动物分为4组-DSS诱导肠炎Tg及non-Tg组, 非诱导Tg及non-Tg组(n = 11-13). DSS诱导肠炎组小鼠给予3%DSS自由饮用7 d诱导急性结肠炎, 非诱导组给予正常饮用水. 每天监测体质量、粪便性状及潜血, 于第7天动物取材. 对每只小鼠结肠进行长度测量后, 留取结肠组织两份: 一份甲醛固定后常规石蜡包埋, 切片后进行苏木精-伊红染色(Hematoxylin-eosin staining, HE)染色; 另一份液氮冻存, 用于RNA提取.
1.2.3 DAI的测定: 肠炎DAI由3部分组成, 各分为5个等级, 对应0-4分-体质量的减轻程度(无、1%-5%、6%-10%、11%-20%、>20%)、大便性状(正常、疏松、稀便、介于稀便与腹泻之间、腹泻)及血便(无血、轻度血便、明显血便、介于明显血便与便血之间、便血), 3部分所得总分即为DAI[8].
1.2.4 结肠长度的测量: 结肠长度变短是结肠损伤的一个指标, 取材时留取肛门以上至回盲部的肠段用于长度测量.
1.2.5 HPS的评定: 将小鼠结肠组织进行石蜡包埋切片, HE染色后镜下观察, IBD病理改变主要有炎症细胞浸润、溃疡形成、隐窝破坏、肠壁水肿及肠壁肌层的增生等. 病理评分按照炎症程度(无、轻度及重度对应0-2分), 病变深度(无、病变达黏膜下层、达肌层、达浆膜层对应0-3分), 隐窝破坏程度(无、基底1/3隐窝被破坏、基底2/3隐窝被破坏、仅有完整表面上皮、全部隐窝和上皮被破坏对应0-4分)及病变范围(1%-25%、26%-50%、51%-75%、76%-100%对应0-3分)4项进行, 各项得分的总和即为病理评分[9].
1.2.6 结肠相关基因表达水平检测: 提取总RNA, 反转录为cDNA后, Real-time PCR检测基因表达水平, GAPDH为内参. 引物均由北京奥科鼎盛生物科技有限公司合成, 引物序列见表1. PCR反应条件: 94 ℃预变性10 min; 94 ℃变性15 s, 58 ℃退火30 s, 72 ℃延伸10 s, 40个扩增循环; 72 ℃ 10 min. 反应结束后由Real-time PCR仪根据反应过程中产生的荧光信号进行数据处理得出Ct值[10]. 结果表示为目的基因与内参GAPDH的mRNA表达量的比值.
| 引物名称 | 引物序列1 扩增大小(bp) | |
| TNFα | F: 5'-CTGTGAAGGGAATGGGTGTT-3' | 384 |
| R: 5'-CAGGGAAGAATCTGGAAAGGTC-3' | ||
| IL-10 | F: 5'-ACCTGGTAGAAGTGATGC-3' | 366 |
| R: 5'-AAGGAGTTGTTTCCGTTA-3' | ||
| TGFβ | F: 5'-GGCGGTGCTCGCTTTGTA-3' | 201 |
| R: 5'-TCCCGAATGTCTGACGTATTGA-3' | ||
| 1PGC-1α | F: 5'-CAGATGGAGCCGTGAC-3' | 400 |
| R: 5'-TGCGACTGCGGTTGT-3' | ||
| 2PGC-1α-m | F: 5'-CACAAACGATGACCCTC-3' | 107 |
| R: 5'-GCATGTTGCGACTGC-3' | ||
| PPARγ | F: 5'-GACCACTCGCATTCCTTT-3' | 266 |
| R: 5'-CCACAGACTCGGCACTCA-3' | ||
| GAPDH | F: 5'-TGATGACATCAAGAAGGTGGTGAAG-3' | 240 |
| R: 5'-TCCTTGGAGGCCATGTAGGCCAT-3' | ||
统计学处理 应用SPSS17.0统计软件进行统计学处理, 数据用mean+SE表示. 数据分析采用因素方差分析(Anova)联合Fisher精确检验(Fisher's exact test); 非参数检验则用Wilcoxon秩和检验(Mann-Whitney). P<0.05则表示有统计学差异.
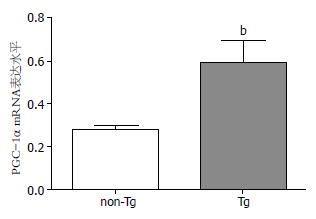
成功构建SMC-PGC-1α转基因小鼠. 基因型鉴定结果, 有400 bp条带者为Tg, 无条带者为non-Tg. Tg组结肠PGC-1α mRNA水平较non-Tg组明显增高, 约为non-Tg组的2倍(0.59+0.10 vs 0.27+0.02, P<0.01); Tg组蛋白表达水平也较non-Tg组明显增高. 结果表明, SMC-PGC-1α转基因小鼠构建成功并且结肠平滑肌高表达PGC-1α(图1-4).
实验过程中, 非诱导组小鼠体质量稳定, 诱导组体质量明显减轻, 最严重的可降低为非诱导组的30%左右. 诱导组中, Tg组及non-Tg组体质量减轻程度并无明显差异(图5A). 非诱导组小鼠DAI一直处于基线水平, 相比之下, 诱导组DAI自第3天起则明显增高(图5B, P<0.01). 取材时可见诱导组小鼠小肠、盲肠、结肠肠腔内有积血、结肠及直肠肠腔内有不成形稀便, 部分小鼠有血便(图6A), 诱导组结肠长度相对于非诱导组减少3 cm以上. 诱导组中, non-Tg组与Tg组间无明显区别(图6B, non-Tg诱导组 vs 非诱导组为5.0 cm+0.3 cm vs 7.8 cm+0.2 cm, Tg诱导组 vs 非诱导组为4.9 cm+0.1 cm vs 8.0 cm+0.3 cm, P<0.01). 以上结果说明肠炎造模成功. 诱导组中, 相对于non-Tg组, Tg组DAI从第3天起明显降低(P<0.01), 说明SMC-PGC-1α有明显抗IBD的作用.
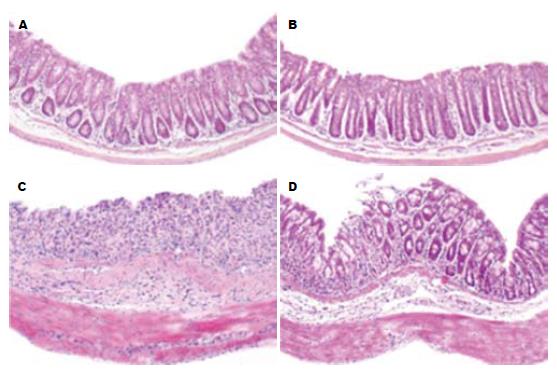
相对于non-Tg组, Tg组结肠黏膜破坏、肠壁水肿及炎性细胞浸润程度明显减轻(图7). HSP可见诱导组明显较非诱导组高(图8, non-Tg诱导组 vs 非诱导组为9.6+1.2 vs 1.2+0.4, P<0.01; Tg诱导组 vs 非诱导组为5.0+0.8 vs 1.2+0.6, P<0.01). 诱导组中, Tg组HSP明显较non-Tg组低(图8, 5.0+0.8 vs 9.6+1.2, P<0.01). 结果表明, SMC-PGC-1α在DSS诱导的结肠炎中对结肠组织有明显保护作用.
我们应用SM22α的启动子驱动PGC-1α在平滑肌细胞表达, 成功建立了在胃肠道高表达PGC-1α的小鼠模型. 该小鼠模型呈现明显对抗DSS诱导的IBD的表型. 结肠组织中PPARγ基因表达上调而TNFα表达下降, 从而抑制炎症进展, 为该小鼠模型抗IBD的可能机制.
近年来对于PGC-1α的研究主要集中在肝脏、心肌、骨骼肌的线粒体功能、能量代谢及骨骼肌纤维表型转换等方面. PGC-1α全身敲除小鼠表现出多系统的能量代谢紊乱, 导致适应性产热障碍、肥胖、脂肪肝、Ⅰ型骨骼肌纤维表型消失及运动能力降低、心功能下降. 其中, 心肌细胞线粒体电子传递相关基因表达水平下降且线粒体有氧呼吸的第3阶段消失; 骨骼肌细胞线粒体表型异常[11-14]. 肝脏特异性PGC-1α敲除小鼠表现出高甘油三酯血症、糖异生障碍以及胰岛素信号通路的异常[15]; 骨骼肌特异性PGC-1α敲除小鼠表现出运动能力下降、肌纤维损伤以及运动后血浆中炎症标志物TNFα水平升高[16]. 而骨骼肌特异性PGC-1α转基因小鼠, Ⅱ型骨骼肌纤维会向Ⅰ型骨骼肌纤维表型转化[17]. 在心肌过表达PGC-1α则会引起与心肌能量需求不匹配的线粒体生物合成, 氧气过度消耗, 最终导致心脏结构异常及心功能减退[18,19].
我们建立的平滑肌特异性PGC-1α转基因小鼠-SMC-PGC-1α小鼠在自然生长状态下无明显异常表型. 有鉴于IBD可能与平滑肌的炎症相关, 我们通过诱导转基因小鼠的IBD, 来观察平滑肌特异性PGC-1α表达对结肠炎的可能影响. 在诱导结肠炎过程中, 诱导组较非诱导组体质量减轻明显. 但在诱导组中, Tg与non-Tg组体质量减轻程度无明显差异; 而DAI则明显降低, 说明SMC-PGC-1α小鼠对IBD有一定耐受的能力. 与此相一致, 结肠的病理评分显示, SMC-PGC-1α能减轻结肠组织黏膜破坏、肠壁水肿及炎性细胞浸润.
有研究表明PGC-1α作为PPARγ的辅助激活因子, 其过表达能激活PPARγ[20], 而PPARγ的激活能够抑制TNFα或促进IL-10的基因表达[21,22]. 诸多临床研究报道TNFα在IBD患者血浆及肠道局部活检组织表达上调, 并能造成肠上皮屏障功能障碍[23,24]. 动物实验结果则表明通过抗体中和TNFα或者药物抑制TNFα水平升高能够明显减轻小鼠实验性结肠炎的症状及结肠病变[25,26]. IL-10在结肠炎的发病过程中则作为重要的保护性细胞因子参与其进展[27,28]. 我们的结果表明, 在结肠组织中, Tg诱导组较non-Tg组PPARγ的表达增加约2.5倍, TNFα下降60%, IL-10也有增高趋势, 显示SMC-PGC-1α过表达抗IBD的作用主要是通过激活PPARγ, 下调TNFα的表达, 从而抑制炎症的进展.
本研究明确了SMC-PGC-1α在IBD中对结肠组织的保护作用, 并初步明确了其可能机制, 为寻找IBD潜在基因治疗靶点提供了研究基础. 而作为线粒体生物合成功能的重要调节基因, PGC-1α的表达水平会影响线粒体的生物合成及呼吸链电子传递的完整性, 最终对于活性氧的生成产生影响[29,30]. 因此, 我们需要进一步对结肠平滑肌细胞的线粒体功能、局部活性氧(ROS)生成进行评估并对结肠组织氧化相关基因进行检测, 以研究PGC-1α转基因对平滑肌线粒体功能以及对结肠局部组织氧化/抗氧化系统平衡的影响, 从而对SMC-PGC-1α抗IBD的机制进行比较全面的解释.
炎症性肠病(IBD)与环境、遗传、感染及免疫等因素相关. 多数IBD患者病情反复, 迁延不愈. 因此, 明确IBD的发病机制, 寻找新的潜在基因治疗靶点, 对预防及治疗IBD具有重大理论及实际意义.
姜慧卿, 教授, 河北医科大学第二医院消化科
在炎症通路中, PPARγ是具有抗炎作用的重要转录因子, 他从上游对炎症因子表达进行调控的作用得到广泛关注和研究.
有研究表明PGC-1α作为PPARγ的辅助激活因子, 其过表达能激活PPARγ, 而PPARγ的激活能够抑制TNFα或促进IL-10的基因表达.
本文应用SM22α的启动子驱动PGC-1α在平滑肌细胞表达, 成功建立了在胃肠道高表达PGC-1α的小鼠模型.
本研究方法可靠, 结果可信, 具有一定的研究价值.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Fajas L, Auboeuf D, Raspé E, Schoonjans K, Lefebvre AM, Saladin R, Najib J, Laville M, Fruchart JC, Deeb S. The organization, promoter analysis, and expression of the human PPARgamma gene. J Biol Chem. 1997;272:18779-18789. [PubMed] [DOI] |
| 2. | Desreumaux P, Dubuquoy L, Nutten S, Peuchmaur M, Englaro W, Schoonjans K, Derijard B, Desvergne B, Wahli W, Chambon P. Attenuation of colon inflammation through activators of the retinoid X receptor (RXR)/peroxisome proliferator-activated receptor gamma (PPARgamma) heterodimer. A basis for new therapeutic strategies. J Exp Med. 2001;193:827-838. [PubMed] [DOI] |
| 3. | Ramakers JD, Verstege MI, Thuijls G, Te Velde AA, Mensink RP, Plat J. The PPARgamma agonist rosiglitazone impairs colonic inflammation in mice with experimental colitis. J Clin Immunol. 2007;27:275-283. [PubMed] [DOI] |
| 4. | Dubuquoy L, Rousseaux C, Thuru X, Peyrin-Biroulet L, Romano O, Chavatte P, Chamaillard M, Desreumaux P. PPARgamma as a new therapeutic target in inflammatory bowel diseases. Gut. 2006;55:1341-1349. [PubMed] [DOI] |
| 5. | Bassaganya-Riera J, Reynolds K, Martino-Catt S, Cui Y, Hennighausen L, Gonzalez F, Rohrer J, Benninghoff AU, Hontecillas R. Activation of PPAR gamma and delta by conjugated linoleic acid mediates protection from experimental inflammatory bowel disease. Gastroenterology. 2004;127:777-791. [PubMed] [DOI] |
| 6. | D'Errico I, Salvatore L, Murzilli S, Lo Sasso G, Latorre D, Martelli N, Egorova AV, Polishuck R, Madeyski-Bengtson K, Lelliott C. Peroxisome proliferator-activated receptor-gamma coactivator 1-alpha (PGC1alpha) is a metabolic regulator of intestinal epithelial cell fate. Proc Natl Acad Sci U S A. 2011;108:6603-6608. [PubMed] [DOI] |
| 7. | Salinthone S, Singer CA, Gerthoffer WT. Inflammatory gene expression by human colonic smooth muscle cells. Am J Physiol Gastrointest Liver Physiol. 2004;287:G627-G637. [PubMed] [DOI] |
| 8. | Mchenga SS, Wang D, Janneh FM, Feng Y, Zhang P, Li Z, Lu C. Differential dose effects of recombinant IL-25 on the development of dextran sulfate sodium-induced colitis. Inflamm Res. 2010;59:879-887. [PubMed] [DOI] |
| 9. | Dieleman LA, Palmen MJ, Akol H, Bloemena E, Peña AS, Meuwissen SG, Van Rees EP. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clin Exp Immunol. 1998;114:385-391. [PubMed] [DOI] |
| 10. | Fink L, Seeger W, Ermert L, Hänze J, Stahl U, Grimminger F, Kummer W, Bohle RM. Real-time quantitative RT-PCR after laser-assisted cell picking. Nat Med. 1998;4:1329-1333. [PubMed] [DOI] |
| 11. | Lin J, Wu PH, Tarr PT, Lindenberg KS, St-Pierre J, Zhang CY, Mootha VK, Jäger S, Vianna CR, Reznick RM. Defects in adaptive energy metabolism with CNS-linked hyperactivity in PGC-1alpha null mice. Cell. 2004;119:121-135. [PubMed] [DOI] |
| 12. | Leone TC, Lehman JJ, Finck BN, Schaeffer PJ, Wende AR, Boudina S, Courtois M, Wozniak DF, Sambandam N, Bernal-Mizrachi C. PGC-1alpha deficiency causes multi-system energy metabolic derangements: muscle dysfunction, abnormal weight control and hepatic steatosis. PLoS Biol. 2005;3:e101. [PubMed] [DOI] |
| 13. | Arany Z, Novikov M, Chin S, Ma Y, Rosenzweig A, Spiegelman BM. Transverse aortic constriction leads to accelerated heart failure in mice lacking PPAR-gamma coactivator 1alpha. Proc Natl Acad Sci U S A. 2006;103:10086-10091. [PubMed] [DOI] |
| 14. | Arany Z, He H, Lin J, Hoyer K, Handschin C, Toka O, Ahmad F, Matsui T, Chin S, Wu PH. Transcriptional coactivator PGC-1 alpha controls the energy state and contractile function of cardiac muscle. Cell Metab. 2005;1:259-271. [PubMed] [DOI] |
| 15. | Estall JL, Kahn M, Cooper MP, Fisher FM, Wu MK, Laznik D, Qu L, Cohen DE, Shulman GI, Spiegelman BM. Sensitivity of lipid metabolism and insulin signaling to genetic alterations in hepatic peroxisome proliferator-activated receptor-gamma coactivator-1alpha expression. Diabetes. 2009;58:1499-1508. [PubMed] [DOI] |
| 16. | Handschin C, Chin S, Li P, Liu F, Maratos-Flier E, Lebrasseur NK, Yan Z, Spiegelman BM. Skeletal muscle fiber-type switching, exercise intolerance, and myopathy in PGC-1alpha muscle-specific knock-out animals. J Biol Chem. 2007;282:30014-30021. [PubMed] [DOI] |
| 17. | Lin J, Wu H, Tarr PT, Zhang CY, Wu Z, Boss O, Michael LF, Puigserver P, Isotani E, Olson EN. Transcriptional co-activator PGC-1 alpha drives the formation of slow-twitch muscle fibres. Nature. 2002;418:797-801. [PubMed] [DOI] |
| 18. | Wu Z, Puigserver P, Andersson U, Zhang C, Adelmant G, Mootha V, Troy A, Cinti S, Lowell B, Scarpulla RC. Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1. Cell. 1999;98:115-124. [PubMed] [DOI] |
| 19. | Lehman JJ, Barger PM, Kovacs A, Saffitz JE, Medeiros DM, Kelly DP. Peroxisome proliferator-activated receptor gamma coactivator-1 promotes cardiac mitochondrial biogenesis. J Clin Invest. 2000;106:847-856. [PubMed] [DOI] |
| 20. | Puigserver P, Wu Z, Park CW, Graves R, Wright M, Spiegelman BM. A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis. Cell. 1998;92:829-839. [PubMed] [DOI] |
| 21. | Su CG, Wen X, Bailey ST, Jiang W, Rangwala SM, Keilbaugh SA, Flanigan A, Murthy S, Lazar MA, Wu GD. A novel therapy for colitis utilizing PPAR-gamma ligands to inhibit the epithelial inflammatory response. J Clin Invest. 1999;104:383-389. [PubMed] [DOI] |
| 22. | Celinski K, Dworzanski T, Korolczuk A, Piasecki R, Slomka M, Madro A, Fornal R. Effects of peroxisome proliferator-activated receptors-gamma ligands on dextran sodium sulphate-induced colitis in rats. J Physiol Pharmacol. 2011;62:347-356. [PubMed] |
| 23. | Murch SH, Lamkin VA, Savage MO, Walker-Smith JA, MacDonald TT. Serum concentrations of tumour necrosis factor alpha in childhood chronic inflammatory bowel disease. Gut. 1991;32:913-917. [PubMed] [DOI] |
| 24. | Murch SH, Braegger CP, Walker-Smith JA, MacDonald TT. Location of tumour necrosis factor alpha by immunohistochemistry in chronic inflammatory bowel disease. Gut. 1993;34:1705-1709. [PubMed] [DOI] |
| 25. | Kojouharoff G, Hans W, Obermeier F, Männel DN, Andus T, Schölmerich J, Gross V, Falk W. Neutralization of tumour necrosis factor (TNF) but not of IL-1 reduces inflammation in chronic dextran sulphate sodium-induced colitis in mice. Clin Exp Immunol. 1997;107:353-35. [PubMed] [DOI] |
| 26. | Myers KJ, Murthy S, Flanigan A, Witchell DR, Butler M, Murray S, Siwkowski A, Goodfellow D, Madsen K, Baker B. Antisense oligonucleotide blockade of tumor necrosis factor-alpha in two murine models of colitis. J Pharmacol Exp Ther. 2003;304:411-424. [PubMed] [DOI] |
| 27. | Lindsay JO, Hodgson HJ. Review article: the immunoregulatory cytokine interleukin-10--a therapy for Crohn's disease? Aliment Pharmacol Ther. 2001;15:1709-1716. [PubMed] [DOI] |
| 28. | Larmonier CB, Uno JK, Lee KM, Karrasch T, Laubitz D, Thurston R, Midura-Kiela MT, Ghishan FK, Sartor RB, Jobin C. Limited effects of dietary curcumin on Th-1 driven colitis in IL-10 deficient mice suggest an IL-10-dependent mechanism of protection. Am J Physiol Gastrointest Liver Physiol. 2008;295:G1079-G1091. [PubMed] [DOI] |
| 29. | St-Pierre J, Drori S, Uldry M, Silvaggi JM, Rhee J, Jäger S, Handschin C, Zheng K, Lin J, Yang W. Suppression of reactive oxygen species and neurodegeneration by the PGC-1 transcriptional coactivators. Cell. 2006;127:397-408. [PubMed] [DOI] |
| 30. | Puigserver P, Spiegelman BM. Peroxisome proliferator-activated receptor-gamma coactivator 1 alpha (PGC-1 alpha): transcriptional coactivator and metabolic regulator. Endocr Rev. 2003;24:78-90. [PubMed] [DOI] |