修回日期: 2011-10-22
接受日期: 2011-12-23
在线出版日期: 2012-01-18
目的: 探讨MRP基因、LRP基因和MDR1基因在胃癌中的表达及其与疾病发生发展相关性的研究.
方法: 应用实时荧光定量PCR(real-time fluorescence quantitative PCR, FQ-PCR)分别检测47例胃癌标本和17例正常胃组织对照标本的MRP基因、LRP基因和MDR1基因表达, 分析其与病情发生发展以及转归的关系 .
结果: MRP基因、LRP基因和MDR1基因在胃癌组织中的表达均高于正常标本, MRP在早期胃癌中显著高于进展期胃癌(P<0.05), 高、中分化腺癌显著高于低、未分化腺癌(P<0.05); LRP基因表达无淋巴结转移组显著高于淋巴结转移组(P<0.05). MRP在病情恶化患者中上调30%.
结论: MRP基因、LRP基因和MDR1在胃癌组织中均有较高的表达, 三者可能具有协同作用, 检测3种基因的表达有利于制定更合理的治疗方案.
引文著录: 靳胜. MRP、LRP和MDR1基因在胃癌中的表达及其意义. 世界华人消化杂志 2012; 20(2): 160-163
Revised: October 22, 2011
Accepted: December 23, 2011
Published online: January 18, 2012
AIM: To investigate the expression of the MRP, MDR1 and LRP genes in gastric cancer and to analyze their clinical significance.
METHODS: The mRNA expression of the MRP, MDR1 and LRP genes in 47 gastric cancer specimens and 17 normal gastric mucosal specimens was detected by real-time fluorescence quantitative PCR (FQ-PCR).
RESULTS: The expression of the MRP, MDR1 and LRP genes was significantly higher in gastric cancer than in normal gastric mucosal tissue. Positive expression of the MRP gene was correlated with tumor differentiation and stage, while LRP expression was correlated with lymph nodes metastasis. The expression level of the MRP gene increased by 30% in patients with progressing disease.
CONCLUSION: The expression of MRP, LRP and MDR1 genes was significantly higher in gastric cancer than in normal gastric tissue and may be associated with multi-drug resistance in gastric cancer.
- Citation: Jin S. Clinical significance of expression of MRP, MDR1 and LRP in gastric cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(2): 160-163
- URL: https://www.wjgnet.com/1009-3079/full/v20/i2/160.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i2.160
肿瘤的多药耐药(multi-drug resistance, MDR)是指肿瘤细胞对分子结构不同、作用机制各异的抗肿瘤药物产生交叉耐药, 是目前所知的肿瘤化疗失败的最重要的原因. 目前研究证实多数肿瘤多药耐药的发生是通过MDR1基因和多药耐药相关蛋白(multi-drug resistance-associated protein, MRP)基因以及肺耐药蛋白基因(lung resistance protein, LRP)编码的相应蛋白, 通过药泵作用将药物排出肿瘤细胞外或者改变药物在细胞内分布而导致耐药[1,2]. 这3个耐药基因是目前研究证实最重要的肿瘤耐药机制, 本文通过检测胃癌MDR1、MRP和LRP基因的定量表达, 探讨其与胃癌临床病理特征及预后的关系, 评价其在患者病程发展监控中的意义,以制定更为合理的治疗方案.
选择诊断明确、病历资料完整、未经任何治疗的患者手术切除胃癌标本共47例. 其中有淋巴结转移的15例, 男性29例, 女性18例, 年龄35-74岁, 中位年龄61岁. 对照组17例, 均为胃及十二指肠溃疡行胃大部切除术患者. 提取试剂盒(QIAGEN公司), 组织RNA提取试剂盒(Bioteke公司); cDNA逆转录试剂盒(Promega公司); 扩增体系PCR Mix购于TIANGEN公司; 引物、探针由华美公司合成; 所用定量PCR仪为罗氏公司的Light Cycle及其配套的分析软件系统.
1.2.1 RNA提取: 收集手术所取肿瘤组织, 液氮研磨、匀浆器匀浆, 再按RNA提取试剂盒(RNA pure高纯总RNA快速提取试剂盒)的说明提取组织中的总RNA. 通过测定吸光度A260计算RNA的浓度, 以A260/280判定纯度, 1%琼脂糖凝胶电泳检测其完整性.
1.2.2 合成cDNA: 总RNA在70 ℃中孵育10 min. 按逆转录cDNA试剂盒(Promega公司)的说明进行cDNA的合成, -20 ℃保存.
1.2.3 PCR反应: 设计合成引物探针(表1), 依据试剂盒上的说明进行PCR扩增. 具体为: 2× Realtime PCR MasterMix 8 mL, Enhancer 1 mL, ddH2O 8 mL, 上、下游引物(20 mmol/L)各1 mL, 探针(20 mmol/L) 0.5 mL, cDNA 1 mL, 同时将定量模板稀释做标准曲线. 首先在95 ℃水平起始模板变性5 min, 然后按以下反应条件完成40个循环: 95 ℃ 15 s, 58 ℃ 40 s. 在每1批PCR反应中设立水模板作为阴性对照. 检测系统自带的软件可以计算Ct(threshold cycle)值, 根据所获得的标准曲线, 得到各标本的起始浓度(基因拷贝数/mL).
| 检测基因 | 上、下游引物 | 探针 |
| MDR1 | 5'-GCTGGTTTGATGTGCACGATGTTGG-3' | 5'-ATTTTGTCACCAATTCCTTCATTAA-3' |
| CTTAACACCCGACTTACAGATGATGTCTCCA | ||
| MRP | 5'-TGTGCCCTCCTCCCAGACCT-3' | 5'-CAGACAGGTTCACGCCCT-3' |
| CCCAGTGGGGATCGGACAGAG | ||
| LRP | 5'-GGGCTTGGTGCTGTTTGATG-3' | 5'-AGCCGGATCTCGAGGTCAGCG-3' |
| CAGGGCAAGTTCGGCTTCGCC |
1.2.4 PCR产物处理: 将扩增完毕的PCR产物进行2%琼脂糖电泳, 并进行切胶回收. 紫外分光和电泳定量后, 根据公式: 标准品浓度(拷贝/mL) = 6.02×1023×C×A260/MWt, 其中C = 5×10-5/mL, MWt = PCR产物的相对分子质量(碱基数×6.58 ×102 ), A260是在260 nm的吸光度值, 将标准品稀释到1012拷贝/mL, -80 ℃保存.
统计学处理 应用SPSS11.0统计软件进行t检验、方差分析及两变量相关性分析.
PCR反应的前15个循环的荧光信号作为荧光本底信号, Ct值是每个反应管内的荧光信号到达设定的域值时所经历的循环数. 横坐标代表起始拷贝数的对数, 纵坐标代表Ct值, 只要获得未品的Ct值, 即可从标准曲线上计算出该样品的起始拷贝数. 以Ct值作为纵坐标, MDR1、MRP1、LRP起始拷贝数作为横坐标, 建立标准曲线, 此曲线显示4个数量级的动态范围. 荧光定量PCR的扩增过程包括3 个阶段: 基线期(baseline phase)、对数期(exponential phase)及平台期(plateau phase), 检测发生在对数期.
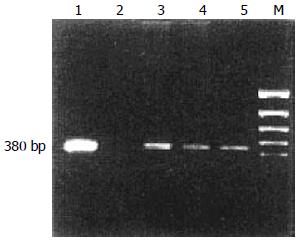
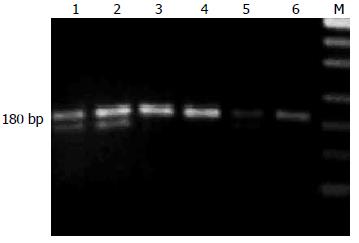
通过检测3种基因表达, 胃癌组与正常对照组相比均有明显差异(图1, 2, 表2).
在上述基础上我们通过对不同病理分型的标本进行拷贝表达分析, 发现MDR1基因的定量表达与组织学类型、浸润深度、淋巴结转移与否均无明显相关性. MRP基因在早期胃癌中显著高于进展期胃癌(P<0.05), 高、中分化腺癌显著高于低、未分化腺癌(P<0.05); 而LRP基因在无淋巴结转移组胃癌组中显著高于淋巴结转移组(P<0.05, 表3).
| 临床病理特征 | n | MRP | MDR1 | LRP |
| 病理分期: 早期 | 9 | 2.8×105 | 3.0×104 | 2.4×104 |
| 进展期 | 38 | 1.5.×105a | 2.6×104 | 2.3×104 |
| 淋巴转移: 无 | 32 | 1.8×105 | 2.9×104 | 2.7×104 |
| 转移 | 15 | 1.5×105 | 2.3×104 | 1.4×104e |
| 分化: 高和中分化 | 17 | 2.4×105 | 3.0×104 | 2.5×104 |
| 未和低分化 | 30 | 1.3×105c | 2.5×104 | 2.2×104 |
在47份病例中, 11例在1年中出现复发转移或者其他恶化状况, 对其单独分组与其他36份病例的定量结果进行分析, 发现MDR1和LRP基因表达无显著性差异; MRP基因表达亦无显著性差异, 但表达量上调达35%.
MDR是肿瘤进行有效化疗的主要障碍[4], 目前认为肿瘤出现耐药与多种耐药基因的过度表达有关, 比较肯定的有MDR1、MRP1、LRP等[5,6], 其中MDR1的过度表达被认为是肿瘤多药耐药的最重要机制[7,8]. MDR1是具有能量依赖性药泵功能的跨膜糖蛋白, 可主动将进入细胞内的抗癌药物泵出细胞外, 降低细胞内药物的浓度, 产生耐药[9]. MRP基因编码表达ATP能量依赖性跨膜糖蛋白泵分子Pgp-190, 该蛋白将疏水性化疗药物逆浓度差泵出细胞外, 减少细胞内药物蓄积, 导致耐药发生. LRP为人的弯隆体主蛋白(MVP), 通过调节囊泡和核质的药物转运, 将化疗药物储存于囊泡并减少其在核与胞质间的比例而致耐药; 就目前研究而言, 这3个机制构成了临床耐药的主要原因: 药泵的作用.
研究认为在胃癌的多药耐药中, MRP较MDR1占有更为重要的作用[5,10], 我们的研究证实MRP基因表达量与胃癌的发生发展以及预后状况具有相关性, 而MDR1则无差异; LRP在淋巴转移胃癌组中表达明显上调, 此结果说明MRP和LRP的基因表达与病情发展或者转移具有一定的关联性, 同时MRP基因表达影响患者预后状况. 这提示MRP基因可能在胃癌发生发展以及耐药产生过程中比MDR1和LRP起到了更重要的作用, 而传统上最重要的MDR1因素在其中的影响似乎相对最弱.
我们研究证实胃癌组织中上述耐药基因表达均明显上调, 说明多药耐药的发生是一个复杂的多因素复合过程; 提示胃癌多药耐药的发生是内源性获得的早期事件, 与未接受化疗的其他肿瘤, 如小细胞型肺癌、头颈部肿瘤、急性非淋巴性白血病、卵巢癌及乳癌中耐药基因的低表达不同[11,12]; 术前MRP基因表达上调的患者预后不良, 这说明后天的获得性药物刺激进一步影响治疗的结果和耐药的进展. 本研究提示上述耐药基因在胃癌多药耐药发生过程中作用有所不同: MRP可能比LRP和MDR1基因具有更为重要的影响, 他的表达量和患者的预后生存具有一定关系; 对其进一步研究可能会有助于我们对胃癌发生发展以及治疗的理解; 进一步对耐药基因尤其是MRP进行研究并将其用于病情监测, 会有助于提高治疗效率提高患者的有效生存时间.
目前研究证实多数肿瘤多药耐药的发生是通过MDR1、MRP以及LRP基因编码的相应蛋白, 以药泵作用将药物排出肿瘤细胞外; 或者改变药物在细胞内分布而导致耐药, 探讨他们与胃癌临床病理特征及预后的关系, 评价其在病程发展监控中的意义, 对临床治疗具有一定指导价值.
李淑德, 主任医师, 教授, 中国人民解放军第二军医大学长海医院消化内科
研究发现在胃癌病变组织中3种耐药基因表达均明显上调, 但在病程发生发展中MRP较MDR1有更重要的作用, 提示MRP的表达与耐药的发生以及预后生存具有一定关系.
本研究证明, 在胃癌耐药发生过程中MRP的重要性高于MDR1, 为进一步深入研究胃癌多药耐药的发生发展提供了新的路径.
对胃癌患者的MRP、MDR1以及LRP基因进行检测有助于指导临床化疗用药以及个体化的治疗, 对改善预后生存具有一定价值.
本文探讨MRP、LRP和MDR1基因在胃癌中的表达, 对阐明胃癌的发生与转移, 借以指导临床治疗, 有重要临床指导意义.
编辑: 张姗姗 电编:何基才
| 1. | Li DQ, Wang ZB, Bai J, Zhao J, Wang Y, Hu K, Du YH. Reversal of multidrug resistance in drug-resistant human gastric cancer cell line SGC7901/VCR by antiprogestin drug mifepristone. World J Gastroenterol. 2004;10:1722-1725. [PubMed] |
| 2. | 邓 晓斌, 王 珊, 邹 琳, 李 长春, 章 均, 欧阳 军. 小儿恶性肿瘤化疗前后外周血多药耐药基因、多药耐药相关蛋白基因、肺耐药蛋白基因的变化及临床意义. 第三军医大学学报. 2010;32:1087-1090. |
| 3. | Woodahl EL, Ho RJ. The role of MDR1 genetic polymorphisms in interindividual variability in P-glycoprotein expression and function. Curr Drug Metab. 2004;5:11-19. [PubMed] [DOI] |
| 4. | Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45:228-247. [PubMed] [DOI] |
| 7. | Soranzo N, Cavalleri GL, Weale ME, Wood NW, Depondt C, Marguerie R, Sisodiya SM, Goldstein DB. Identifying candidate causal variants responsible for altered activity of the ABCB1 multidrug resistance gene. Genome Res. 2004;14:1333-1344. [PubMed] [DOI] |
| 8. | Ponte-Sucre A. Availability and applications of ATP-binding cassette (ABC) transporter blockers. Appl Microbiol Biotechnol. 2007;76:279-286. [PubMed] [DOI] |
| 9. | Baird NJ, Fang XW, Srividya N, Pan T, Sosnick TR. Folding of a universal ribozyme: the ribonuclease P RNA. Q Rev Biophys. 2007;40:113-161. [PubMed] [DOI] |
| 10. | Zhou Y, Xu Y, Tan Y, Qi J, Xiao Y, Yang C, Zhu Z, Xiong D. Sorcin, an important gene associated with multidrug-resistance in human leukemia cells. Leuk Res. 2006;30:469-476. [PubMed] [DOI] |
| 11. | 李 向上, 林 阳, 胡 藴慧, 苏 晔, 程 昕, 杨 铭, 杨 纯正, 王 金宏. PHⅡ-7逆转肿瘤细胞K562/A02耐药机制的研究. 中国药理学通报. 2010;26:750-753. |
| 12. | Jerry DJ, Tao L, Yan H. Regulation of cancer stem cells by p53. Breast Cancer Res. 2008;10:304. [PubMed] [DOI] |