修回日期: 2011-11-25
接受日期: 2011-12-14
在线出版日期: 2012-01-18
目的: 探讨肽酰-脯氨酰-顺反式异构酶(peptidyl-prolyl cis-trans isomerase, PPIase)编码基因在不同胃疾病来源幽门螺杆菌(Helicobacter pylori, H. pylori)菌株中的分布情况, 旨在揭示其在胃疾病动态发展过程中的作用及其与胃疾病相关性.
方法: 选取浅表性胃炎(superficial gastritis, GS)、萎缩性胃炎(atrophic gastritis, GA)、胃癌(gastric cancer, GC)三组疾病来源胃黏膜活检标本分离培养出的H. pylori菌株64例, 其中GS26例、GA18例、GC20例, 使用酚-氯仿法提取菌种DNA, 经聚合酶链反应及琼脂糖凝胶电泳对PPIase编码基因进行检测. 用c2检验或Fisher精确检验分析不同胃疾病来源H. pylori菌株PPIase编码基因分布频率差异.
结果: GA组来源的H. pylori菌株PPIase基因分布频率(94.4%)最高, 与GS组(57.7%)和GC组(65.0%)相比差异有统计学意义(P = 0.014, P = 0.045); GC组(65.0%) PPIase基因分布频率高于GS组(57.7%), 无统计学差异(P>0.05).
结论: 萎缩性胃炎来源H. pylori菌株携带较高频率PPIase编码基因, 其与萎缩性胃炎的发生密切相关.
引文著录: 陈莫耶, 宫月华, 袁媛. 不同胃疾病来源幽门螺杆菌菌株PPIase编码基因分布频率及其意义. 世界华人消化杂志 2012; 20(2): 155-159
Revised: November 25, 2011
Accepted: December 14, 2011
Published online: January 18, 2012
AIM: To explore the distribution of the peptidyl-prolyl cis-trans isomerase (PPIase) gene in Helicobacter pylori (H. pylori) strains isolated from patients with different gastric diseases.
METHODS: Biopsy specimens were taken from the gastric mucosa of patients with superficial gastritis (GS), atrophic gastritis (GA) or gastric cancer (GC) and used to isolate a total of 64 H. pylori strains. The distribution of the PPIase gene in these strains was analyzed by PCR.
RESULTS: The GA group had the highest distribution frequency (94.4%) of the PPIase gene, which was significantly higher than those in the GS (57.7%) and GC (65.0%) groups (P = 0.014, 0.045). Although the frequency of the PPIase gene was higher in the GC group than in the GS group, there was no statistical difference between them (P > 0.05).
CONCLUSION: H. pylori strains isolated from patients with AG carried a higher frequency of the PPIase gene.
- Citation: Chen MY, Gong YH, Yuan Y. Differential distribution of the PPIase gene in Helicobacter pylori strains isolated from patients with different gastric diseases. Shijie Huaren Xiaohua Zazhi 2012; 20(2): 155-159
- URL: https://www.wjgnet.com/1009-3079/full/v20/i2/155.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i2.155
幽门螺杆菌(Helicobacter pylori, H. pylori)是成功定植于胃酸性环境的微生物之一[1], 是引起慢性胃炎的主要原因, 少数感染者会罹患消化性溃疡, 萎缩性胃炎, 胃癌等程度不等的严重临床疾病[2]. H. pylori导致的不同临床结局除了与环境因素以及宿主易感性相关以外, H. pylori菌株毒力基因的差异也在胃疾病的发生发展中起到重要作用, 目前寻找胃疾病进展过程中可以作为疾病潜在标志物的H. pylori菌株特异性毒力基因仍然是研究热点[3-5]. 目前较为关注的一些H. pylori与临床结局相关的毒力基因, 包括cagA, vacA s1, oipA, babA2, dupA以及hrgA等基因, 然而目前在东亚地区没有任何一个确定的H. pylori毒力基因具有疾病特异性, 尚不能作为与临床结局相关的潜在标志基因[6,7]. 确定H. pylori菌株与疾病相关的毒力基因对于高危人群的筛查, 临床疾病诊断以及预后的估计都有至关重要的作用. 本室在前期研究中, 采用抑制性消减杂交(SSH)以及斑点杂交的方法构建了H. pylori胃癌来源株和浅表性胃炎来源株差异基因文库, 对筛选出的差异基因进行鉴定, 发现肽酰-脯氨酰-顺反式异构酶(peptidyl-prolyl cis-trans isomerase, PPIase)编码基因为胃癌来源株的高拷贝基因, 可能与胃癌发生发展密切相关[8]. 本研究采用聚合酶链式反应(PCR)检测浅表性胃炎, 萎缩性胃炎以及胃癌3组不同疾病来源的H. pylori菌株PPIase编码基因的分布情况, 旨在揭示其在胃疾病动态发展过程中的作用及其与胃疾病相关性.
本研究经中国医科大学伦理委员会批准, 共选取浅表性胃炎(superficial gastritis, GS)、萎缩性胃炎(atrophic gastritis, GA)、胃癌(gastric cancer, GC)3种疾病来源的新鲜胃黏膜活检标本221例. 每例取胃黏膜4块, 其中3块(包括胃体、胃窦、胃角各1块)进行病理组织学检查, 另1块(胃窦)进行H. pylori培养.
1.2.1 H. pylori培养及鉴定:H. pylori培养采用脑心浸液琼脂培养基, 培养基内包含: 绵羊血(70 mL/L)、soVitaleX(4 mL/L)、两性霉素B(8 g/mL)、甲氧胺苄嘧啶(5 g/mL)、万古霉素(6 g/mL). 将脑心浸液琼脂培养基置于含有50 mL/L O2、100 mL/L CO2、850 mL/L N2、37 ℃相对湿度为95%的培养箱中, 培养3-6 d之后观察结果. 通过3种方法鉴定阳性H. pylori分离株:包括典型菌落的观察、革兰氏染色以及通用型引物16srRNA聚合酶链式反应, 其中2种方法鉴定为阳性即判定为H. pylori阳性. 收集典型菌落放入新鲜胃黏膜保存液500 mL中, 吹打混匀, -70 ℃保存备用.
1.2.2 H. pylori菌株DNA提取: 采用酚-氯仿方法提取H. pylori DNA. 菌种置于2 mL EP管中离心5 min(10 000 g/min), 去除上清液, 加入TE缓冲液318 mL, 10% SDS 80 mL, 蛋白酶K(20 g/L)2 mL, 振荡混匀; 37 ℃恒温水浴过夜; 加入等体积酚、氯仿、异戊醇, 3种试剂比例为25:24:1, 混匀后离心10 min; 将上层水相吸出加入等体积氯仿、异戊醇, 试剂比例为24:1, 混匀后离心10 min; 再次吸取上层水相, 加入1/10体积乙酸钠以及RNA酶(终浓度0.25-0.3 g/L), 混匀后37 ℃水浴30 min; 加入2.5倍体积预冷无水乙醇, 于-20 ℃放置2 h; 离心15 min(10 000 g/min), 除去上清液, 使用75%乙醇将沉淀洗涤两次, 沉淀干燥后重新溶于50 mL TE缓冲液中. 利用分光光度计测定H. pylori DNA浓度, 使用TE缓冲液将DNA浓度统一调整为100 ng/mL.
1.2.3 PPIase编码基因聚合酶链式反应(PCR):H. pylori PPIase编码基因经过PCR扩增, 琼脂糖凝胶电泳, genefinder染色观察. PCR反应体系为25 mL, 包括去离子水, 4种dNTP各2.5 mmol/L, Taq DNA聚合酶2.5 U, 基因组DNA 2 mL, 10 pmol引物. 引物序列为P1: 5'-CCCACCTTTCTTTCCG-3'; P2: 5'-CCATTCAAGCCACTATCAA-3': 预期片段203 bp[8]. 反应参数为: 94 ℃预变性5 min, 94 ℃变性45 s, 59 ℃退火45 s, 72 ℃延伸45 s, 经过35个循环后72 ℃延伸10 min. 扩增产物经20 g/L琼脂糖凝胶电泳分析, 置于紫外光凝胶成像系统观察结果.
统计学处理 采用SPSS16.0软件进行c2或Fisher精确检验, 检验水准为a = 0.05.
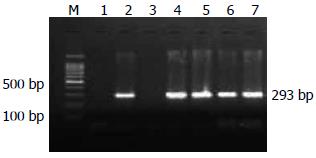
221例新鲜胃黏膜标本共培养出H. pylori菌株64例, 其中GS26例、GA18例、GC20例. 菌落特点: 培养基上观察到半透明, 针尖状典型菌落. 细菌形态: 常规革兰染色, 油镜下观察到革兰氏染色阴性, "C"形弯曲、S形或"海鸥型"弯曲的典型细菌形态. PCR反应: H. pylori通用型引物16srRNA基因检测出阳性条带(图1).
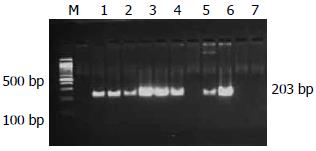
H. pylori菌株PPIase编码基因PCR扩增产物片段长度为203 bp(图2). 64株H. pylori菌株中, 70.31%(45/64)的PPIase编码基因扩增结果为阳性.
GS, GA, GC 3组疾病来源的H. pylori菌株PPIase编码基因检出率分别为57.7%, 94.4%, 65.0%. GA组H. pylori PPIase编码基因检出率(94.4%)最高, 与GS组(57.7%)和GC组(65.0%)相比差异具有统计学差异(P = 0.014, P = 0.045), GS组(57.7%)与GC组(65.0%)相比, GC来源的H. pylori菌株PPIase编码基因检出率高于GS组, 但是差异无统计学差异(P>0.05, 表1).
| 疾病 | n | 阳性n | 阴性n | 检出率(%) |
| 浅表性胃炎 | 26 | 15 | 11 | 57.7 |
| 萎缩性胃炎 | 18 | 17 | 1 | 94.4 |
| 胃癌 | 20 | 13 | 7 | 65.0 |
H. pylori PPIase编码基因编码蛋白为PPIase, 已经有学者明确指出PPIase与细菌感染以及毒力密切相关, 嗜肺军团杆菌的Mip蛋白是PPIase家族成员, 与进入细胞以及细胞内复制密切相关[9], 而PPIase家族的另一成员SlrA蛋白则与肺炎球菌的定植相关[10]. 那么PPIase是否也作为H. pylori的毒力因子之一参与H. pylori相关性胃疾病的发生与发展成为研究所关注的问题. 目前有研究证实PPIase编码基因的蛋白产物PPIase是H. pylori释放的5个分泌抗原之一, 可以在H. pylori感染者血清中被识别, 对其抗体的检测可能有助于H. pylori感染后疾病的诊断以及预后的预测[11,12]. H. pylori分泌的PPIase可以诱导胃上皮细胞凋亡[13], 还可以诱导巨噬细胞IL-6的产生, 与慢性炎症密不可分[14], 并且可以诱导TLR4依赖性因子EGFR超激活以及VGFR产生, 与致胃溃疡致胃癌作用相关[15], 目前对于H. pylori PPIase功能方面的研究较少,还有待于进行更广泛的体内以及体外实验进一步探讨PPIase的致病机制. Correa曾根据流行病学和病理学研究总结出人肠型胃癌发生的模式: 正常胃黏膜→浅表性胃炎→萎缩性胃炎→肠上皮化生/不典型增生→胃癌[16], H. pylori携带不同的毒力因子可能增加胃疾病发生进展动态过程中不同疾病的发病风险, 如在西方国家携带cagA基因的H. pylori菌株主要增加胃癌的发病风险[17], 而携带vacAd1等位基因的菌株主要增加萎缩性胃炎的发病风险[18], 那么, PPIase在致病过程中主要在哪一环节起到关键作用还有待探讨.
本研究对不同疾病来源的64株H. pylori菌株进行了PPIase编码基因的检测, 检测结果证实在GS、GA、GC 3组不同疾病来源的H. pylori菌株中, PPIase编码基因的分布频率存在差异, 检出率分别为57.7%, 94.4%, 65.0%. GA组H. pylori PPIase编码基因检出率(94.4%)明显高于GS组(57.7%)和GC组(65.0%)(P = 0.014, P = 0.045), 表明PPIase编码基因与萎缩性胃炎的发生密切相关, 感染PPIase编码基因阳性的菌株明显增加了萎缩性胃炎发生的风险. 曾有报道, H. pylori感染可以诱导萎缩性胃炎的发生, 其毒力基因cagA、vacA可能是导致萎缩性胃炎发生的机制之一[19,20], CagE能够直接诱导壁细胞凋亡, 导致腺体萎缩[21], CagA、VacA、HcpC以及GroEL同时存在的H. pylori菌株则更容易导致萎缩性胃炎的发生[22]. 据本研究结果, PPIase编码基因可能是H. pylori另一个重要的导致萎缩性胃炎发病的机制之一. 有研究报道, PPIase作为凋亡诱导因子通过与TLR-4以及ASK-1相互作用, 启动细胞程序性死亡通路, 导致胃上皮细胞过度凋亡, 打破新细胞生成率和凋亡导致的细胞丧失率之间的平衡, 而细胞损失过度, 可能与萎缩性胃炎的发生有关[13,23], 而萎缩性胃炎以及肠上皮化生又可以加速细胞凋亡[24], 两者互相推进, 加速疾病进展. 在Correa胃疾病进展模型中, 萎缩性胃炎是其中一个最关键的环节, 是肠型胃癌发生的关键因素[16]. 严重的萎缩性胃炎伴肠上皮化生可以明显增加胃癌发生的风险[25,26]. Uemura等[27]经过平均7.8年的随访发现大约有10%的中度萎缩性胃炎患者发展为胃恶性肿瘤. 本研究结果显示, 感染PPIase编码基因阳性H. pylori菌株与萎缩性胃炎密切相关, 而萎缩性胃炎又是导致肠型胃癌发生的重要癌前疾病, 增加萎缩性胃炎的发病风险, 就有可能提高胃癌, 尤其是肠型胃癌的发病风险. 另有研究发现, PPIase可以活化EGFR从而刺激VEGF的产生[15], VEGF家族在调节肿瘤血管生成方面起到至关重要的作用, 并且可以诱导细胞增殖, 分化以及血管内皮细胞迁移, 有利于肿瘤的生长和转移[28]. Meta分析的结果显示, 在亚洲罹患胃癌的人群中, VEGF过表达与胃癌患者生存率密切相关[29], 调节VEGF的表达与肿瘤的进展和预后密切相关[30], 研究结果支持PPIase在胃癌形成过程中可能起到了一定的作用. 综合本研究结果及相关研究报道, 我们推测, PPIase可能作为H. pylori毒力因子之一主要参与萎缩性胃炎发生的环节, 直接增加胃癌前疾病发病风险, 进而增加了胃癌发生的风险.
总之, 萎缩性胃炎来源H. pylori菌株携带较高频率PPIase编码基因, 其与萎缩性胃炎的发生密切相关, 在浅表性胃炎发展为萎缩性胃炎直至进展为胃癌的动态变化过程中起到重要作用. 检测PPIase编码基因对于H. pylori相关性萎缩性胃炎的诊断, 临床疗效判定及预测预后都具有良好的指导作用.
感谢本室孙丽萍、徐倩、董楠楠及王兰等给予本实验的大力帮助.
不同胃疾病来源的H. pylori分离株具有明显的遗传异质性, 其毒力因子的类型和频率分布存在明显差异, 与长期感染所导致的不同的临床结局密切相关, 寻找胃疾病进展过程中可以作为疾病潜在标志物的H. pylori菌株特异性毒力基因是目前研究热点.
陈卫昌, 教授, 苏州大学附属第一医院消化内科
目前有研究证实PPIase编码基因的蛋白产物PPIase是H. pylori释放的5个分泌抗原之一, 可以在H. pylori感染者血清中被识别, 并且PPIase蛋白与炎症因子的释放, 细胞的凋亡等密切相关, 可能参与了胃疾病发生发展的不同环节.
根据本研究结果, PPIase编码基因可能作为萎缩性胃炎发生的潜在标志基因, 感染PPIase编码基因阳性H. pylori菌株提示预后不良, 为临床高危人群的筛查、疗效判定以及预测预后提供线索.
本文设计合理, 有一定的研究价值, 可读性和科学性较好, 对临床实践有一定指导意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Sachs G, Scott DR, Wen Y. Gastric Infection by Helicobacter pylori. Curr Gastroenterol Rep. 2011;13:540-546. [PubMed] [DOI] |
| 2. | Yamaoka Y. Mechanisms of disease: Helicobacter pylori virulence factors. Nat Rev Gastroenterol Hepatol. 2010;7:629-641. [PubMed] |
| 3. | Marteau P, Chaput U. Bacteria as trigger for chronic gastrointestinal disorders. Dig Dis. 2011;29:166-171. [PubMed] [DOI] |
| 4. | Bornschein J, Kandulski A, Selgrad M, Malfertheiner P. From gastric inflammation to gastric cancer. Dig Dis. 2010;28:609-614. [PubMed] [DOI] |
| 5. | Hamajima N, Naito M, Kondo T, Goto Y. Genetic factors involved in the development of Helicobacter pylori-related gastric cancer. Cancer Sci. 2006;97:1129-1138. [PubMed] [DOI] |
| 6. | Lu H, Graham DY, Yamaoka Y. The Helicobacter pylori restriction endonuclease-replacing gene, hrgA, and clinical outcome: comparison of East Asia and Western countries. Dig Dis Sci. 2004;49:1551-1555. [PubMed] [DOI] |
| 7. | Nguyen LT, Uchida T, Tsukamoto Y, Kuroda A, Okimoto T, Kodama M, Murakami K, Fujioka T, Moriyama M. Helicobacter pylori dupA gene is not associated with clinical outcomes in the Japanese population. Clin Microbiol Infect. 2010;16:1264-1269. [PubMed] [DOI] |
| 8. | Gong YH, Chen M, Xu Y, Dong N, Sang Z, Liu J, Yuan Y. Subtractive hybridization analysis of gastric diseases-associated Helicobacter pylori identifies peptidyl-prolyl isomerase as a potential marker for gastric cancer. FEMS Microbiol Lett. 2011;320:103-109. [PubMed] [DOI] |
| 9. | Köhler R, Fanghänel J, König B, Lüneberg E, Frosch M, Rahfeld JU, Hilgenfeld R, Fischer G, Hacker J, Steinert M. Biochemical and functional analyses of the Mip protein: influence of the N-terminal half and of peptidylprolyl isomerase activity on the virulence of Legionella pneumophila. Infect Immun. 2003;71:4389-4397. [PubMed] [DOI] |
| 10. | Hermans PW, Adrian PV, Albert C, Estevão S, Hoogenboezem T, Luijendijk IH, Kamphausen T, Hammerschmidt S. The streptococcal lipoprotein rotamase A (SlrA) is a functional peptidyl-prolyl isomerase involved in pneumococcal colonization. J Biol Chem. 2006;281:968-976. [PubMed] [DOI] |
| 11. | Atanassov C, Pezennec L, d'Alayer J, Grollier G, Picard B, Fauchère JL. Novel antigens of Helicobacter pylori correspond to ulcer-related antibody pattern of sera from infected patients. J Clin Microbiol. 2002;40:547-552. [PubMed] [DOI] |
| 12. | Kim N, Weeks DL, Shin JM, Scott DR, Young MK, Sachs G. Proteins released by Helicobacter pylori in vitro. J Bacteriol. 2002;184:6155-6162. [PubMed] [DOI] |
| 13. | Basak C, Pathak SK, Bhattacharyya A, Pathak S, Basu J, Kundu M. The secreted peptidyl prolyl cis,trans-isomerase HP0175 of Helicobacter pylori induces apoptosis of gastric epithelial cells in a TLR4- and apoptosis signal-regulating kinase 1-dependent manner. J Immunol. 2005;174:5672-5680. [PubMed] |
| 14. | Pathak SK, Basu S, Bhattacharyya A, Pathak S, Banerjee A, Basu J, Kundu M. TLR4-dependent NF-kappaB activation and mitogen- and stress-activated protein kinase 1-triggered phosphorylation events are central to Helicobacter pylori peptidyl prolyl cis-, trans-isomerase (HP0175)-mediated induction of IL-6 release from macrophages. J Immunol. 2006;177:7950-7958. [PubMed] |
| 15. | Basu S, Pathak SK, Chatterjee G, Pathak S, Basu J, Kundu M. Helicobacter pylori protein HP0175 transactivates epidermal growth factor receptor through TLR4 in gastric epithelial cells. J Biol Chem. 2008;283:32369-32376. [PubMed] [DOI] |
| 16. | Correa P. Human gastric carcinogenesis: a multistep and multifactorial process--First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res. 1992;52:6735-6740. [PubMed] |
| 17. | Peleteiro B, Lunet N, Barros R, La Vecchia C, Barros H. Factors contributing to the underestimation of Helicobacter pylori-associated gastric cancer risk in a high-prevalence population. Cancer Causes Control. 2010;21:1257-1264. [PubMed] [DOI] |
| 18. | Ogiwara H, Sugimoto M, Ohno T, Vilaichone RK, Mahachai V, Graham DY, Yamaoka Y. Role of deletion located between the intermediate and middle regions of the Helicobacter pylori vacA gene in cases of gastroduodenal diseases. J Clin Microbiol. 2009;47:3493-3500. [PubMed] [DOI] |
| 19. | Adamu MA, Weck MN, Rothenbacher D, Brenner H. Incidence and risk factors for the development of chronic atrophic gastritis: five year follow-up of a population-based cohort study. Int J Cancer. 2011;128:1652-1658. [PubMed] [DOI] |
| 20. | Adamu MA, Weck MN, Gao L, Brenner H. Incidence of chronic atrophic gastritis: systematic review and meta-analysis of follow-up studies. Eur J Epidemiol. 2010;25:439-448. [PubMed] [DOI] |
| 21. | Neu B, Randlkofer P, Neuhofer M, Voland P, Mayerhofer A, Gerhard M, Schepp W, Prinz C. Helicobacter pylori induces apoptosis of rat gastric parietal cells. Am J Physiol Gastrointest Liver Physiol. 2002;283:G309-G318. [PubMed] |
| 22. | Gao L, Weck MN, Michel A, Pawlita M, Brenner H. Association between chronic atrophic gastritis and serum antibodies to 15 Helicobacter pylori proteins measured by multiplex serology. Cancer Res. 2009;69:2973-2980. [PubMed] [DOI] |
| 23. | Targa AC, César AC, Cury PM, Silva AE. Apoptosis in different gastric lesions and gastric cancer: relationship with Helicobacter pylori, overexpression of p53 and aneuploidy. Genet Mol Res. 2007;6:554-565. [PubMed] |
| 24. | Xia HH, Talley NJ. Apoptosis in gastric epithelium induced by Helicobacter pylori infection: implications in gastric carcinogenesis. Am J Gastroenterol. 2001;96:16-26. [PubMed] [DOI] |
| 25. | Yanaoka K, Oka M, Mukoubayashi C, Yoshimura N, Enomoto S, Iguchi M, Magari H, Utsunomiya H, Tamai H, Arii K. Cancer high-risk subjects identified by serum pepsinogen tests: outcomes after 10-year follow-up in asymptomatic middle-aged males. Cancer Epidemiol Biomarkers Prev. 2008;17:838-845. [PubMed] [DOI] |
| 26. | Ohata H, Kitauchi S, Yoshimura N, Mugitani K, Iwane M, Nakamura H, Yoshikawa A, Yanaoka K, Arii K, Tamai H. Progression of chronic atrophic gastritis associated with Helicobacter pylori infection increases risk of gastric cancer. Int J Cancer. 2004;109:138-143. [PubMed] [DOI] |
| 27. | Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med. 2001;345:784-789. [PubMed] [DOI] |
| 28. | Kut C, Mac Gabhann F, Popel AS. Where is VEGF in the body? A meta-analysis of VEGF distribution in cancer. Br J Cancer. 2007;97:978-985. [PubMed] [DOI] |
| 29. | Chen J, Li T, Wu Y, He L, Zhang L, Shi T, Yi Z, Liu M, Pang X. Prognostic significance of vascular endothelial growth factor expression in gastric carcinoma: a meta-analysis. J Cancer Res Clin Oncol. 2011;137:1799-1812. [PubMed] [DOI] |
| 30. | Zhao B, Yang P, Yang J, Cai D. A randomized trial of somatostatin to regulate the VEGFs/VEGFRs in patients with gastric cancer. Hepatogastroenterology. 2011;58:1425-1430. [PubMed] [DOI] |