修回日期: 2011-10-30
接受日期: 2011-12-23
在线出版日期: 2012-01-18
目的: 研究蟾毒灵诱导人胰腺癌细胞凋亡以及凋亡相关基因表达的JNK信号转导通路, 揭示其抗胰腺癌的部分机制.
方法: MTT法观察蟾毒灵对人胰腺癌BxPC-3细胞的生长抑制作用; 0.16、0.32、0.64 mg/L蟾毒灵分别作用人胰腺癌BxPC-3细胞48 h后, 流式细胞仪(flow cytometry, FCM)检测细胞周期和细胞凋亡; Western印迹法检测蟾毒灵作用BxPC-3细胞后SAPK/JNK信号通路的激活情况, 荧光定量PCR检测Survivin基因mRNA的表达水平; 并比较阻断JNK信号通路后丹参酮ⅡA对胰腺癌细胞凋亡Survivin基因mRNA的表达.
结果: MTT法测得蟾毒灵对人胰腺癌BxPC-3细胞具有显著的抑制作用, 其作用效果与剂量和作用时间成正相关; 0.16、0.32、0.64 mg/L浓度蟾毒灵作用人胰腺癌细胞后的细胞凋亡率分别为19.36%±0.39%、40.69%±0.44%、59.63%±1.14%, 与对照组2.24%±0.37%比较均有显著性差异(P<0.01); 蟾毒灵作用人胰腺癌细胞1 h后JNK信号通路被激活, 2 h达峰值; 阻断JNK信号通路后, 凋亡率明显降低(P<0.01); 0.32 mg/L蟾毒灵作用人胰腺癌细胞48 h后Survivin mRNA的表达明显下降; 阻断JNK信号通路后, 蟾毒灵作用人胰腺癌细胞的Survivin mRNA的表达明显上升.
结论: 蟾毒灵通过JNK信号转导通路下调人胰腺癌BxPC-3细胞Survivin mRNA的表达, 可能是其诱导胰腺癌细胞凋亡的机制.
引文著录: 胡强, 殷佩浩, 陆品相, 沈玉根, 余琛, 李水军, 贾晶莹, 刘罡一, 缪怡, 范耀祖. 蟾毒灵介导JNK信号通路诱导人胰腺癌细胞的凋亡. 世界华人消化杂志 2012; 20(2): 100-105
Revised: October 30, 2011
Accepted: December 23, 2011
Published online: January 18, 2012
AIM: To investigate whether bufalin induces apoptosis of human pancreatic cancer cells via the JNK signaling pathway.
METHODS: The cytostatic effect of bufalin on human pancreatic cancer cell line BxPC-3 was evaluated by MTT assay. The impact of bufalin on apoptosis and p-JNK expression was determined by flow cytometry (FCM) and Western blot, respectively. The mRNA expression level of survivin was detected by fluorescent quantitative PCR in BxPC-3 cells treated with bufalin in the absence or presence of a JNK inhibitor.
RESULTS: Bufalin inhibited cell growth in a concentration- and time-dependent manner. BxPC-3 cells treated with 0.16, 0.32, or 0.64 mg/L of bufalin for 48 h had cell apoptotic rates of 19.36% ± 0.39%, 40.69% ± 0.44% and 59.63% ± 1.14%, respectively, showing a significant difference among the three groups (P < 0.01). After the JNK signaling pathway was blocked, cell apoptotic rate decreased significantly (P < 0.01).After bufalin treatment, p-JNK expression was up-regulated at 1 h and reached the peak at 2 h. The mRNA expression of survivin decreased obviously after treatment with 0.32 mg/L of bufalin for 48 h, but increased significantly when the NK signaling pathway was blocked.
CONCLUSION: Bufalin can induce apoptosis of human pancreatic cancer cells. The anti-pancreatic cancer activity of bufalin might involve down-regulation of survivin mRNA via the SAPK/JNK signal transduction pathway.
- Citation: Hu Q, Yin PH, Lu PX, Shen YG, Yu C, Li SJ, Jia JY, Liu GY, Miao Y, Fan YZ. Bufalin induces apoptosis of pancreatic cancer cells via the JNK signaling pathway. Shijie Huaren Xiaohua Zazhi 2012; 20(2): 100-105
- URL: https://www.wjgnet.com/1009-3079/full/v20/i2/100.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i2.100
胰腺癌是一种临床表现隐匿、发病迅速且预后不良的消化系统恶性肿瘤, 手术治疗5年生存率低于20%[1-3]. 近年来, 中药或其提取物在抑制肿瘤生长、促进肿瘤细胞凋亡中的作用正日益受到国内外研究者的重视[4-7]. 蟾毒灵是蟾蜍中的有效抗癌成分, 近年来发现具有抗癌作用, 但对胰腺癌的作用尚未见报道. 本研究重点探讨蟾毒灵对人胰腺癌细胞周期和凋亡的影响及其作用机制.
人胰腺癌细胞株BxPC-3购于中科院上海细胞研究所; 蟾毒灵(bufalin)购自南昌贝塔生物公司, 纯度≥98%; JNK特异性的抑制剂sp600125购于美国Serologllcais公司; 总RNA抽提试剂RNAiso Reagent、荧光定量PCR试剂购自日本TaKaRa公司; 甘油醛-3-磷酸脱氢酶(GAPDH)、Survivin上下游引物和探针由上海闪晶分子生物科技有限公司设计并合成, 其中5'端标记上报告荧光基团FAM(6-carboxy-fluo-rescein-phosphoramidite), 3'端标记上淬灭荧光基团TAMRA(carboxy-tetramethyl-rhodamine).的引物序列如下: 上游引物: 5'-GGTTCATCCAGTCGCTTTGT-3',下游引物: 5'-AATTCTGTTGCCACCTTTCG-3'; 内参GAPDH作为对照, 上游引物: 5'-CCACTCCTCCACCTTTGAC-3', 下游引物: 5'-ACCCTGTTGCTGTAGCCA-3'. 氯仿、异丙醇、无水乙醇均为分析纯.
1.2.1 MTT法测定蟾毒灵对人胰腺癌细胞的生长抑制作用: 取对数生长期的人胰腺癌BxPC-3细胞, 调整细胞浓度至2×104/mL, 以每孔100 mL接种于96孔培养板中, 在50 mL/L CO2、饱和湿度、37 ℃孵箱中预培养24 h后加入100 mL不同浓度培养液配制的蟾毒灵, 使最终每组含蟾毒灵浓度分别为: 0.04、0.08、0.16、0.32、0.64、1.28 mg/L 6个剂量, 每个剂量分别设4个复孔, 并设正常细胞组作对照, 继续培养. 分别于24、48、72 h 3个时相进行MTT比色实验: 每次于实验结束前每孔加入浓度为5 g/L MTT液20 mL, 37 ℃避光培养继续培养 4 h, 使MTT还原为formazan. 每孔加DMSO 150 mL, 震荡10 min, 混匀使formazan充分溶解, 10 min后置于酶标仪570 nm检测吸光度A值, 以空白组平均值调零, 按以下公式计算抑制率: 细胞生长抑制率 = (1-实验孔平均A值)/对照孔平均A值×100%, 以剂量和生长抑制率作直线相关分析.
1.2.2 流式细胞仪检测: 人胰腺癌BxPC-3细胞常规培养至对数生长期, 换无血清培养液培养12 h使细胞周期同步化, 设0.16、0.32、0.64 mg/L蟾毒灵组, 20 mmol/L的JNK抑制剂sp600125组, 20 mmol/L的JNK抑制剂sp600125丹参酮IIA组, 培养48 h后, 分别收集各组细胞置于10 mL离心管中. 各样本的细胞密度为1×106/mL, 1 000 r/min离心5 min后弃去培养液. 用孵育缓冲液洗涤1次, 1 000 r/min离心5 min, 用100 mL标记溶液重悬细胞, 室温下避光孵育15 min, 1 000 r/min离心5 min沉淀细胞, 孵育缓冲液洗1次. 加入Annexin V-FITC /PI溶液5 mL, 4 ℃下孵育20 min. 最后补400 mL PBS, 用流式细胞仪(FACS Calibur, BD公司) 检测细胞周期和凋亡情况. 每个样品检测1万个细胞, 用cellquest软件分析细胞凋亡情况.
1.2.3 Western印迹法检测JNK的磷酸化: 将各组细胞用预冷的PBS液洗2次, 吸弃PBS液, 加入预冷的含抑制剂的蛋白质抽提试剂, 轻轻摇动5 min; 后用一预冷的橡胶和塑料细胞刮刮下培养瓶壁上细胞, 转移细胞悬液到离心管中, 冰浴15 min进行裂解. 裂解液于预冷的离心机中14 000 r/min离心15 min, 吸弃上清液; BCA分析试剂测定蛋白质浓度. 50 mg总蛋白质在SDS聚丙烯酰胺凝胶电泳分离后, 电转移至PVDF膜, 膜在5% BSA溶液中室温培养1 h以封闭膜上的非特异结合. 封闭过的膜加入一抗4 ℃过夜. TBS/T洗膜3次, 每次5 min; 再加入HRP标记的二抗, 室温孵育1 h, TBS/T洗膜3次, 每次5min; 同样方法标记鼠单克隆抗GAPDH作对照. 洗膜稍干后, 按1:1加入AB显影液(与二抗HRP结合), 在Bio-Rad的化学发光成像仪上显影. 然后分析灰度值, 计算灰度系数比.
1.2.4 荧光定量PCR: 将蟾毒灵稀释至终浓度为0.32 mg/L, 处理人胰腺癌细胞48 h后加胰酶消化离心收集细胞. 将各组细胞分别加入2 mL RNAiso, 按说明书提取总RNA. 1 mL总RNA在20 mL体系中按照标准程序进行反转录, 反应条件: 37 ℃ 15 min, 85 ℃ 5 s. Survivin和GAPDH基因荧光定量PCR反应体系均如下: Premix EX TaqTM 10 mL, Rox Reference Dye 0.4 mL, 上下游引物各0.4 mL, 荧光探针0.8 mL, ddH2O 6 mL, cDNA 2 mL, 共20 mL体系. 反应条件如下: 预变性: 95 ℃ 10 s ; 变性: 95 ℃ 5 s; 退火延伸: 60 ℃ 31 s, 40个循环. 数据采用ABI 7300 SDS Software分析. 相对mRNA表达 = 2-DDCt, DCt值 = 靶基因Ct值-GAPDH Ct值. 以GAPDH作为内参照, 同时以PANC-1细胞作为基准, 各组细胞mRNA的表达量表示成PANC-1细胞的N倍, N = 样品表达量/基准表达量 = 2-样本DCt/2-基准DCt, 每组均做3个样本, 取均数.
统计学处理 采用PEMS3.1医学统计软件包进行统计分析; 计量资料以mean±SD表示; 多样本比较采用单因素方差分析; 用Student's t检验、Rank sum检验和SNK检验方法进行统计分析; 组间比较用t或t'检验. P<0.05具有统计学差异.
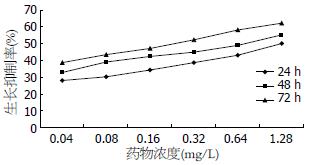
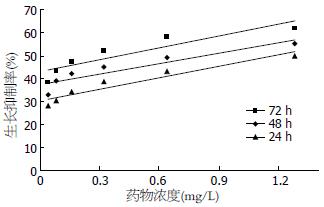
倒置显微镜观察, 用药后细胞排列稀疏, 部分变圆, 随作用时间延长、药物浓度的增加细胞数明显减少. 不同剂量的蟾毒灵对BxPC-3细胞的生长均有一定的抑制作用, 抑制率与药物浓度和作用时间成正相关. 24 h、48 h、72 h蟾毒灵剂量和生长抑制率之间的直线回归方程分别为: y = 16.28x +31.446, r = 0.9233; y = 15.334x + 37.945, r = 0.9155 ; y =16.862x + 43.756, r = 0.9054(y为抑制率, x为蟾毒灵剂量, r为相关系数). 24 h、48 h、72 h IC50(半数抑制浓度)分别为1.14 mg/L、0.79 mg/L、0.37 mg/L(图1, 2).
蟾毒灵作用48 h后, 细胞周期均受到不同程度的影响, 与对照组相比, 3个剂量组 G2/M期细胞比例均显著增加(P<0.05); 且随着药物剂量的增加, G2/M期的比例也显著增加. 以上结果提示蟾毒灵可通过G2/M期阻滞抑制胰腺癌细胞的生长(表1).
0.16、0.32、0.64 mg/L浓度蟾毒灵作用人胰腺癌细胞后的细胞凋亡率明显高于对照组的凋亡率(19.36%±0.39%, 40.69%±0.44%, 59.63%±1.14% vs 2.24%±0.37%), 并出现凋亡典型性特征峰. 加入抑制剂sp600125组的细胞凋亡率(1.78%±0.21% vs 2.24%±0.37%), 蟾毒灵组作用人胰腺癌细胞后凋亡率显著提高(P<0.01); 阻断SAPK/JNK信号转导通路后蟾毒灵作用人胰腺癌细胞后凋亡率明显降低(P<0.01). 提示蟾毒灵通过胰腺癌细胞内SAPK/JNK信号转导途径诱导细胞凋亡(表2).
| 分组 | 凋亡率 |
| 对照组 | 2.24±0.37 |
| Sp600125组 | 1.78±0.21 |
| 蟾毒灵低剂量组 | 19.36±0.39 |
| 蟾毒灵中剂量组 | 40.69±0.44 |
| 蟾毒灵高剂量组 | 59.63±1.14 |
| 蟾毒灵中剂量+Sp600125组 | 16.98±0.48 |
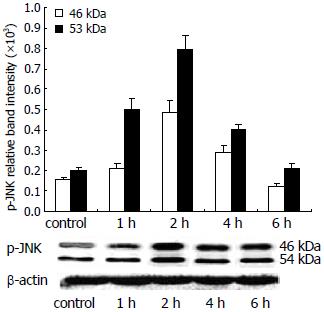
Western印迹法检测JNK及磷酸化JNK蛋白. 结果发现对照组BxPC-3细胞p-JNK弱表达, 0.32 mg/L蟾毒灵作用BxPC-3细胞1 h时JNK被迅速激活, 2 h达峰值, 约为对照组的 3.15倍(图3).
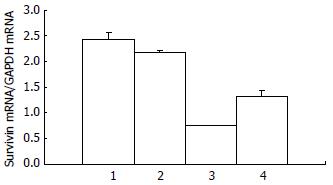
荧光定量PCR结果显示, 0.32 mg/L蟾毒灵作用人胰腺癌细胞48 h后Survivin mRNA的表达明显下调(P<0.01), 为正常细胞的0.27倍; 阻断SAPK/JNK信号通路后Survivin mRNA的表达明显上调(P<0.01, 图4).
胰腺癌属于中医中"癥瘕"、"积聚"等范畴, 其发生发展与后天失养、饮食失调、七情郁结导致机体免疫监控功能失调、基因突变密切相关. 病理因素以邪实为主: 有邪毒内攻、气滞血瘀、寒湿阻滞、湿热蕴结. 应用中医"以毒攻毒"理论, 传统中药蟾酥治疗肿瘤有悠久的历史. 蟾毒灵是中药蟾酥中的有效成分之一, 属于蟾毒甾烯类化合物, 分子式为C24H34O4, 相对分子质量386 kDa, 其疏水性较强, 具有广泛的药理作用[8]. 现代研究发现其具有较强的抗肿瘤作用, 在控制肿瘤发展、延长生存期、缓解症状、改善生活质量方面有较好的疗效, 作用机制涉及促进凋亡、诱导分化、抑制肿瘤血管新生等[9-11].
细胞凋亡(Apoptosis)是在基因调控下的细胞程序化死亡, 临床上除了大剂量化疗、放疗可能引起细胞坏死外[12-15], 一般抗癌药物、激素制剂、放疗、中药等的主要作用机制都是通过诱导各自敏感的细胞发生凋亡来达到治疗目的. 凋亡不仅直接影响着机体组织的正常发育、分化与死亡, 他在肿瘤治疗中的作用也已受到极大的重视[16-18].
JNK(c-Jun N-terminal kinase, c-Jun氨基末端激酶)也被称为应激活化蛋白激酶(stress-activated protein kinase, SAPK), 作为丝裂原活化蛋白酶(mitogen-activated protein kinase, MAPK)家族中的重要成员, 是细胞内重要的信号转导通路之一[19-22]. JNK位于细胞质, 是分子质量为54 kDa的丝氨酸/苏氨酸蛋白激酶. 他包含双磷酸化的功能区Thr-Pro-Tyr, JNK与其下游c-JunN端的活化区结合并使其第63, 73位丝氨酸残基磷酸化. JNK的活化是通过其氨基酸残基端的磷酸化, 在静止细胞中, JNK通过磷酸化反应而激活, 一旦被激活, 胞浆中的JNK移位到细胞核, 通过对转录因子c-Jun、ATF-2、Elk-1等的磷酸化促进基因的表达及新蛋白质的合成而促进或引起细胞凋亡[23-27]. 目前, 多数研究认为JNK通路是化疗药物、紫外线照射及Fas蛋白等诱导细胞凋亡所必需的通路, 并必须持续激活JNK才能诱导细胞凋亡[27-29].
我们在实验中发现蟾毒灵对人胰腺癌BxPC-3细胞的生长抑制率均有显著的抑制作用, 其作用与剂量和作用时间成正相关; 0.16、0.32、0.64 mg/L浓度蟾毒灵作用人胰腺癌细胞后的细胞凋亡率分别为(19.36%±0.39%), (40.69%±0.44%)和(59.63%±1.14%), 与对照组比较均有显著性差异(P<0.01); 阻断JNK信号通路后, 凋亡率明显降低(P<0.01). 蟾毒灵作用人胰腺癌细胞1 h后JNK信号通路被激活, 2 h达峰值, 0.32 mg/L蟾毒灵作用人胰腺癌细胞48 h后Survivin mRNA的表达明显下降; 阻断JNK信号通路后, 蟾毒灵作用人胰腺癌细胞的Survivin mRNA的表达明显上升. 提示蟾毒灵治疗胰腺癌的机制与诱导胰腺癌细胞凋亡有关, 通过JNK信号转导下调Survivin mRNA是蟾毒灵诱导胰腺癌细胞凋亡的重要机制之一. 本实验显示蟾毒灵具有较好的诱导胰腺癌细胞凋亡的作用, 在治疗胰腺癌方面具有较好的应用前景.
胰腺癌是一种临床表现隐匿、发病迅速且预后不良的消化系统恶性肿瘤, 手术治疗5年生存率低于20%. 近年来, 中药或其提取物在抑制肿瘤生长、促进肿瘤细胞凋亡中的作用正日益受到国内外研究者的重视.
齐清会, 教授, 大连医科大学附属第一医院; 周国雄, 主任医师, 南通大学附属医院消化内科
毒灵是蟾蜍中的有效抗癌成分, 近年来发现具有抗癌作用, 但对胰腺癌的作用尚未见报道.
目前, 多数研究认为JNK通路是化疗药物、紫外线照射及Fas蛋白等诱导细胞凋亡所必需的通路, 并必须持续激活JNK才能诱导细胞凋亡.
本实验显示蟾毒灵具有较好的诱导胰腺癌细胞凋亡的作用, 在治疗胰腺癌方面具有较好的应用前景.
本文研究了中药蟾毒灵对人胰腺癌细胞周期和凋亡的影响及其作用机制, 选题较好, 内容丰富, 统计正确, 结论可靠, 有较好的价值.
编辑: 曹丽鸥 电编:何基才
| 1. | DuBois RN. New paradigms for cancer prevention. Carcinogenesis. 2001;22:691-692. [PubMed] [DOI] |
| 2. | Gumbs AA, Rodriguez Rivera AM, Milone L, Hoffman JP. Laparoscopic pancreatoduodenectomy: a review of 285 published cases. Ann Surg Oncol. 2011;18:1335-1341. [PubMed] [DOI] |
| 3. | Pan FC, Wright C. Pancreas organogenesis: from bud to plexus to gland. Dev Dyn. 2011;240:530-565. [PubMed] [DOI] |
| 4. | 王 炎, 李 琦, 范 忠泽, 王 忆勤, 邱 艳艳, 靳 宝辉, 陈 星竹, 殷 佩浩. 丹参酮ⅡA对人胰腺癌细胞凋亡的诱导作用及其对SAPK/JNK信号转导通路的影响. 世界华人消化杂志. 2011;19:1028-1033. [DOI] |
| 6. | 王 熙月, 韩 凤娟, 汤 欣, 吴 效科, 侯 丽辉. 中药复方药物血清对CDKN2A和RPS3a基因在人卵巢癌细胞株SKOV3中表达的影响. 世界中西医结合杂志. 2011;6:747-750. |
| 8. | Lee DY, Yasuda M, Yamamoto T, Yoshida T, Kuroiwa Y. Bufalin inhibits endothelial cell proliferation and angiogenesis in vitro. Life Sci. 1997;60:127-134. [PubMed] [DOI] |
| 9. | Jiang Y, Zhang Y, Luan J, Duan H, Zhang F, Yagasaki K, Zhang G. Effects of bufalin on the proliferation of human lung cancer cells and its molecular mechanisms of action. Cytotechnology. 2010;62:573-583. [PubMed] [DOI] |
| 11. | Qi F, Inagaki Y, Gao B, Cui X, Xu H, Kokudo N, Li A, Tang W. Bufalin and cinobufagin induce apoptosis of human hepatocellular carcinoma cells via Fas- and mitochondria-mediated pathways. Cancer Sci. 2011;102:951-958. [PubMed] [DOI] |
| 12. | Ribatti D, Vacca A. The role of microenvironment in tumor angiogenesis. Genes Nutr. 2008;3:29-34. [PubMed] [DOI] |
| 13. | Zhao P, Zhong W, Ying X, Yuan Z, Fu J, Zhou Z. Manganese chloride-induced G0/G1 and S phase arrest in A549 cells. Toxicology. 2008;250:39-46. [PubMed] [DOI] |
| 14. | Johansson M, Persson JL. Cancer therapy: targeting cell cycle regulators. Anticancer Agents Med Chem. 2008;8:723-731. [PubMed] |
| 16. | 王 炎, 李 琦, 范 忠泽, 孙 珏, 王 忆勤, 刘 瑞海, 高 虹. 丹参酮ⅡA介导p38MAPK信号转导诱导人肝癌细胞凋亡. 世界华人消化杂志. 2009;17:124-129. [DOI] |
| 17. | Lee SK, Kim HN, Kang YR, Lee CW, Kim HM, Han DC, Shin J, Bae K, Kwon BM. Obovatol inhibits colorectal cancer growth by inhibiting tumor cell proliferation and inducing apoptosis. Bioorg Med Chem. 2008;16:8397-8402. [PubMed] [DOI] |
| 19. | Huang Y, Huang X, Cai J, Ye F, Qin Q. Involvement of the mitogen-activated protein kinase pathway in soft-shelled turtle iridovirus-induced apoptosis. Apoptosis. 2011;16:581-593. [PubMed] [DOI] |
| 20. | Thévenin AF, Zony CL, Bahnson BJ, Colman RF. Activation by phosphorylation and purification of human c-Jun N-terminal kinase (JNK) isoforms in milligram amounts. Protein Expr Purif. 2011;75:138-146. [PubMed] [DOI] |
| 21. | Nix P, Hisamoto N, Matsumoto K, Bastiani M. Axon regeneration requires coordinate activation of p38 and JNK MAPK pathways. Proc Natl Acad Sci U S A. 2011;108:10738-10743. [PubMed] [DOI] |
| 22. | Kovac A, Zilka N, Kazmerova Z, Cente M, Zilkova M, Novak M. Misfolded truncated protein τ induces innate immune response via MAPK pathway. J Immunol. 2011;187:2732-2739. [PubMed] [DOI] |
| 23. | Bogoyevitch MA, Ngoei KR, Zhao TT, Yeap YY, Ng DC. c-Jun N-terminal kinase (JNK) signaling: recent advances and challenges. Biochim Biophys Acta. 2010;1804:463-475. [PubMed] |
| 24. | Séverin S, Ghevaert C, Mazharian A. The mitogen-activated protein kinase signaling pathways: role in megakaryocyte differentiation. J Thromb Haemost. 2010;8:17-26. [PubMed] [DOI] |
| 25. | Geest CR, Coffer PJ. MAPK signaling pathways in the regulation of hematopoiesis. J Leukoc Biol. 2009;86:237-250. [PubMed] [DOI] |
| 26. | Yu MK, Lee YH, Yoon MR, Bhattarai G, Lee NH, Kim TG, Jhee EC, Yi HK. Attenuation of AH26-induced apoptosis by inhibition of SAPK/JNK pathway in MC-3T3 E1 cells. J Endod. 2010;36:1967-1971. [PubMed] [DOI] |
| 27. | Brnjic S, Olofsson MH, Havelka AM, Linder S. Chemical biology suggests a role for calcium signaling in mediating sustained JNK activation during apoptosis. Mol Biosyst. 2010;6:767-774. [PubMed] [DOI] |
| 28. | Bermudez O, Pagès G, Gimond C. The dual-specificity MAP kinase phosphatases: critical roles in development and cancer. Am J Physiol Cell Physiol. 2010;299:C189-C202. [PubMed] [DOI] |