修回日期: 2012-05-03
接受日期: 2012-06-01
在线出版日期: 2012-07-08
目的: 研究SLP-2基因在胃腺癌及正常胃黏膜中的表达情况.
方法: 应用免疫组织化学法及RT-PCR法分别检测45例及40例胃腺癌及其癌旁正常胃黏膜中SLP-2基因的表达, 并结合免疫组织化学结果及胃癌患者的临床病理资料进行分析.
结果: 免疫组织化学和RT-PCR结果均显示SLP-2在胃腺癌组织中的表达高于正常配对胃黏膜(68.9% vs 26.7%, 1.12±0.47 vs 0.63±0.31, 均P<0.01), 且SLP-2的表达与胃癌TNM分期及有无淋巴结转移相关(χ2 = 5.32、4.78, 均P<0.05).
结论: SLP-2基因在胃腺癌组织中高表达, 可能参与胃腺癌的发生发展和转移.
引文著录: 张剑, 李建生, 吴敏, 赵晔. SLP-2在胃癌中的表达及意义. 世界华人消化杂志 2012; 20(19): 1778-1781
Revised: May 3, 2012
Accepted: June 1, 2012
Published online: July 8, 2012
AIM: To investigate the expression of stomatin-like protein 2 (SLP-2) in gastric adenocarcinoma and to analyze its significance.
METHODS: The expression of SLP-2 mRNA and protein was detected by RT-PCR in 40 cases and by immunohistochemistry in 45 cases of human gastric adenocarcinoma and adjacent tumor-free tissue, respectively. The relationship between SLP-2 expression and clinicopathologic characteristics of gastric adenocarcinoma was then analyzed.
RESULTS: The expression of SLP-2 mRNA and protein in gastric adenocarcinoma was significantly higher than that in adjacent tumor-free tissue (68.9% vs 26.7%, 1.12 ± 0.47 vs 0.63 ± 0.31, both P < 0.01). SLP-2 expression in gastric adenocarcinoma was associated with lymph node metastasis and TNM stage (χ2 = 5.32, 4.78, both P < 0.05), but not with other clinicopathologic characteristics (all P > 0.05).
CONCLUSION: The expression of SLP-2 is increased in gastric adenocarcinoma. SLP-2 may play important roles in the occurrence, development and metastasis of gastric adenocarcinoma.
- Citation: Zhang J, Li JS, Wu M, Zhao Y. Significance of SLP-2 expression in gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(19): 1778-1781
- URL: https://www.wjgnet.com/1009-3079/full/v20/i19/1778.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i19.1778
胃癌是世界上最为常见的恶性肿瘤之一, 居男性恶性肿瘤发病率的第3位, 女性恶性肿瘤发病率的第4位. 包括中国在内的东亚地区是世界上胃癌发病率和死亡率最高的地区[1], 胃癌的病理类型主要为腺癌. 恶性肿瘤的发生是涉及多基因、多分子水平变化、多阶段的一个复杂过程, 而癌基因的激活和抑癌基因的失活是该过程的重要事件之一. SLP-2基因是2000年由美国耶鲁大学病理科首次发现并命名的, 属于stomatin基因超家族的一个新成员[2], 其具体特性和功能尚未查明. 中国医学科学院张立勇等[3]首次发现SLP-2基因在食管鳞状细胞癌中过表达, 其在食管鳞癌中的表达水平是正常食管黏膜中的6倍以上, 并发现其与肿瘤的发生发展关系密切. 本研究采用免疫组织化学法和RT-PCR法检测SLP-2在人胃腺癌组织中的表达, 并结合患者的临床病理资料进行分析, 旨在探讨SLP-2在胃腺癌中的表达特点及其意义.
收集郑州大学第五附属医院2010-05/2011-04手术切除的胃癌标本45例, 取癌组织及癌旁正常组织(距离癌组织边缘>5 cm). 所有标本均经病理学检查确诊为胃腺癌, 术前未接受过放、化疗. 其中男27例, 女18例; 年龄45-78岁, 中位年龄63岁. 临床分期按TNM分期标准(AJCC 2010年第7版). TRIzol试剂盒和cDNA第一链合成逆转录试剂盒购自美国Invitrogen公司; 一抗为鼠抗人SLP-2单克隆抗体购自美国proteintech公司; 即用型一步法(非生物素)检测试剂盒购自迈新公司.
1.2.1 组织总RNA的提取和cDNA第一链的合成: 细胞总RNA的提取按照TRIzol试剂盒说明书进行操作. 经紫外分光光度仪检测波长为260 nm和280 nm时的吸光度(A)值, A260/A280为1.8-2.0时, 说明RNA纯度良好; 用1%琼脂糖凝胶电泳, 若28S和18S条带清楚, 比值约为2:1, 则表明总RNA没有被降解, 为完整的总RNA. cDNA第一链合成按逆转录试剂盒说明书进行操作. cDNA产物-20 ℃保存.
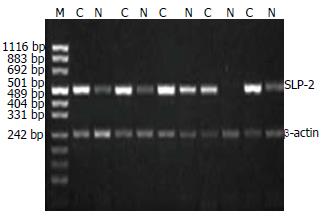
1.2.2 半定量RT-PCR: 用于扩增SLP-2基因的上游引物5'-CTGGAGCCTGGTTTGAACAT-3'; 下游引物为5'-AGGATCTGGGCCTGTTTCTT-3', 扩增片断长度为500 bp. 以β-actin为内对照, 上游引物为5'-ACACTGTGCCCATCTACGACC-3'; 下游引物为5'-AGGGGCCGGACTCGTCATAGA-3', 扩增片断长度为242 bp. PCR反应体系: 2×Taq PCR Master Mix 12.5 µL, β-actin上、下游引物各1 µL, SLP-2上、下游引物各1 µL, cDNA 2 µL, ddH2O补至25 µL. PCR反应在2400型PCR仪(美国PE公司产品)上进行, 94 ℃预变性5 min; 进入循环: 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 50 s, 共30个循环; 最后72 ℃延伸7 min, 获取扩增片断. 扩增产物进行1.5%琼脂糖凝胶电泳后, 电泳条带图像用Fluor-S MutiImager凝胶成像仪(美国Bio-Rad公司产品)扫描, 用Multi-Analyst软件包(美国Bio-Rad公司产品)定量分析电泳分离的各特异扩增条带的原始A值, 以SLP-2与β-actin的A值的比值表示SLP-2 mRNA的相对表达水平.
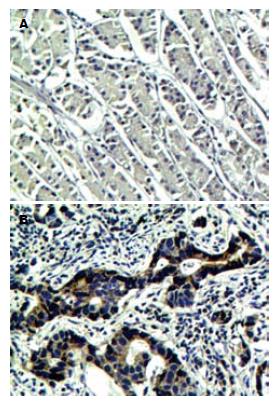
1.2.3 免疫组织化学染色: 所有组织均用10%甲醛溶液固定, 经脱水、包埋、3 μm厚连续切片. 鼠抗人SLP-2单克隆抗体稀释度为1:200. 操作步骤按即用型一步法(非生物素)检测试剂盒说明书进行. 用PBS代替一抗作阴性对照, 用已知阳性片作阳性对照. 免疫组织化学染色由2位高年资病理科医师在双盲条件下进行评定, 判定标准参照文献[4], 每张切片根据阳性细胞染色程度及细胞阳性百分数的多少进行分级. 计数阳性细胞百分数: 没有阳性细胞赋值为0, 1%-25%为1, 26%-50%为2, 51%-75%为3, >75%为4. 染色程度根据每张切片的大多数细胞染色特征决定: 细胞膜及细胞浆无着色赋值为0, 浅黄色为1, 黄色为2, 棕黄色为3. 最终评分由两者分数相乘得到, 总值≥8分为高表达, <8分为阴性或低表达.
统计学处理 应用SPSS16.0统计软件进行统计分析. 采用χ2检验及t检验, P<0.05为差异有统计学意义.
胃癌组织中SLP-2 mRNA表达水平为1.12±0.47, 正常胃黏膜组织为0.63±0.31, 两者比较, 差异有统计学意义(t = 4.77, P<0.01, 图1).
SLP-2在癌旁正常胃黏膜中多为低表达, 在胃腺癌组织中则多呈高表达. SLP-2在胃腺癌和癌旁正常胃黏膜中的高表达率分别为68.9%(31/45)和26.7%(12/45), 差异有统计学意义(χ2 = 16.08, P<0.01, 图2).
SLP-2蛋白的表达与淋巴结转移及TNM分期密切相关(均P<0.05, 表1); 与患者年龄、性别、肿瘤大小、分化程度无关.
| n | SLP-2蛋白表达 | χ2值 | P值 | ||
| 高 | 低 | ||||
| 性别 | 0.85 | >0.05 | |||
| 男 | 27 | 20 | 7 | ||
| 女 | 18 | 11 | 7 | ||
| 年龄(岁) | 0.09 | >0.05 | |||
| ≤50 | 10 | 6 | 4 | ||
| >50 | 35 | 25 | 10 | ||
| 肿瘤大小(cm) | 1.20 | >0.05 | |||
| ≤5 | 32 | 20 | 12 | ||
| >5 | 13 | 11 | 2 | ||
| 分化程度 | 0.12 | >0.05 | |||
| 高-中分化 | 29 | 21 | 8 | ||
| 低分化 | 16 | 10 | 6 | ||
| 淋巴结转移 | 4.78 | <0.05 | |||
| 有 | 31 | 25 | 6 | ||
| 无 | 14 | 6 | 8 | ||
| 临床分期 | 5.32 | <0.05 | |||
| Ⅰ+Ⅱ | 11 | 4 | 7 | ||
| Ⅲ+Ⅳ | 34 | 27 | 7 | ||
SLP-2基因是2000年首次发现并命名的一个新基因, 并在当时被鉴定为细胞膜相关蛋白[2]. SLP-2因其含有stomatin家族的保守序列而被认为是stomatin家族的一个新成员. Stomatin蛋白广泛存在于不同种属的多种组织中, 是一种整合膜蛋白, stomatin及其同源物可能作为离子通道和细胞骨架之间的连接分子, 从而影响细胞信号传导通路和细胞骨架[5,6]. SLP-2基因定位于染色体9P13.1, 长约3 250 bp, SLP-2蛋白具有stomatin基因家族所共有的SPFH(stomatin/prohibitin/flotillin/hflk)结构域, 但不具有其他stomatin家族成员所共有的N-端疏水结构域[2], 因此推测, SLP-2蛋白可能是一种细胞质膜相关蛋白, 但不直接整合到细胞膜脂质双层结构中, 可能作为外周膜蛋白起作用, 调控离子通道和脂筏结构[2,7]. 近年来关于线粒体的蛋白组学研究发现, SLP-2存在于细胞的线粒体中[8], 并与一些线粒体内膜相关蛋白有直接结合, 可能参与调节与其结合的线粒体膜相关蛋白的稳定性[9,10].
张立勇等[3]首次发现SLP-2基因在食管鳞状细胞癌中过表达, 并与肿瘤的发生﹑发展关系密切. 此后的一些研究表明, SLP-2基因在肺癌、子宫内膜癌、结直肠癌[11-16]等恶性肿瘤中也存在高表达. 推测其在恶性肿瘤中的高表达是一个较为普遍的现象, SLP-2可能是一个新的癌基因. 但目前关于SLP-2基因的研究较少, 国内、外尚无有关SLP-2基因在胃癌中表达情况的报道. 本实验采用RT-PCR法检测40对人胃腺癌及癌旁正常胃黏膜组织中SLP-2 mRNA表达水平, 用免疫组织化学法检测45对人胃腺癌及癌旁正常胃黏膜组织中SLP-2蛋白表达水平, 结果均显示, SLP-2基因表达在胃腺癌中较正常胃黏膜组织有较明显升高(均P<0.01). 结合免疫组织化学结果和患者临床病理资料进行分析发现, SLP-2蛋白的高表达与胃腺癌的临床分期和有无淋巴结转移相关(均P<0.05), 即较晚期病例的胃腺癌组织SLP-2蛋白的表达水平高于较早期病例的胃腺癌组织, 有淋巴结转移的病例相对应的胃腺癌组织中SLP-2蛋白的表达水平高于无淋巴结转移的病例; 而SLP-2蛋白的表达与其他临床病理变量没有显著相关性. 提示SLP-2可能是一个与胃腺癌分期和转移相关的指标, 在胃腺癌的发展和转移中起一定的促进作用.
总之, 本研究首次发现SLP-2在胃腺癌组织中呈高表达, 并与胃腺癌的淋巴结转移和TNM分期相关. 恶性肿瘤的分期及是否有淋巴结转移和远处转移是决定其预后的重要因素, 因此, SLP-2可能作为胃癌的一个有意义的预后指标, 指导胃癌患者的预后生存, 并有可能作为一个新的肿瘤靶向治疗的靶点. 目前对SLP-2的研究不多, SLP-2在胃癌中的表达情况及其对肿瘤细胞的调节机制有待大样本量实验及肿瘤体内外实验进一步深入研究.
SLP-2基因是2000年由美国耶鲁大学首次发现并命名的一个新基因, 属于stomatin基因超家族的一个新成员, 近年来发现其在肺癌、子宫内膜癌、结直肠癌等恶性肿瘤中高表达. 但目前国内、外有关SLP-2基因的研究较少, 尚无有关SLP-2基因在胃癌中表达情况的报道.
刘丽江, 教授, 江汉大学医学院病理学
本研究首次发现SLP-2在胃腺癌组织中呈高表达, 并与胃腺癌的淋巴结转移和TNM分期相关.
恶性肿瘤的分期及是否有淋巴结转移和远处转移是决定其预后的重要因素, 因此, SLP-2可能作为胃癌的一个有意义的预后指标, 指导胃癌患者的预后生存, 并有可能作为一个新的肿瘤靶向治疗的靶点.
本研究选取了一定数量的胃癌病例进行研究, 结果可信, 具有一定的学术价值.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Wang Y, Morrow JS. Identification and characterization of human SLP-2, a novel homologue of stomatin (band 7.2b) present in erythrocytes and other tissues. J Biol Chem. 2000;275:8062-8071. [PubMed] [DOI] |
| 3. | 张 立勇, 王 涛, 丁 芳, 刘 仲敏, 刘 芝华, 李 衍达. SLP-2基因在食管鳞癌中的差异表达及其生物信息学分析. 世界华人消化杂志. 2004;12:1517-1521. [DOI] |
| 4. | Wang Y, Cao W, Yu Z, Liu Z. Downregulation of a mitochondria associated protein SLP-2 inhibits tumor cell motility, proliferation and enhances cell sensitivity to chemotherapeutic reagents. Cancer Biol Ther. 2009;8:1651-1658. [DOI] |
| 5. | Stewart GW, Hepworth-Jones BE, Keen JN, Dash BC, Argent AC, Casimir CM. Isolation of cDNA coding for an ubiquitous membrane protein deficient in high Na , low K stomatocytic erythrocytes. Blood. 1992;79:1593-1601. |
| 6. | Hiebl-Dirschmied CM, Entler B, Glotzmann C, Maurer-Fogy I, Stratowa C, Prohaska R. Cloning and nucleotide sequence of cDNA encoding human erythrocyte band 7 integral membrane protein. Biochim Biophys Acta. 1991;1090:123-124. [DOI] |
| 7. | Sprenger RR, Speijer D, Back JW, De Koster CG, Pannekoek H, Horrevoets AJ. Comparative proteomics of human endothelial cell caveolae and rafts using two-dimensional gel electrophoresis and mass spectrometry. Electrophoresis. 2004;25:156-172. [PubMed] [DOI] |
| 8. | Chevallet M, Lescuyer P, Diemer H, van Dorsselaer A, Leize-Wagner E, Rabilloud T. Alterations of the mitochondrial proteome caused by the absence of mitochondrial DNA: A proteomic view. Electrophoresis. 2006;27:1574-1583. [PubMed] [DOI] |
| 9. | Hájek P, Chomyn A, Attardi G. Identification of a novel mitochondrial complex containing mitofusin 2 and stomatin-like protein 2. J Biol Chem. 2007;282:5670-5681. [PubMed] [DOI] |
| 10. | Da Cruz S, Parone PA, Gonzalo P, Bienvenut WV, Tondera D, Jourdain A, Quadroni M, Martinou JC. SLP-2 interacts with prohibitins in the mitochondrial inner membrane and contributes to their stability. Biochim Biophys Acta. 2008;1783:904-911. [PubMed] [DOI] |
| 12. | Chang D, Ma K, Gong M, Cui Y, Liu ZH, Zhou XG, Zhou CN, Wang TY. SLP-2 overexpression is associated with tumour distant metastasis and poor prognosis in pulmonary squamous cell carcinoma. Biomarkers. 2010;15:104-110. [PubMed] [DOI] |
| 16. | Cao W, Zhang B, Liu Y, Li H, Zhang S, Fu L, Niu Y, Ning L, Cao X, Liu Z. High-level SLP-2 expression and HER-2/neu protein expression are associated with decreased breast cancer patient survival. Am J Clin Pathol. 2007;128:430-436. [PubMed] [DOI] |