修回日期: 2012-05-06
接受日期: 2012-06-01
在线出版日期: 2012-07-08
目的: 探讨慢性乙型肝炎(chronic hepatitis B, CHB)肝脏微循环障碍时, 联合检测低氧诱导因子(hypoxia-inducible factor, HIF)-1α、血栓烷素(thromboxan, TX)B2、6-酮-前列腺素F1α(6-Keto-PGF1α)及透明质酸(hyaluronic acid, HA)的临床意义.
方法: 275例CHB患者肝组织标本通过肝穿刺获得, 同时留取外周血待检. 15例正常志愿者外周血来自健康体检者. 用透射电镜观察肝细胞及肝窦的超微结构变化. 用化学发光法检测血清HA, 放射免疫法检测血浆TXB2和6-Keto-PGF1α, 免疫组织化学法标记肝穿活检标本中的HIF-1α.
结果: 随着CHB肝组织病变的加重, 电镜示肝窦腔内红细胞聚集, 肝窦阻塞和狭窄明显, 狄氏腔中胶原纤维沉积及基底膜形成率逐步增多. HIF-1α在肝组织中的表达强度和范围逐渐加大, HA、TXB2逐渐上升, 6-Keto-PGF1α轻度下降.
结论: HIF-1α、TXB2、6-Keto-PGF1α及HA联合检测能较好地反映肝脏微循环障碍状况.
引文著录: 范秀梅, 丁体龙, 代学枫, 于莉, 马勇. HIF-1α、TXB2、6-Keto-PGF1α和HA联合检测在CHB肝脏微循环障碍中的诊断意义. 世界华人消化杂志 2012; 20(19): 1732-1736
Revised: May 6, 2012
Accepted: June 1, 2012
Published online: July 8, 2012
AIM: To evaluate the significance of combined detection of HIF-1α, TXB2, 6-keto-PGF1α and HA in the diagnosis of hepatic microcirculatory disturbance in patients with chronic hepatitis B (CHB).
METHODS: In total, 275 patients with CHB and 15 normal volunteer were included. The ultrastructure of the liver was observed by transmission electron microscopy (TEM). HIF-1α expression in liver biopsies was detected by immunohistochemistry. Plasma levels of TXB2 and 6-keto-PGF1α were determined by chemiluminescence, and serum HA levels was measured by RIA.
RESULTS: As the pathological changes of the liver were aggravated, erythrocyte aggregation, stenosis and blockage of sinus hepaticas, collagen fiber deposition, and basal membrane formation became worsened, the strength and range of expression of HIF-1α was enhanced, the levels of serum HA and plasma TXB2 were raised gradually, and plasma levels of 6-keto-PGF1α slightly declined.
CONCLUSION: Combined detection of HIF-1α, TXB2, 6-keto-PGF1α and HA can help accurately diagnose hepatic microcirculatory disturbance in patients with CHB.
- Citation: Fan XM, Ding TL, Dai XF, Yu L, Ma Y. Significance of combined detection of HIF-1α, TXB2, 6-keto-PGF1α and HA in the diagnosis of hepatic microcirculatory disturbance in patients with chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2012; 20(19): 1732-1736
- URL: https://www.wjgnet.com/1009-3079/full/v20/i19/1732.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i19.1732
大慢性乙型肝炎(chronic hepatitis B, CHB)肝脏微循环障碍将进一步加重肝组织损伤, 已为越来越多的学者所认同, 但肝脏微循环障碍的监测却是难点. 以往常用手指甲襞微循环检查法判断肝脏微循环障碍的程度, 但由于特异性差, 并不能准确反映肝脏微循环状况; 通过电镜进行组织学超微观察可反映组织和器官的微循环状况, 但由于价格昂贵限制了其广泛使用. 肝窦是肝脏微循环的关键部位. 因此, 本研究通过透射电镜观察肝细胞和肝窦的结构变化, 从超微结构上判断肝脏是否存在微循环障碍, 用组织病理学方法判断肝组织的病变程度, 同时观察低氧诱导因子(hypoxia-inducible factor, HIF)-1α在CHB肝组织中的表达及定位, 并检测患者血清透明质酸(hyaluronic acid, HA)、血浆血栓烷(thromboxan, TX)B2及6-酮-前列腺素F1α(6-Keto-PGF1α)与肝组织病变程度的关系, 探讨HIF-1α、HA、TXB2及6-Keto-PGF1α联合检测在CHB肝脏微循环障碍中的诊断意义.
2008-07/2010-10我中心收治的CHB患者275例, 男192例, 女83例, 年龄18-62岁, 平均年龄34.8岁. 病程1-20年, 平均11.4年. 诊断符合2000年中华医学会传染病与寄生虫病学分会和肝病学分会联合修订的"病毒性肝炎防治方案"的标准[1]. 并排除外伤和其他组织及器官的急慢性疾病. 另取15例正常人静脉血作对照. HIF-1α鼠抗人单克隆抗体购自美国Santa cruze生物技术公司(货号: sc-13515); 即用型免疫组织化学EliVisionTM plus试剂盒购自福州迈新生物技术公司(产品编号: KIT-9901/9902/9903). 透明质酸化学发光试剂购自郑州安图生物技术有限公司; TXB2及6-Keto-PGF1α放免试剂购自北京普尔伟业生物科技有限公司.
1.2.1 CHB分组: 根据光镜观察结果, 按肝组织炎症、坏死和纤维化程度, 将275例CHB患者分为3组: CHB轻度81例, CHB中度96例, CHB重度98例. 分组标准参照李玉林主编的第6版《病理学》中的标准[2].
1.2.2 标本采集及预处理: 肝组织活检标本采集, 用日本产16号肝活检针, B超引导下取出肝组织, 直径约2 mm, 长度≥1.5 cm, 肝组织标本分为2部分: 一部长度约1 mm, 用2.5%戊二醛固定, 1%四氧化锇固定, 0.1 mol/L磷酸缓冲液清洗, 梯度酒精脱水, Ep812树脂包埋, 超薄切片机切片, 醋酸铀、柠檬酸铅染色, 作透射电子显微镜观察, 剩余部分立即置于40 g/L甲醛固定(≥12 h), 石蜡包埋, 连续4 μm切片, 作HIF-1α免疫组织化学染色, 光镜观察. 各组患者分别于肝穿当日清晨空腹采静脉血2 mL作HA检测, 另取静脉血3 mL(消炎痛EDTA-Na2抗凝)作TXB2及6-Keto-PGF1α检测用.
1.2.3 免疫组织化学染色: 按试剂盒说明书操作, 慢性重度肝炎阴性对照片以PBS代替一抗制备. 结果判定方法: 黄色呈灶性分布为弱阳性(+), 深黄色呈片状分布为阳性(++)、深棕黄色呈弥漫性分布为强阳性(+++)、未着色为阴性(-).
1.2.4 HA、TXB2、6-Keto-PGF1α检测: 由专人按仪器操作规程和试剂盒说明书操作.
统计学处理 SPSS11.5统计软件进行统计分析, 试验数据采用mean±SD表示, 两两比较采用t检验, 显著性水准为P<0.05.
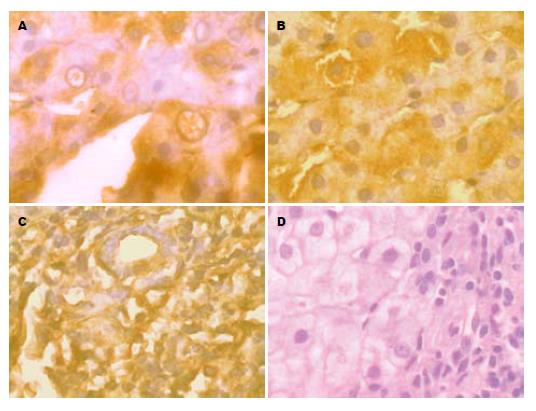
CHB轻度患者肝组织中HIF-1α呈灶性表达, 主要表达在肝细胞的胞浆部位, 多数呈弱阳性(+)表达(图1A); CHB中度患者肝组织中HIF-1α呈片状表达, 细胞核与细胞浆均有表达, 多数呈阳性(++)表达(图1B); CHB重度患者肝组织中HIF-1α呈弥漫性强阳性(+++)表达(图1C), 在肝窦毛细血管化部位表达更明显. 阴性对照片无表达(图1D).
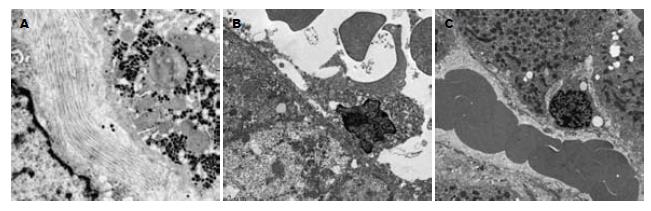
CHB轻度主要表现为炎症性损伤, 肝细胞结构基本正常, 线粒体肿胀, 内质网扩张, 嵴模糊缺失, 粗面内质网有脱颗粒现象, 部分内质网形成大泡样结构, 核膜孔逐渐消失, 核膜呈波纹状皱缩, 肝窦腔中红细胞聚集(图2A); CHB中度时, 肝细胞缺氧逐渐加重, 许多线粒体破坏, 嵴消失, 外膜破裂, 线粒体基质外溢. 同时肝细胞体积变小, 肝细胞内空泡样结构常见, 部分肝细胞已崩解, 释出胞质成份, 并可见白细胞浸润, 此时可见大量凋亡细胞, 核固缩变小或异染色质聚集. 但细胞膜性结构完整, 没有溶酶体内容物释放, 随后细胞膜出现深的皱褶, 形成"凋亡小体", 狄氏腔中有大量胶原纤维沉积(图2B); CHB重度时主要表现为微循环结构的改变, 肝窦内皮细胞窗孔减少减小, 甚至消失, 肝窦毛细血管化和基底膜形成(图2C), 肝窦毛细血管化并在门静脉与门静脉、肝静脉与门静脉、肝静脉与肝静脉之间形成广泛的吻合支, 导致肝脏微循环紊乱.
随着CHB肝组织病变的加重, 血清HA、血浆TXB2水平显著升高, 不同组别之间差异有统计学意义(P<0.05), 血浆6-Keto-PGF1α逐渐下降, 但邻组之间差异不显著(P>0.05, 表1).
急性、亚急性重型肝炎较大血管阻塞诱发肝梗塞、肝组织大片、片状坏死, 导致患者肝功能快速衰竭而死亡, CHB较小血管和毛细血管病变从轻度肝炎至活动性肝硬化始终存在, 而且血管病变的程度与肝组织病变的程度一致[3-10]. CHB肝窦病变已引起学者的关注[11-17]. 但肝窦病变导致肝脏微循环障碍所诱发的肝细胞损伤、肝组织中HIF-1α表达及血液中HA、TXB2、6-Keto-PGF1α含量变化的探讨较少. 我们通过透射电镜观察发现, CHB轻度主要表现为炎症性损伤, 肝细胞结构基本正常, 线粒体肿胀, 内质网扩张, 嵴模糊缺失, 粗面内质网有脱颗粒现象, 部分内质网形成大泡样结构, 核膜孔逐渐消失, 核膜呈波纹状皱缩, 肝窦腔中红细胞聚集; CHB中度时, 肝细胞缺氧逐渐加重, 许多线粒体破坏, 嵴消失, 外膜破裂, 线粒体基质外溢; 同时肝细胞体积变小, 肝细胞内空泡样结构常见, 部分肝细胞已崩解, 释出胞质成份, 并可见白细胞浸润, 此时可见大量凋亡细胞, 核固缩变小或异染色质聚集, 但细胞膜性结构完整, 没有溶酶体内容物释放, 随后细胞膜出现深的皱褶, 形成"凋亡小体". 狄氏腔中有大量胶原纤维沉积. CHB重度时主要表现为微循环结构的改变, 肝窦内皮细胞窗孔减少减小, 甚至消失, 肝窦毛细血管化和基底膜形成, 肝窦毛细血管化并在门静脉与门静脉、肝静脉与门静脉、肝静脉与肝静脉之间形成广泛的吻合支, 结果提示, 随着肝组织病变的加重, 肝细胞的损害及肝窦物质交换的障碍程度也随之加重. 说明肝窦病变是引起肝脏微循环障碍的重要原因. 与此同时, 肝组织中HIF-1α的表达, 随着肝窦病变的加重, 其阳性表达程度也随之增加; 血液中HA、TXB2含量随着肝窦病变的加重而升高, 6-Keto-PGF1α则轻度降低. 提示肝组织中HIF-1α的表达、血液中HA、TXB2和6-Keto-PGF1α含量变化与肝脏微循环障碍的程度有关.
肝窦是血液与肝细胞物质交换的主要场所, 肝窦内皮细胞是血液与肝细胞之间进行物质交换的屏障, 其完整性又防止了血小板的黏附及凝血因子的激活, 从而维持肝窦血液循环和物质的顺畅. HA是一种氨基多糖, 由肝间质细胞合成. 肝脏是HA的主要代谢器官, 在肝内标记的HA, 90%位于肝窦内皮细胞[18]. SEC通过受体与HA结合, 以液相胞饮的方式将HA摄入. 摄入细胞的HA主要聚集于溶酶体中, 被其中的透明质酸酶分解代谢. 慢性肝病时, SEC对HA的摄取和分解代谢功能受损, HA清除减少, 造成血清HA水平升高, 因此血清HA可准确地反映SEC的受损伤程度. 血栓素TXA2主要是由血小板微粒体合成并释放的一种强烈促进血管收缩和活化血小板的生物活性物质. 其生物半衰期约30 min, 而迅速代谢为无活性的TXB2. 前列环素(PGI2)是由血管壁内皮细胞合成和释放的一种抗血小板聚集和舒张血管的生物活性物质, 其生物半衰期约3 s, 迅速代谢生成6-Keto-PGF1α. 在生理状态下, 血浆或组织中TXA2和PGI2浓度比例处于相对平衡状态, 以保持机体内环境的稳定. 许多病理因素如高血压性肾病、肺心病、前列腺增生及外伤均可导致TXA2和PGI2平衡失调而造成血小板聚集, 血管痉挛或血栓形成[19-22]. 本研究结果提示, 血液中TXA2的代谢产物TXB2含量升高、PGI2的代谢产物6-Keto-PGF1α含量降低, 说明肝组织内TXA2分泌增多和PGI2合成减少, 提示肝脏内TXA2和PGI2平衡失调. HIF-1是在缺氧状态下特异性发挥活性的核转录因子, 广泛存在于缺氧条件下的哺乳动物和人体内, 可以调控多种靶基因, 具有多种生物学效应, 在许多缺氧性疾病的病理过程中都发挥着重要作用[23-30]. HIF-1有α、β两种亚基, HIF-1β亚基在细胞浆中稳定表达, 而HIF-1α亚基在翻译后即被泛素-蛋白酶水解复合体降解. 因此, 在正常氧饱和度下的细胞中基本检测不到α亚基的表达. CHB肝组织由于微循环障碍, 导致肝组织无法从血液循环中得到足够的氧而出现缺氧状态, 此时, α亚基的降解被抑制, 并可采用免疫组织化学的方法进行检测.
本研究表明, CHB肝窦病变包括肝窦内红细胞聚集、肝窦间隙胶原蛋白沉积、肝窦基底膜形成和肝窦内皮细胞窗孔减少或消失, 并与肝组织损伤的程度一致; 肝窦病变导致肝窦血液循环和物质交换障碍, 从而导致肝脏微循环. 在排除外伤及其他器官和组织慢性疾病的CHB患者的血液中, HA、TXB2含量升高、6-Keto-PGF1α含量降低, 肝组织中HIF-1α表达异常, 且HA、TXB2含量升高、6-Keto-PGF1α含量降低, 肝组织中HIF-1α表达异常程度与肝窦病变的程度一致. 说明联合检测血液中HA、TXB2、6-Keto-PGF1α含量变化及肝组织中HIF-1α表达程度对诊断CHB肝脏微循环障碍的程度具有可靠的临床意义. 本研究应用的检测方法特异性和灵敏度高, 与电镜观察的肝窦病变有很好的吻合度, 且实验条件要求不高, 成本较低, 大多数实验室均可开展, 值得临床进一步推广使用.
慢性乙型肝炎(CHB)存在肝脏微循环障碍是药物治疗效果不佳的一个重要原因. 因此, 在CHB治疗过程中了解其肝脏微循环状况是十分必要的. 肝脏微循环障碍的诊断与监测是一个难点, 建立一种简单易行的判断肝脏微循环状况的方法是本课题研究的意义所在.
陈建杰, 教授, 上海中医药大学附属曙光医院(东部)肝病科
低氧诱导因子(HIF)是在缺氧状态下发挥特异性活性的核转录因子, 与缺氧性疾病关系密切, 但在CHB肝组织中如何表达的报道鲜见.
HIF-1α是反映组织缺氧的指标, TXB2和6-Keto-PGF1α是反映血液循环状态的指标, HA是反映SEC受损程度的指标, 四者联合检测可大大提高诊断肝脏微循环障碍的特异性和敏感度.
本文探讨了HIF-1α、TXB2、6-Keto-PGF1α及HA联合检测在CHB肝脏微循环障碍中的诊断意义, 该方法较手指甲襞微循环检查法特异性更高, 与电镜观察结果有很好的吻合度, 且实验条件要求不高, 成本较低, 适合大多中小型医院开展.
本文题目准确反映了研究工作的科学问题和特定内容, 简明而有特色, 结论明确, 试验证据充足. 文章的科学性、创新性和可读性较强, 具有良好的临床实用价值.
编辑: 张姗姗 电编:鲁亚静
| 2. | 李 玉林. 病理学. 第6版. 北京: 人民卫生出版社 2004; 203. |
| 12. | Chevallier M, Guerret S, Chossegros P, Gerard F, Grimaud JA. A histological semiquantitative scoring system for evaluation of hepatic fibrosis in needle liver biopsy specimens: comparison with morphometric studies. Hepatology. 1994;20:349-355. [PubMed] [DOI] |
| 14. | 徐 长江, 严 家春, 马 勇, 丁 体龙, 袁 苏娜. 肝窦及窦周隙病变在慢性乙型肝炎肝微循环障碍中担当关键角色. 临床与实验病理学杂志. 2009;25:62-65. |
| 19. | 叶 建明, 郁 丽霞, 卢 国元, 陈 洪磊, 顾 晓霞, 熊 燕. 高血压性肾损害患者内皮功能及血小板活化指标的测定及其临床意义. 苏州大学学报(自然科学版). 2009;29:148-150. |
| 23. | Shannon AM, Bouchier-Hayes DJ, Condron CM, Toomey D. Tumour hypoxia, chemotherapeutic resistance and hypoxia-related therapies. Cancer Treat Rev. 2003;29:297-307. [PubMed] [DOI] |
| 24. | Blancher C, Harris AL. The molecular basis of the hypoxia response pathway: tumour hypoxia as a therapy target. Cancer Metastasis Rev. 1998;17:187-194. [PubMed] [DOI] |
| 25. | Adams JM, Difazio LT, Rolandelli RH, Luján JJ, Haskó G, Csóka B, Selmeczy Z, Németh ZH. HIF-1: a key mediator in hypoxia. Acta Physiol Hung. 2009;96:19-28. [PubMed] [DOI] |
| 26. | Lei L, Mason S, Liu D, Huang Y, Marks C, Hickey R, Jovin IS, Pypaert M, Johnson RS, Giordano FJ. Hypoxia-inducible factor-dependent degeneration, failure, and malignant transformation of the heart in the absence of the von Hippel-Lindau protein. Mol Cell Biol. 2008;28:3790-3803. [PubMed] [DOI] |
| 27. | Weidemann A, Klanke B, Wagner M, Volk T, Willam C, Wiesener MS, Eckardt KU, Warnecke C. Hypoxia, via stabilization of the hypoxia-inducible factor HIF-1alpha, is a direct and sufficient stimulus for brain-type natriuretic peptide induction. Biochem J. 2008;409:233-242. [PubMed] [DOI] |
| 28. | Zhao HX, Wang XL, Wang YH, Wu Y, Li XY, Lv XP, Zhao ZQ, Zhao RR, Liu HR. Attenuation of myocardial injury by postconditioning: role of hypoxia inducible factor-1alpha. Basic Res Cardiol. 2010;105:109-118. [PubMed] [DOI] |
| 29. | Malhotra R, Tyson DW, Rosevear HM, Brosius FC. Hypoxia-inducible factor-1alpha is a critical mediator of hypoxia induced apoptosis in cardiac H9c2 and kidney epithelial HK-2 cells. BMC Cardiovasc Disord. 2008;8:9. [PubMed] [DOI] |
| 30. | Chen SM, Li YG, Zhang HX, Zhang GH, Long JR, Tan CJ, Wang DM, Fang XY, Mai RQ. Hypoxia-inducible factor-1alpha induces the coronary collaterals for coronary artery disease. Coron Artery Dis. 2008;19:173-179. [PubMed] [DOI] |