修回日期: 2012-04-29
接受日期: 2012-05-31
在线出版日期: 2012-06-28
目的: 研究藤梨根提取物(ethanol extract from radix of actinidia chinensis, EERAC)对人大肠癌LoVo细胞增殖和凋亡的影响.
方法: 提取藤梨根抗癌有效活性成分(EERAC), 按浓度分为4处理组(10、40、160、320 mg/L)和空白对照组(0 mg/L). 各实验组经作用24、48、72 h后, 进行一般形态学和AO/EB荧光染色观察; MMT法检测细胞增殖的抑制情况; 免疫组织化学(immunohistochemistry, IHC)法测定LoVo细胞中凋亡相关基因Bcl-2、Bax、Caspase-3的蛋白表达变化.
结果: 与空白对照组比较, 一般形态学显示EERAC处理组能使细胞密度减低, 增殖变慢; 细胞逐渐变大, 细胞间接触变松, 胞浆中颗粒增多, 细胞脱壁现象和周围碎片增多; 荧光染色观察可见处理组细胞呈橙红色荧光, 细胞核出现碎片状或固缩状的凋亡特征学形态改变, 凋亡现象与EERAC的浓度呈正相关性; MTT法检测显示, EERAC处理组对LoVo细胞的最佳作用时间为72 h, 最大抑制率为79.48%, 具有浓度和时间的依赖性(P<0.01); IHC检测结果显示EERAC作用LoVo细胞24 h后, Bcl-2表达明显减弱, Bax、Caspase-3表达水平明显增高, Bcl-2/Bax比值下降, 差异具有统计学意义(P<0.05), 其效应与浓度相关.
结论: EERAC具有明显抑制LoVo细胞增殖的作用, 其机制可能与降低Bcl-2表达, 上调Bax、Caspase-3的表达水平, 激活线粒体凋亡途径有关.
引文著录: 陈永杰, 史仁杰. 藤梨根提取物对大肠癌LoVo细胞增殖的抑制作用及诱导凋亡的影响. 世界华人消化杂志 2012; 20(18): 1657-1661
Revised: April 29, 2012
Accepted: May 31, 2012
Published online: June 28, 2012
AIM: To explore the regulatory effect of ethanol extract from radix of Actinidia chinensis (EERAC) on cell proliferation and apoptosis in human colon carcinoma cell line LoVo.
METHODS: LoVo cells were divided into four treatment groups (10, 40, 160, 320 mg/L EERAC) and blank control group. After treatment for different durations, the morphological alterations of LoVo cells were observed by inverse microscopy and AO/EB fluorescent staining, cell proliferation was detected by MTT assay, and the expression of apoptosis-related proteins Bcl-2, Bax and Caspase-3 was detected by immunohistochemistry.
RESULTS: Compared to the control group, EERAC treatment reduced cell density, slowed down cell growth, gradually increased cell size, and resulted in an increase in the number of particles in the cytoplasm and the occurrence of cell detachment. Fluorescence staining showed that treated cells emitted an orange-red fluorescence and showed typical apoptotic features such as nuclear fragmentation and pyknotic nuclei. Apoptosis was positively correlated with EERAC concentrations. MTT assay showed that the optimal duration of action was 72 h in EERAC treatment group, and the maximal inhibition rate was 79.48%. The inhibitory effect was concentration- and time-dependent. ICH results showed that the expression of Bcl-2 and the ratio of Bcl-2/Bax were obviously decreased, while the expression levels of Bax and Caspase-3 were significantly increased after treatment for 24 h (P < 0.05).
CONCLUSION: EERAC can significantly inhibit LoVo cell proliferation possibly via mechanisms associated with decreasing Bcl-2 expression and increasing Bax and Caspase-3 expression.
- Citation: Chen YJ, Shi RJ. Ethanol extract from radix of Actinidia chinensis inhibits cell proliferation and induces apoptosis in human colon carcinoma cell line LoVo. Shijie Huaren Xiaohua Zazhi 2012; 20(18): 1657-1661
- URL: https://www.wjgnet.com/1009-3079/full/v20/i18/1657.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i18.1657
中药藤梨根味咸、酸、涩, 性凉, 无毒, 具有清热解毒、祛风除湿、利尿止血的功效, 在中医"癌毒"[1]和"湿热致病"学说的指导下, 常用于治疗各种恶性肿瘤. 据临床报道, 朱秀山等[2]使用藤梨根为主药的昭黄散, 治疗72例胃癌患者(经诊断不能进行手术), 疗效与5-Fu相当, 能明显提高生存质量和延长生存时间, 不良反应明显小于西药对照组. 田林等[3]应用MTT比色法检测藤梨根乙酸乙酯提取物在不同浓度及不同时间对人食管癌Eca-109细胞生长作用, TUNEL法检测其对癌细胞生长的诱导凋亡效应, 发现藤梨根乙酸乙酯提取物对人食管癌Eca-109细胞的生长抑制作用随着药物浓度的升高和作用时间的延长而增强. 藤梨根乙酸乙酯提取物提取物对人食管癌Eca-109细胞具有明显的凋亡效应. 基于上述的研究基础, 本实验将观察藤梨根提取物(ethanol extract from radix of actinidia chinensis, EERAC)对大肠癌LoVo细胞增殖的作用和凋亡相关蛋白的影响, 并探讨其可能的作用机制.
藤梨根提取物根据中国科学院化学研究所公布的藤梨根抗癌有效活性成分醇提取工艺(专利公开号: CN1977869A), 由中国药科大学生命科学院实验中心制备; 人大肠癌LoVo细胞株购自中国科学院上海细胞库; 兔抗小鼠多抗(Caspase-3、Bcl-2、Bax抗体稀释度1:80)、生物素标记羊抗兔IgG、胎牛血清、RPMI 1640培养基、0.25%胰酶、DAB显色试剂盒、叮啶橙(AO)、澳乙咙(EB)、MTT, Bcl-2、Bax、Caspase-3抗体(鼠抗人多抗), 生物素IgG、倒置显微镜、24孔/96孔培养板及细胞培养瓶、Elx800 多功能酶标仪.
1.2.1 藤梨根抗癌有效活性成分的制取: 根据专利技术的提取流程进行酒精溶解, 回流提取, 色谱分离, 梯度洗脱, 最后将所得干燥提取物100 g, 用蒸馏水调配成50、100、200 mg/L药物浓度, 分装, 置4 ℃冰箱备用.
1.2.2 藤梨根有效活性成分醇提取物的质量控制: 用醋酐浓硫酸反应和泡沫实验加以鉴定, 符合三萜皂苷类反应特征的该次提取物作为本实验用药.
1.2.3 HPLC(高效液相色谱)指纹图谱鉴定: 采用国际公认的, 能反应中药样品整体化学特征的HPLC-DAD指纹图谱技术, 对10批次的藤梨根样品进行了分析研究. 结果显示, HPLC-DAD获得的指纹图谱峰值、趋势一致, 显示本实验使用的中药藤梨根各批次化学成分稳定均一, 具有可重复性.
1.2.4 EEEAC对LoVo细胞形态学的观察: 一般形态学观察: LoVo细胞生长于含100 mL/L新生牛血清RPMI l640培养液中, 并置37 ℃恒温、50 mL/L CO2及饱和湿度的培养箱中培养. 细胞呈单纯贴壁生长. 每2-3 d传代1次. 取对数生长期的LoVo细胞以0.25%胰蛋白酶消化吹打制成细胞悬液, 按所需浓度接种使用, 用倒置显微镜观察96孔培养板内0、10、40、160、320 mg/L EERAC作用LoVo细胞24 h后, 各培养孔内的细胞形态、结构变化并拍照. AO/EB荧光染色观察: (1)LoVo细胞在100 mL/L胎牛血清的RPMI l640培养液中稳定培养24 h, 经倒置显微镜观察, 确认其生长稳定及状态良好; (2)用纯RPMI l640, 配制成5×104/mL细胞悬液, 滴加入孔板中, 每孔0.1 mL, 每个剂量组设6个复孔, 分别加入终浓度为10、40、160、320 mg/L的EERAC溶液0.1 mL, 滴加时间为24、48、72 h; (3)各时间段, 加入EERAC后的第2天需更换同浓度的培养基1次, 总体积不能超过200 μL; (4)在24、48、72 h停止使用EERAC后, 去除培养基, 各实验组加入2 μL的AO染液(100 mg/L)及2 μL EB染液(100 mg/L), 迅速转入荧光显微镜观察并拍照.
1.2.5 EERAC对LoVo细胞增殖的抑制作用: MTT比色法: 先同1.2.4中荧光观察实验, 然后在24、48、72 h停止使用EERAC后, 去除培养基, 加入5 g/L的MTT 20 μL, 再返回正常培养条件下培养4 h; 去掉孔内培养液, 加入100 μL的DMSO充分振荡10 min, 用酶联免疫检测仪测定测定吸光度(A)值, 激发波长为570 nm. 细胞生长抑制率 = (1-实验组A570 nm值/对照组A570 nm值)×100%.
1.2.6 免疫组织化学法测定各组细胞中凋亡相关基因Bcl-2、Bax、Caspase-3的蛋白表达: 细胞培养、传代同实验1.2.4, 在进行测定前, 用倒置显微镜观察各组培养孔内细胞形态结构的状况, 确认其生长稳定及状态良好后予各浓度的EERAC处理. 24 h后进行以下操作: (1)用40 g/L多聚甲醛(PFA)固定细胞分布, 室温搁置20 min, 之后用 PBS平衡液洗3遍; (2)0.3%的Triton(溶于PBS)通透细胞, 约室温30 min; (3)PBS平衡液漂洗3次, 每次3 min; (4)用5%羊血清, 置室温下封闭30 min; (5)将Caspase-3、Bcl-2、Bax抗体按1:80稀释, 孵育, 4 ℃放置12 h; (6)PBS浸洗5次, 每次5 min; (7)生物素IgG 37 ℃下孵育, 0.5 h; (8)PBS浸洗5次, 每次5 min; (9)孵育37℃, 进行SP反应, 0.5 h; (10)PBS浸洗5次, 每次5 min; (11)DAB显色: 3-10 min; (12)苏木素伊红复染、石蜡封装玻片、倒置显微镜下观察; (13)PBS浸洗5次, 每次5 min; 倒置显微镜下观察并拍照; (14)采用Image-Pro Plus 6.0图像分析系统, 计算积分吸光度(IA)值.
统计学处理 SPSS17.0分析, 数据以mean±SD表示, 计量资料用t检验, 计数资料用χ2检验分析, 多组间比较用方差分析, 百分数用U检验.
2.1.1 一般形态学: (1)空白对照组细胞生长旺盛, 呈高亮状, 胞体丰满, 在24、48、72 h时间段的形态变化不大; (2)EERAC组细胞数量随着药物浓度的增加而增殖减慢, 增殖也时间延长, 细胞形态与对照组相比, 逐渐变小并呈灰暗状, 有脱落漂浮现象, 甚至可见到细胞膜破裂; (3)随着EERAC作用时间增长, 浓度增高, 漂浮细胞逐渐增多. ERAC的最高浓度组320 mg/L, 还可见到大量悬浮的细胞碎片.
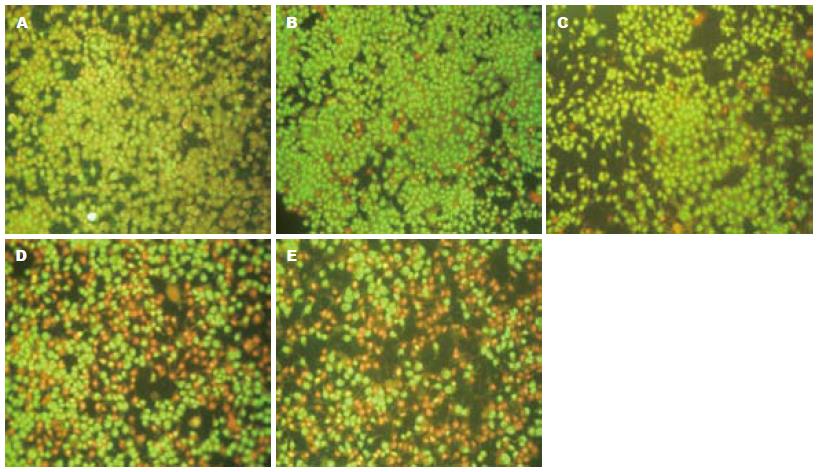
2.1.2 荧光染色: 细胞经EERAC作用24 h后, 进行AO/EB荧光染色, 各处理组均发生典型的细胞凋亡形态学改变, 早期为绿色荧光显现, 细胞核为碎片状、固缩状, 晚期为显示橙红色荧光, 细胞核亦出现碎片状或固缩状. 空白组细胞为绿色荧光显现, 形态均匀正常. 凋亡现象与EERAC的浓度呈正相关性(图1).
不同浓度EERAC作用LoVo细胞24、48、72 h后, 能不同程度地抑制细胞增殖, 其抑制作用与药物浓度和作用时间具有依赖性特点. 与空白组对比, EERAC各实验组对LoVo细胞生长抑制率, 差异均有统计学意义(P<0.01, 表1), 其中以320 mg/L浓度的实验组在72 h时抑制率最高, 达到79.48%.
| 分组 | 浓度(mg/L) | 24 h | 48 h | 72 h | |||
| A | IR(%) | A | IR(%) | A | IR(%) | ||
| EERAC | 10 | 0.448±0.001a | 19.82 | 0.598±0.081b | 6.25 | 0.562±0.019b | 23.75 |
| 40 | 0.339±0.021a | 37.85 | 0.235±0.042b | 47.35 | 0.274±0.010b | 63.40 | |
| 160 | 0.224±0.027b | 60.92 | 0.241±0.037b | 64.84 | 0.218±0.008b | 70.91 | |
| 320 | 0.163±0.081b | 70.13 | 0.142±0.019b | 76.86 | 0.141±0.013b | 79.48 | |
| 空白对照组 | 0 | 0.532±0.012 | 0 | 0.654±0.087 | 0 | 0.758±0.007 | 0 |
经作用24 h后, 与对照组相比, EERAC各实验组LoVo细胞内的Bax蛋白水平表达呈上升趋势(除10 mg/L组外, 40 mg/L组P<0.05, 160、320 mg/L组均为P<0.01), 而Bcl-2的表达下降(P<0.01), Bcl-2/Bax比例下降, Caspase-3表达水平明显升高(P<0.01), 且均呈现浓度依赖性, 其中以320 mg/L浓度的变化最为显著(P<0.01, 表2).
肿瘤的特点就是无限增殖、生长, 一般认为肿瘤细胞是从正常细胞演变而来, 正常细胞转变为恶性肿瘤的过程为癌变. 凋亡是一种细胞自主性、程序性的死亡过程, 属于一种类似"细胞自杀"的生命现象, 对于维护人体内环境的稳定和抑制肿瘤的形成和发展具有重要的意义. 细胞在凋亡过程中可通过出现特殊的形态学和生物化学特征而被研究者获悉[4]. 本研究发现EERAC能使LoVo细胞发生细胞变圆, 体积变小, 细胞核固缩, 核内色素沉着的一般形态学改变, 还能在AO/EB荧光染色观察下发现凋亡典型特性显像-橙红色细胞, 随着浓度的增加而越来越多, 表明EERAC具有LoVo细胞凋亡的作用, 诱导且具有时效和量效关系.
MTT法自20世纪60年代末发现以来, 能客观评价活细胞的生存和增殖的状况[5], 并逐渐成为抗肿瘤药物筛选的重要检测途径[6-8]. 本实验采用MTT法来确定EERAC对LoVo细胞细胞增殖的抑制, 发现其最佳作用时间为72 h, 最大抑制率为79.48%, 表明EERAC具有明显的抑制LoVo细胞增殖的作用且作用特点具有浓度和时间的依赖性.
在细胞凋亡的过程中, 是一个多基因参与的复杂的生命过程[9], Bcl-2是一种原癌基因, 具有促进细胞增殖和突变的作用, 在细胞凋亡过程中负调控作用[10,11], 而Bax为凋亡促进基因, 对Bcl-2基因有重要的调节作用[12-14], Caspase-3是细胞凋亡线粒体途径中信号转导通路的核心效应分子,可以导致细胞发生一系列凋亡形态和生化改变[15,16]. 本实验结果表明EERAC处理LoVo细胞后, Bcl-2表达水平降低, 而Bax表达增强, 从而导致与凋亡密切相关的Bcl-2/Bax比值下降. 与此同时, EERAC还能上调Caspase-3表达水平, 激活细胞的线粒体凋亡途径.
本研究中, 证实EERAC具有抑制LoVo细胞增殖和诱导凋亡的作用, 其机制可能与EERAC抑制癌变正调控基因Bcl-2的蛋白表达, 上调抑癌基因Bax 、Caspase-3的蛋白表达、降低Bcl-2/Bax的比值有关, 其抑瘤作用可能与激活细胞线粒体凋亡途径相关. 从EERAC对LoVo细胞的形态学影响、增殖抑制作用、调控凋亡相关蛋白的方面, 为应用中药藤梨根临床治疗大肠癌提供客观的实验依据.
大肠癌是最常见的消化系肿瘤之一, 对人类健康的威胁性极大, 中药藤梨根是大肠癌术后常用的有效药物, 其抗癌的机制尚未完全明确; Bcl-2, Bax, Capase-3属调控肿瘤增殖与凋亡的重要调控基因, 可在一定程度上反应抗肿瘤药物的内在机制.
徐列明, 教授, 上海中医药大学附属曙光医院(东部)肝二科
肛肠科常用中药藤梨根, 经临床实践证明, 有着较好的抗肿瘤作用, 其疗效确切, 越来越受到人们关注, 藤梨根抗肿瘤的化学成分和药理作用虽已有初步的研究, 但其有效部位、作用机制缺乏系统的药理跟踪研究.
本文从细胞形态学和凋亡相关基因Bcl-2、Bax、Caspase-3的蛋白表达变化, 观察藤梨根提取物(EERAC)在体外实验中对大肠癌LoVo细胞的抑制及诱导凋亡的作用, 并探讨其可能的作用机制.
癌毒学说: 中医认为, 癌毒是恶性肿瘤的一个重要致病因素, 其形成与饮食、外感、情志等有关, 皆可导致癌病的发生, 又可作为一个病理产物, 进一步使病邪深重不解.
本研究观察EER-AC对人大肠癌细胞增殖凋亡的影响, 并探讨其可能机制, 为中医治疗临床大肠癌提供了一定参考.
编辑: 曹丽鸥 电编:闫晋利
| 5. | Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983;65:55-63. [PubMed] [DOI] |
| 6. | Dung TD, Chang HC, Binh TV, Lee MR, Tsai CH, Tsai FJ, Kuo WW, Chen LM, Huang CY. Zanthoxylum avicennae extracts inhibit cell proliferation through protein phosphatase 2A activation in HA22T human hepatocellular carcinoma cells in vitro and in vivo. Int J Mol Med. 2012;29:1045-1052. [PubMed] |
| 7. | Yamazaki M, Yamashita Y, Kubo N, Yashiro M, Ohira M, Ako E, Tanaka H, Muguruma K, Sawada T, Hirakawa K. Concurrent biological targeting therapy of squamous cell carcinoma of the esophagus with cetuximab and trastuzumab. Oncol Rep. 2012;28:49-54. [PubMed] |
| 8. | Jia XQ, Cheng HQ, Li H, Zhu Y, Li YH, Feng ZQ, Zhang JP. Inhibition of connective tissue growth factor overexpression decreases growth of hepatocellular carcinoma cells in vitro and in vivo. Chin Med J (Engl). 2011;124:3794-3799. [PubMed] |
| 10. | Zhang H, Li Y, Huang Q, Ren X, Hu H, Sheng H, Lai M. MiR-148a promotes apoptosis by targeting Bcl-2 in colorectal cancer. Cell Death Differ. 2011;18:1702-1710. [PubMed] [DOI] |
| 11. | Zhang MS, Hu AH, Qiu H, Xiong HH, Chen Y. The correlation between IGF-II and Bcl-2 expression in colorectal adenocarcinoma. Med Oncol. 2012;29:928-932. [PubMed] [DOI] |
| 12. | Anvari K, Seilanian Toussi M, Kalantari M, Naseri S, Karimi Shahri M, Ahmadnia H, Katebi M, Sedighi Pashaki A, Dayani M, Broumand M. Expression of Bcl-2 and Bax in advanced or metastatic prostate carcinoma. Urol J. 2012;9:381-388. [PubMed] |
| 13. | Zhong ZG, Wu DP, Huang JL, Liang H, Pan ZH, Zhang WY, Lu HM. Progallin A isolated from the acetic ether part of the leaves of Phyllanthus emblica L. induces apoptosis of human hepatocellular carcinoma BEL-7404 cells by up-regulation of Bax expression and down-regulation of Bcl-2 expression. J Ethnopharmacol. 2011;133:765-772. [PubMed] [DOI] |
| 14. | Wang W, Lu J, Zhu F, Wei J, Jia C, Zhang Y, Zhou L, Xie H, Zheng S. Pro-apoptotic and anti-proliferative effects of mitofusin-2 via Bax signaling in hepatocellular carcinoma cells. Med Oncol. 2012;29:70-76. [PubMed] [DOI] |
| 15. | Sabine VS, Faratian D, Kirkegaard-Clausen T, Bartlett JM. Validation of activated caspase-3 antibody staining as a marker of apoptosis in breast cancer. Histopathology. 2012;60:369-371. [PubMed] [DOI] |
| 16. | Li S, Tian D, Fei P, Gao Y, Chen Z, Wang Q, Tong Q. A cyclooxygase-2 inhibitor NS-398-enhanced apoptosis of esophageal carcinoma cell EC9706 by adjusting expression of survivin and caspase-3. Cancer Invest. 2011;29:102-106. [PubMed] [DOI] |