修回日期: 2012-02-07
接受日期: 2012-04-17
在线出版日期: 2012-06-18
自身免疫性肝炎(autoimmune hepatitis, AIH)是临床上较常见的非病毒性肝炎类型, 干燥综合征、桥本甲状腺炎也是常见的自身免疫性疾病, 但合并以上3种自身免疫性疾病的病例较为少见. 该文报道和回顾了1例以白细胞减少起病的AIH合并干燥综合征、桥本甲状腺炎的临床表现、诊断治疗过程, 在临床工作过程中应注意非病毒性肝炎合并其他自免疾病的可能, 提高诊疗质量.
引文著录: 戴敏, 赵鹏, 贝明龙, 张国强. 自身免疫性肝炎合并干燥综合征、桥本甲状腺炎伴白细胞减少1例. 世界华人消化杂志 2012; 20(17): 1585-1587
Revised: February 7, 2012
Accepted: April 17, 2012
Published online: June 18, 2012
Autoimmune hepatitis (AIH) is a clinically common type of non-viral hepatitis. Sjogren syndrome (SS) and Hashimoto's thyroiditis (HT) are common autoimmune diseases. However, AIH complicated by SS and HT, which starts with leucopenia, rarely occurs. Here we report such a case and performed a literature review to summarize its clinical manifestations, diagnosis and treatment. Attention should be paid to the possibility of AIH complicated by other autoimmune diseases.
- Citation: Dai M, Zhao P, Bei ML, Zhang GQ. Autoimmune hepatitis complicated by Sjogren syndrome and Hashimoto thyroiditis with leukopenia: A report of one case. Shijie Huaren Xiaohua Zazhi 2012; 20(17): 1585-1587
- URL: https://www.wjgnet.com/1009-3079/full/v20/i17/1585.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i17.1585
自身免疫性肝炎(autoimmune hepatitis, AIH)是临床上较常见的非病毒性肝炎类型, 其总发病率占世界人口的3%-5%. AIH通常可以伴随着肝外表现, 如关节炎、自身免疫性甲状腺炎等. 干燥综合征、桥本甲状腺炎也是常见的自身免疫性疾病, 但合并以上3种自身免疫性疾病的病例较为少见. 该文报道和回顾了1例以白细胞减少起病的AIH合并干燥综合征、桥本甲状腺炎的临床表现、诊断治疗过程, 旨在为临床上相关疾病的诊疗提供一些依据和参考.
女, 45岁, 因发现白细胞减少2年, 乏力、纳差、尿黄1 mo, 入院. 患者于2009年发热、咳嗽, 被诊断为"肺炎"住院治疗, 查白细胞(white blood cells, WBC)2.8×109/L, 2010年单位体检WBC 2.9×109/L, 肝功能正常. 1 mo前出现乏力、纳差、尿黄. 于外院查血常规: WBC 2.94×109/L, 中性粒细胞(neutrophils, N)48.7%, 淋巴细胞(lymphocyte, L)33.3%, 血红蛋白(hemoglobin, HB)106 g/L, 血小板(platelet, PLT)108×109/L; 功能: 总胆红素(total bilirubin, TBIL)109.8 μmol/L, 直接胆红色素(DBIL)77.4 μmol/L, 丙氨酸氨基转移酶(alanine aminotransferase, ALT)433.6 IU/L, 天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)693.3 IU/L, 白蛋白(albumin, ALB)43.4 g/L, 球蛋白(globulin, GLB)40.9 g/L; 尿分析: 胆红素17 μmol/L. 甲乙丙丁戊肝炎病毒抗体阴性, 考虑"肝炎"予保肝退黄治疗, 乏力、尿黄稍有改善, 纳差依旧, 3 d前出现发热, 双下肢出现大小不等红斑伴瘙痒, 全身其他处散在分布, 转入我院. 追问病史患者有口干、眼干史半年, 否认病毒性肝炎史, 家族中无类似患者.
查体: T 37.6 ℃, BP 128/84 mmHg, 神志清, 皮肤巩膜中度黄染, 双肺未闻及干湿啰音. 心率70次/分, 律齐. 腹平坦, 无压痛, 肝肋下未及, 剑突下3 cm, 质软, 表面光滑, 边缘钝, 无压痛. 脾脏肋下未扪及, Murpy征阴性, 移动性浊音阴性, 双下肢大小不等斑丘疹.
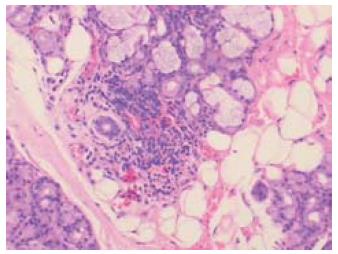
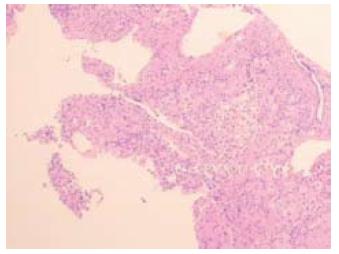
辅助检查: 查WBC 3.04×109/L, L 51.3%, HB 109 g/L, PLT 117×109/L. TBIL 78.1 μmol/L, DBIL 42.5 μmol/L, ALT 120 IU/L, AST 140 IU/L, GLB 44.8 g/L, ALB 25.6 g/L, γ谷氨酰基转移酶(γ-GT)95 IU/L. IgG 34.2 g/L, IgA 4.44 g/L, 补体C3 653 mg/L, C4正常. 抗HAV-IgM阴性, 甲乙丙丁戊肝炎病毒抗体均阴性. 纤维5项: 透明质酸酶(hyaluronidase, HA)128.61 μg/L, 层粘连蛋白(laminin, LN)77.04 μg/L, Ⅳ型胶原77.91 μg/L, Ⅲ型Ⅹ胶原209.54 μg/L. 抗核抗体(ANA): 1:320阳性, 核浆颗粒型. 抗平滑肌抗体均阴性. Coomb's试验弱阳性; 血小板抗体IgA弱阳性. 凝血6项: 凝血酶原时间(prothrombin time, PT)16.0 s, 国际标准化比值(international normalized ratio, INR)1.39, 部分凝血活酶时间(partial thromboplastin time, APTT)46.8 s, 凝血酶时间(thrombin time, TT)20.1 s. 甲状腺功能7项测定: 甲状腺过氧化物酶抗体(AntiTPO)424.91 IU/mL, 血清总甲状腺素(total thyroxine, TT4)9.17 μg/dL, 血清总三碘甲状腺原氨酸(TT3)0.96 ng/dL, 游离三碘甲状腺原氨酸(FT3)2.06 pg/L, 游离甲状腺素(FT4)0.93 ng/dL, 甲状腺球蛋白抗体(Anti Tg) 139.71 IU/mL, 促甲状腺激素(thyroid stimulating hormone, TSH)15.2446 IU/mL. 甲状腺彩超: 甲状腺弥漫性改变伴左叶小结节. SS-A阳性, SS-B阳性, Ro-S2阳性. 干眼症3项: BUT、Shirmer's试验阳性; 唇腺病理: 唇腺小叶内见淋巴细胞团浸润, 符合干燥综合征(Ⅱ级, 图1). MRCP: 肝硬化可能, 肝右叶异常信号, 轻度脾肿大. 上腹增强CT: 轻度肝硬化、脾肿大、肝脏异常强化. 胸部CT: 右肺中下叶小结节, 两侧腋窝多发小淋巴结. 骨髓涂片: 基本正常. B超下行肝右叶穿刺病理: 肝板周围小汇管区淋巴浆细胞浸润(图2).
入院诊断: AIH合并干燥综合征、桥本甲状腺炎. 给予甲泼尼龙40 mg/d、还原型谷胱甘肽2.4 g/d静脉滴注, 熊去氧胆酸胶囊0.25 g Tid, 口服, 补充甲状腺素、白蛋白和补钙对症治疗. 2 wk后患者体温正常, 无明显乏力、纳差, 尿色正常. 查体: 巩膜轻度黄染, 全身红斑消退, 呼吸音清, 心律齐, 肝区无叩痛, 肝脾肋下未触及. 复查血常规: WBC 5.2×109/L, N 66.2%, L 25.6%, Hb 115 g/L, PLT 126×109/L. 肝功能: TBIL 43.3 μmol/L, DBIL 24.5 μmol/L, ALT 55 IU/L, AST 46 IU/L, GLB 41.8 g/L, ALB 24.5 g/L, γ-GT 91 IU/L. 出院口服泼尼松龙片, 早30 mg, 晚10 mg/d.
出院2 wk后随访调整为甲泼尼龙片, 早24 mg, 晚8 mg/d, 逐渐减量. 4 mo后复查血常规正常, 肝功能: TBIL 10.1 μmol/L, DBIL 5.3 μmol/L, AST 26 g/L, ALB 29.3 g/L, GLB 29.9 g/L, γ-GT 21 IU/L, 血常规正常. 加用免疫抑制剂硫唑嘌呤维持治疗.
根据2008年Hennes等[1]对AIH确诊的简化评分系统评分: ANA≥1:80(2分), IgG≥1.1倍正常上限(2分), 病理肝板周围小汇管区淋巴细胞浸润(1分), 排除病毒性肝炎(2分), 总分7分, AIH确诊. 根据干燥综合征(Sjogren syndrome, SS)、桥本甲状腺炎(Hashimoto's thyroiditis, HT)诊断标准, 结合上述临床资料, SS、HT诊断明确. 此3种自身免疫病(autoimmune disease, AID)首选肾上腺皮质激素, HT需加甲状腺素替代治疗. AIH症状缓解后需减量, 必要时加用免疫抑制剂硫唑嘌呤, 与SS、HT的治疗不矛盾.
随着对AID认识的提高, 临床经验积累和实验室技术的进步, AID的发病率明显上升, 其总发病率占世界人口的3%-5%. AIH通常可以伴随着肝外表现, 如关节炎、自身免疫性甲状腺炎等. 干燥综合征是一种主要侵犯外分泌腺的慢性自身免疫性疾病[2], 女性多见, 其可累及其他组织器官如肝、肾、肺、血液、关节等.
上述3种AID同时合并较为罕见, 王娜等[3]曾有1例报道. 本例伴白细胞减少、双下肢皮疹, 更为罕见. 临床上可能由于对其缺乏认识而导致无法确诊甚至误诊误治, 早期诊断治疗有助于病情缓解. 结合本例我们有如下体会: (1)临床中青年女性出现白细胞减少伴肝功能异常, 也需考虑自身免疫性疾病可能; (2)干燥综合征对造血系统有影响, 表现为白细胞减少或(和)血小板减少, 激素使用后可缓解. 本例双下肢出现皮疹伴瘙痒、发热, 考虑干燥综合征伴过敏性紫癜可能; (3)在临床工作中, 我们应注意AIH合并其他多种自身免疫性疾病的可能, 病理检查可对其进行确诊. 本例患者白细胞减少2年后确诊, 予激素治疗, 预后良好, 故提供此病例, 引起重视, 以望提高诊疗质量.
生物型和混合型生物人工肝由于引入肝细胞, 在一定程度上能够替代肝脏的合成、解毒和代谢功能, 而受到广泛关注. 但迄今为止尚未出现一种肝细胞能够完全满足生物人工肝的需要.
唐世刚, 教授, 湖南省人民医院
最理想的生物人工肝反应器中的细胞材料应该具备成熟肝细胞的所有生物合成、代谢解毒功能, 但迄今为止尚未出现一种肝细胞能够完全满足生物人工肝的需要.
构建好的C3A-未优势化细胞系表达CYP 3A4和GST A1的含量和活性均有所增加, 功能亦有所改善, 有望成为生物人工肝系统的细胞材料.
该研究设计合理, 实验技术成熟, 实验结果可信, 对生物人工肝系统的临床应用提供了较好的参考价值.
编辑: 张姗姗 电编:鲁亚静
| 1. | Hennes EM, Zeniya M, Czaja AJ, Parés A, Dalekos GN, Krawitt EL, Bittencourt PL, Porta G, Boberg KM, Hofer H. Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatalogy. 2008;48:169-176. [PubMed] [DOI] |
| 2. | Thanou-Stavraki A, James JA. Primary Sjogren's syndrome: current and prospective therapies. Semin Arthritis Rheum. 2008;37:273-292. [PubMed] [DOI] |