修回日期: 2012-03-14
接受日期: 2012-03-28
在线出版日期: 2012-06-18
目的: 探讨环氧化酶-2(cyclooxygenase-2, COX-2)基因启动子区的-1195(G/A, rs689466)及3'非翻译区的8473(T/C, rs5275)2个位点的基因多态性与结直肠癌(colorectal cancer, CRC)发病风险的相关性.
方法: 采用病例-对照研究, 利用聚合酶链式反应和限制性片段长度多态性(polymerase chain reaction-restrictive fragment length polymorphism, PCR-RFLP)分析方法, 对343例CRC患者和340例健康人的COX-2基因的2个位点的多态性进行检测, 采用SPSS11.0软件包统计分析各位点的基因型分布和等位基因频率.
结果: COX-2-8473位点多态性的各基因型频率在病例组及对照组中分布均无显著差异(P>0.05), 但COX-2-1195位点多态性的基因型频率在二组中分布有显著性差异(P<0.001), 结果显示CRC患者COX-2-1195AG基因型在病例组的频率较对照组显著增高(校正后OR = 2.23; 95%CI: 1.50-3.32), AA基因型在病例组中的频率亦较对照组高(校正后OR = 2.46; 95%CI: 1.51-4.02), A等位基因携带者在病例组中的频率高于对照组(校正后OR = 2.27; 95%CI: 1.55-3.34). 各基因型分布在结肠癌及直肠癌中的分布无显著性差异(P>0.05). COX-2-1195A等位基因与淋巴结转移及TNM分期有显著相关性.
结论: COX-2-1195位点AG/AA基因型是CRC的风险因素, 且与CRC的淋巴结转移及TNM分期相关.
引文著录: 张颖, 刘长明, 彭惠平, 张剑治, 蔡晓琴, 冯全林. 环氧化酶-2基因启动子区多态性与结直肠癌的易感性. 世界华人消化杂志 2012; 20(17): 1579-1584
Revised: March 14, 2012
Accepted: March 28, 2012
Published online: June 18, 2012
AIM: To investigate the correlation between polymorphisms in the promoter region (-1195G/A, rs689466) and 3'-untranslated region (8473T/C, rs5275) of the cyclooxygenase-2 (COX-2) gene and risk of colorectal cancer (CRC).
METHODS: A case-control study was performed in 343 patients with CRC and 340 healthy individuals. The polymerase chain reaction and restriction fragment length polymorphism (PCR-RFLP) method was used to genotype the COX-2-1195G/A and COX-2-8473T/C polymorphisms. The SPSS 10.0 software was used to analyze genotypic and allelic frequencies.
RESULTS: We found no differences in allele or genotype distributions of COX-2-8473T/C between cases and controls (all P > 0.05). However, there was an obvious difference in the polymorphism distribution of COX-2-1195G/A between the CRC group and control group (P < 0.001). Stratification analysis revealed a significantly increased risk in CRC patients carrying the AG genotype (adjusted OR = 2.23; 95% CI 1.50-3.32), AA genotype (adjusted OR = 2.46; 95% CI 1.51-4.02) or (AG/AA) genotype (adjusted OR = 2.27; 95% CI 1.55-3.34) compared to the control group. There was no difference in the distribution of each COX-2 genotype between colon and rectal cancer. Patients carrying the COX-2-1195A allele had a higher risk of lymph node metastasis and CRC progression.
CONCLUSION: COX-2-1195AG/AA genotype is associated with a higher risk of CRC, lymph node metastasis and CRC progression.
- Citation: Zhang Y, Liu CM, Peng HP, Zhang JZ, Cai XQ, Feng QL. Relationship between polymorphisms in the promoter region of the COX-2 gene and susceptibility to colorectal cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(17): 1579-1584
- URL: https://www.wjgnet.com/1009-3079/full/v20/i17/1579.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i17.1579
结直肠癌(colorectal cancer, CRC)是常见的消化系恶性肿瘤, 发生率仅次于胃癌和食管癌. 在我国常见恶性肿瘤死亡中CRC在男性占第5位, 女性占第6位. 随着我国生活水平的不断提高, 人们的生活方式也有了很大变化, CRC发病率呈明显上升趋势. 分子流行病学证实肿瘤发生与个体的遗传背景及环境的交互作用关系密切, 90%CRC的发生是环境因素与遗传因素交互作用的结果. 近年来研究显示, 环氧化酶-2(cyclooxygenase-2, COX-2)在一些肿瘤中存在过度表达现象, 提示COX-2可能与肿瘤的发生发展密切相关[1]. COX-2位于染色体1q25.2-q25.3, 包括10个内含子和9个外显子. 位于COX-2 3'非翻译区的8473T>C(rs5275)位点可影响调节蛋白的结果进而对COX-2 mRNA的稳定性及表达产生影响[2]. 亦有研究显示, COX-2启动子区的-1195G>A(rs689466)变异形成1个转录因子c-Myb结合位点, 且A等位基因与COX-2的高表达相关[3]. 因此探讨COX-2启动子区的基因多态性与CRC发生的相关性有着重要的理论意义. 本研究拟采用病例-对照的分子流行病学方法, 用聚合酶链式反应和限制性片段长度多态性(polymerase chain reaction-restrictive fragment length polymorphism, PCR-RFLP)技术对COX-2基因-8473和-1195位点的基因多态性与CRC发生的相关性进行研究, 并旨在探讨COX-2基因多态性与CRC发生的关系.
2007-08/2011-03收集于江苏省昆山市中医院的进行手术并经病理确诊的CRC患者343例设为病例组, 最大年龄为93岁, 最小年龄为30岁, 平均年龄为63.22岁±12.29岁, 男女性别比为230:113. 选取同期到医院参加体检健康的340名志愿者设为健康对照组, 最大年龄为91岁, 最小年龄为44岁, 年龄平均为62.47岁±11.20岁, 男女性别比为212:128. 收集研究人群的基本资料, 包括吸烟、饮酒及CRC组的病理资料, 临床分期采用国际抗癌协会UICC 1987年的TNM分期法. DNA提取试剂盒购自美国Gentra公司; DNA聚合酶由大连Takara公司提供; 限制性内切酶Pvu Ⅱ和BclⅠ购自Ferments Life Sciences公司; 引物由上海Invitrogen有限公司合成; Mastercycler gradient PCR购自德国Eppendorf公司; UVP EC3 Imaging System购自美国UVP公司.
1.2.1 标本采集及基因组DNA提取: 经研究对象知情同意后, 采集静脉血置于3 mL EDTA抗凝管中, 离心去血清后在剩下的细胞中加入300 mL人红细胞裂解液, 混匀震荡3 min溶解红细胞, 10 000 g离心30 s, 沉淀白细胞, 加入细胞裂解液后按Gentra公司说明书提取DNA.
1.2.2 COX-2基因多态性检测: 采用PCR-RFLP技术分析COX-2基因启动子区的-1195G>A位点及3'非翻译区8473T>C位点的基因多态性. PCR扩增的引物序列依次为: COX-2 1195G>A F: 5'TCTCACCCTCACATGCTCCT3', R: 5'TCTTTTCTGTCCACTTTTCCA3'; COX-2 8473T>C F: 5'AGAATTTTAAAGTACTTTTAGT3', R: 5'CTTTTACAGGTAGTTCTACCC3'. 2个PCR反应体系均为50 μL, 包括以下组分: 10×Buffer 5.0 μL, MgCl2 3.0 μL, dNTPs 4.0 μL, 上下游引物各1.0 μL, DNA聚合酶1.25 U, 模板50 ng, 灭菌双蒸馏水补足反应体积至50 μL. 扩增条件为94 ℃ 45 s, 54 ℃(COX-2-8473)或55 ℃(COX-2-1195)45 s, 72 ℃ 45 s, 共40个循环. PCR产物分别用Pvu Ⅱ和BclⅠ酶切, 体系均为PCR产物10 μL, 酶10 U, 10×Buffer Tango 3.0 μL, 灭菌双蒸馏水补足反应体积至30 μL, 水浴37 ℃过夜. 3%琼脂糖凝胶电泳鉴定结果, 同时选取10%样本进行重复检测.
统计学处理 用SPSS11.0软件包进行统计学分析. 计算各组等位基因和基因型频率的分布, χ2检验分析各组等位基因和基因型频率分布的差异, 并通过比数比(OR)计算进行相关性分析.
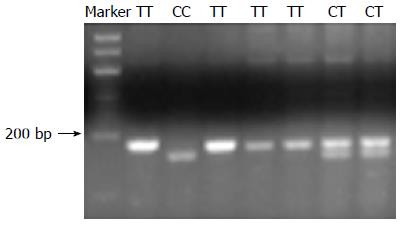
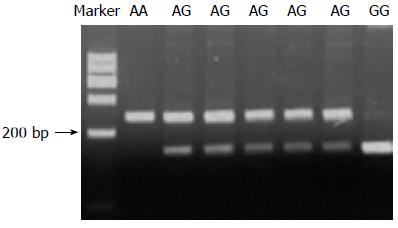
COX-2-8473位点的PCR产物为177 bp, 经BclⅠ酶切电泳后产生156 bp、21 bp 2个片段为CC型, 产生177 bp、156 bp、21 bp 3个片段为TC型(图1); COX-2-1195位点的PCR产物为237 bp, 经Pvu Ⅱ酶切后仅有237 bp为AA基因型, 含有237 bp、164 bp、73 bp 3个片段为AG基因型, 而含有164 bp、73 bp 2个片段为GG基因型(图2); 计算以上位点的多态性基因型分布, 经检验对照组基因型分布符合Hardy-Weinberg遗传平衡, 可认为研究人群来自于平衡群体, 具有群体代表性.
研究人群基本特征所示, 在性别、年龄、吸烟、饮酒特征上没有显著性差异(表1). CRC组的病理特征如表1所示.
| CRC组 | 对照组 | P值 | |
| 年龄(岁) | 63.22±12.29 | 62.47±11.20 | 0.408 |
| 性别 | |||
| 男 | 230(67.06) | 212(62.35) | 0.198 |
| 女 | 113(32.94) | 128(37.65) | |
| 吸烟情况 | 0.535 | ||
| 不吸烟 | 247(72.01) | 252(74.12) | |
| 吸烟 | 96(27.99) | 88(25.88) | |
| 饮酒情况 | 0.463 | ||
| 不饮酒 | 276(80.47) | 281(82.65) | |
| 饮酒 | 67(19.53) | 59(17.35) | |
| 分化程度 | |||
| 高、中 | 212(61.81) | ||
| 低 | 131(38.19) | ||
| 淋巴结转移 | |||
| 无转移 | 182(53.06) | ||
| 有转移 | 161(46.94) | ||
| TNM分期 | |||
| Ⅰ | 76(22.16) | ||
| Ⅱ | 73(21.28) | ||
| Ⅲ | 89(25.95) | ||
| Ⅳ | 105(30.61) |
COX-2-8473的各基因型频率在对照组与病例组之间均无显著差异(P>0.05). 但COX-2-1195 AG基因型在病例组中的分布频率显著高于对照组(校正后OR = 2.23; 95%CI 1.50-3.32), AA基因型在病例组中的频率亦较对照组高(校正后OR = 2.46; 95%CI 1.51-4.02), A等位基因携带者在病例组中的频率高于对照组(校正后OR = 2.27; 95%CI 1.55-3.34, 表2).
| 基因型 | 病例组n(%) | 对照组n(%) | OR(95%CI) | OR(95%CI)1 | P值 |
| COX-2-8473 | |||||
| TT | 218(63.56) | 202(59.41) | 1.00 | 1.00 | 0.533 |
| TC | 105(30.61) | 115(33.82) | 0.85(0.61,1.17) | 0.84(0.60,1.16) | |
| CC | 20(5.83) | 23(6.76) | 0.81(0.43,1.51) | 1.35(0.63,2.90) | |
| TC/CC | 125(36.44) | 138(40.59) | 0.83(0.62,1.14) | 0.82(0.43,1.57) | |
| COX-2-1195 | |||||
| GG | 50(14.58) | 94(27.65) | 1.00 | 1.00 | 0.000 |
| AG | 216(62.97) | 184(54.12) | 2.21(1.49,3.28) | 2.23(1.50,3.32) | |
| AA | 77(22.45) | 62(18.24) | 2.33(1.45,3.77) | 2.46(1.51,4.02) | |
| AG/AA | 293(85.42) | 246(72.35) | 2.24(1.53,3.28) | 2.27(1.55,3.34) |
COX-2-8473的各基因型频率在病例组及对照组中的频率分布没有显著性差异(P>0.05), 且在结肠癌及直肠癌中分布也没有显著性差异(P>0.05); COX-2-1195 AG及AA基因型在结肠癌及直肠癌中的频率均高于对照组, 在结肠癌及直肠癌中分布频率没有显著性差异(表3).
| 基因型 | 对照组n(%) | 结肠癌 | 直肠癌 | ||
| n(%) | OR(95%CI)1 | n(%) | OR(95%CI)1 | ||
| COX-2-8473 | |||||
| TT | 202(59.41) | 136(64.15) | 1.00 | 82(62.60) | 1.00 |
| TC | 115(33.82) | 68(32.08) | 0.83(0.57,1.21) | 37(28.24) | 0.80(0.50,1.26) |
| CC | 23(6.76) | 8(3.77) | 0.52(0.22,1.22) | 12(9.16) | 1.12(0.43,2.95) |
| TC /CC | 138(40.59) | 76(35.85) | 0.77(0.54,1.10) | 49(37.40) | 1.41(0.65,3.07) |
| COX-2-1195 | |||||
| GG | 94(27.65) | 30(14.15) | 1.00 | 20(15.27) | 1.00 |
| AG | 184(54.12) | 134(63.21) | 2.28(1.43,3.65) | 82(62.59) | 2.11(1.22,3.67) |
| AA | 62(18.24) | 48(22.64) | 2.63(1.49,4.67) | 29(22.13) | 2.23(1.15,4.34) |
| AG/AA | 246(72.35) | 182(85.85) | 2.34(1.48,3.69) | 111(84.73) | 2.13(1.25,3.64) |
COX-2-1195各基因型在高、中分化及低分化CRC组与对照组的分布频率均有显著性差异(P<0.05), 高、中分化程度与低分化程度组间没有显著性差异(P = 0.360); COX-2-1195各基因型在淋巴结转移组与对照组的分布有显著性差异(P<0.001), 而在无淋巴结转移组与对照组中的分布频率没有显著性差异(P = 0.061); 基因型分布在淋巴结转移组及无转移组间有显著性差异(P = 0.015). 在与TNM分期的分组比较中结果显示, COX-2-1195基因型在Ⅰ-Ⅱ期组与对照组的分布没有显著性差异(P = 0.260), 而在Ⅲ-Ⅳ组中各基因型与对照组中的分布频率有显著性差异(P<0.001); 且COX-2-1195各基因型在Ⅰ-Ⅱ期及Ⅲ-Ⅳ期组间分布有显著性差异(P<0.001, 表4).
| 病理特征 | n | COX-2-1195 G>A基因型分布 | |||
| GG | AG/AA | OR(95% CI)1 | P值 | ||
| 对照组 | 94 | 246 | 1.00 | ||
| 分化程度 | 0.360 | ||||
| 高、中 | 212 | 28 | 184 | 2.50(1.56, 4.02) | <0.001 |
| 低 | 131 | 22 | 109 | 1.92(1.35, 3.25) | 0.020 |
| 淋巴结转移 | 0.015 | ||||
| 无转移 | 182 | 36 | 146 | 0.99(0.99,2.41) | 0.061 |
| 有转移 | 161 | 14 | 147 | 6.25(3.48,11.30) | <0.001 |
| TNM分期 | <0.001 | ||||
| Ⅰ-Ⅱ | 149 | 33 | 115 | 1.35(0.82,2.12) | 0.260 |
| Ⅲ-Ⅳ | 194 | 17 | 177 | 2.65(1.48,4.62) | <0.001 |
COX-2是催化花生四烯酸产生前列腺素族的关键限速酶之一, 正常生理状态下表达甚少, 而在各种刺激因子存在时表达增加[4]. 近年来研究显示COX-2在包括CRC在内的一些肿瘤中存在过度表达现象, 提示COX-2在CRC的发生过程中起着重要作用. 研究显示COX-2的基因多态性与多肿瘤发生相关[5-7], 本文采用PCR-RFLP技术对343例CRC患者和340例健康人进行病例-对照研究, 探讨COX-2基因多态性与CRC的易感性关系, 并分析其与CRC患者病理特点相关性. 研究结果显示COX-2启动子区-1195位点的基因多态性与CRC的发病风险相关, A等位基因是CRC的风险因素, 且A等位基因与淋巴结转移和TNM分期有显著相关性.
COX-2基因多态性有种族差异, 不同种族中基因型的频率不同, 本研究的COX-2-1195基因型在对照组中的分布与Zhang等[3]在中国汉族人群中开展的食管癌研究中的对照组结果相一致(GG: 22.5%, AG: 53.4%, AA: 24.1%). COX-2-1195 A等位基因是肿瘤发生的危险因素, 在包括胃癌[8]、食管癌[9]、胰腺癌[10]及胆囊癌[11]中都得到了证实. COX-2启动子含有多个转录因子的结合位点, 有研究报道COX-2-1195的G>A突变形成了1个c-Myb转录因子结合位点, 增强了COX-2的启动子活性, 进而提高了其转录活性, A等位基因与高水平的COX-2转录相关[3]. 而其高表达可以通过多种途径促进肿瘤的形成, 其中最为关注的是COX-2高表达可使金属蛋白酶-2活性增加, 膜金属蛋白酶表达增多, 有利于癌肿侵袭淋巴结而发生转移. 本研究也显示高表达基因型(AG/AA)与CRC的淋巴结转移及TNM分期相关, 可能与这一机制相关. 陈志刚等[12]对118例CRC样本进行分析, 结果显示COX-2高表达与淋巴结转移及肿瘤的分期相关, 本研究结果与之相一致. 本研究对3'非翻译区的8473 T>C基因多态性与CRC的发病风险性分析结果表明, 该基因多态性与CRC的发病风险无相关性, 结果与Siezen等[13]及Cox等[14]报道相一致.
之前研究学者始终将结肠癌与直肠癌统一为CRC, 然而结肠和直肠不管是在胚胎学、解剖学, 生理学还是在遗传学上都有不同[15], 研究表明结肠癌和直肠癌的发病机制尚存在差异. 本研究还对病例组针对CRC的不同部位进行了分层分析, 此前我们开展的一项研究亦显示CRC与基因多态性的发生有部位的特异性[16], 但在此研究中我们没有发现结肠癌与直肠癌对于COX-2基因多态性存在显著性差异, 提示COX-2的表达对于CRC的发生没有部位特异性, 现有研究未见相关的报道, 有待于进一步证实.
本研究对COX-2基因启动子区多态性与CRC发病风险进行了探讨, 但仍存在有一些不足的地方, 首先是研究虽然纳入了CRC患者343例, 但进行分层分析来说样本量相对较少, 可能会对研究结果产生影响. 总之, 本研究结果表明, COX-2-1195AG/AA基因型是CRC的风险因素, 且与CRC的淋巴结转移及TNM分期有显著相关性, 此研究有助于阐明CRC易感性的分子基础, 为CRC的预防提供了实验依据.
随着我国生活水平的不断提高, 人们的生活方式也有了很大变化, 结直肠癌(CRC)发病率呈明显上升趋势. 其中. 90%CRC的发生是环境因素与遗传因素交互作用的结果.
李革, 副教授, 延边大学附属医院
环氧化酶-2(COX-2)在一些肿瘤中存在的过度表达现象与肿瘤的发生发展密切相关, COX-2基因多态性因影响其功能与多种肿瘤相关.
本研究拟采用病例-对照的分子流行病学方法, 用 PCR-RFLP技术对COX-2基因多态性与CRC发生的相关性进行研究, 具有一定创新性.
本研究分析COX-2的基因多态性与CRC发生风险及肿瘤的生物学特征, 有助于阐明结肠癌易感性的分子基础, 为结肠癌的预防提供了实验依据.
本文有较好的创新性, 方法先进, 得出很有意义的结论, 为结肠癌的预防提供了实验依据.
编辑: 张姗姗 电编:鲁亚静
| 1. | Romano M, Claria J. Cyclooxygenase-2 and 5-lipoxygenase converging functions on cell proliferation and tumor angiogenesis: implications for cancer therapy. FASEB J. 2003;17:1986-1995. [PubMed] [DOI] |
| 2. | Dixon DA. Dysregulated post-transcriptional control of COX-2 gene expression in cancer. Curr Pharm Des. 2004;10:635-646. [PubMed] [DOI] |
| 3. | Zhang X, Miao X, Tan W, Ning B, Liu Z, Hong Y, Song W, Guo Y, Zhang X, Shen Y. Identification of functional genetic variants in cyclooxygenase-2 and their association with risk of esophageal cancer. Gastroenterology. 2005;129:565-576. [PubMed] |
| 4. | Gasparini G, Longo R, Sarmiento R, Morabito A. Inhibitors of cyclo-oxygenase 2: a new class of anticancer agents? Lancet Oncol. 2003;4:605-615. [PubMed] [DOI] |
| 5. | Liang Y, Liu JL, Wu Y, Zhang ZY, Wu R. Cyclooxygenase-2 polymorphisms and susceptibility to esophageal cancer: a meta-analysis. Tohoku J Exp Med. 2011;223:137-144. [PubMed] [DOI] |
| 6. | Liu F, He Y, Peng X, Wang W, Yang X. Association of the 8473T& gt; C cyclooxygenase-2 (COX-2) gene polymorphism with lung cancer risk in Asians. Asian Pac J Cancer Prev. 2010;11:1257-1262. [PubMed] |
| 7. | Liu JL, Liang Y, Wang ZN, Zhou X, Xing LL. Cyclooxygenase-2 polymorphisms and susceptibility to gastric carcinoma: a meta-analysis. World J Gastroenterol. 2010;16:5510-5517. [PubMed] [DOI] |
| 8. | Liu F, Pan K, Zhang X, Zhang Y, Zhang L, Ma J, Dong C, Shen L, Li J, Deng D. Genetic variants in cyclooxygenase-2: Expression and risk of gastric cancer and its precursors in a Chinese population. Gastroenterology. 2006;130:1975-1984. [PubMed] [DOI] |
| 9. | Guo Y, Zhang X, Tan W, Miao X, Sun T, Zhao D, Lin D. Platelet 12-lipoxygenase Arg261Gln polymorphism: functional characterization and association with risk of esophageal squamous cell carcinoma in combination with COX-2 polymorphisms. Pharmacogenet Genomics. 2007;17:197-205. [PubMed] [DOI] |
| 10. | Zhao D, Xu D, Zhang X, Wang L, Tan W, Guo Y, Yu D, Li H, Zhao P, Lin D. Interaction of cyclooxygenase-2 variants and smoking in pancreatic cancer: a possible role of nucleophosmin. Gastroenterology. 2009;136:1659-1668. [PubMed] [DOI] |
| 11. | Srivastava K, Srivastava A, Pandey SN, Kumar A, Mittal B. Functional polymorphisms of the cyclooxygenase (PTGS2) gene and risk for gallbladder cancer in a North Indian population. J Gastroenterol. 2009;44:774-780. [PubMed] [DOI] |
| 12. | 陈 志刚, 魏 嘉, 禹 立霞, 钱 晓萍, 刘 宝瑞. 环氧化酶-2单核苷酸多态性与结直肠癌生物学行为的相关性研究. 南京医科大学学报(自然科学版). 2009;29:963-966. |
| 13. | Siezen CL, Bueno-de-Mesquita HB, Peeters PH, Kram NR, van Doeselaar M, van Kranen HJ. Polymorphisms in the genes involved in the arachidonic acid-pathway, fish consumption and the risk of colorectal cancer. Int J Cancer. 2006;119:297-303. [PubMed] [DOI] |
| 14. | Cox DG, Pontes C, Guino E, Navarro M, Osorio A, Canzian F, Moreno V. Polymorphisms in prostaglandin synthase 2/cyclooxygenase 2 (PTGS2/COX2) and risk of colorectal cancer. Br J Cancer. 2004;91:339-343. [PubMed] |