修回日期: 2012-03-16
接受日期: 2012-05-18
在线出版日期: 2012-06-18
目的: 检测sFRP-1在不同胰腺组织(正常胰腺导管、胰腺导管腺癌及癌前病变胰腺上皮内瘤变和胰腺导管内乳头状粘液性肿瘤)中的表达水平, 分析其在胰腺癌发生过程中的作用, 为胰腺癌的临床诊疗提供新线索.
方法: 免疫组织化学SP法检测sFRP-1在21灶正常胰腺导管(normal pancreatic duct, NP), 73灶胰腺上皮内瘤变(pancreatic intraepithelial neoplasia-1, PanIN-1), 29灶PanIN-2, 16灶PanIN-3, 20例胰腺导管内乳头状粘液性肿瘤(IPMN-adenoma, IPMA), 13例(IPMN-borderline, IPMB), 19例(IPMN-carcinoma, IPMC)及50例胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)中的表达, 并分析sFRP-1的表达与临床病理特征及患者术后生存期的关系.
结果: sFRP-1的免疫组织化学评分在由NP导管→PanIN-1→PanIN-2、PanIN-3、PDAC及NP→IPMA、IPMB→IPMC→PDAC的逐级进展过程中逐渐升高, sFRP-1的表达与肿瘤分化程度、神经浸润显著相关.
结论: sFRP-1的异常表达是PDAC发生中的早期事件, sFRP-1高表达是PDAC神经浸润的重要分子特征.
引文著录: 满晓华, 王伟, 王世峰, 高军, 龚燕芳, 李兆申. sFRP-1在胰腺导管腺癌中的表达及其临床意义. 世界华人消化杂志 2012; 20(17): 1520-1525
Revised: March 16, 2012
Accepted: May 18, 2012
Published online: June 18, 2012
AIM: To detect the expression of secreted frizzled-related protein 1 (sFRP1) protein in different pancreatic tissues (normal pancreatic duct, NP; pancreatic ductal adenocarcinoma, PDAC; pancreatic intraepithelial neoplasia, PanIN; and intraductal papillary mucinous neoplasm, IPMN) and evaluate its significance in the carcinogenesis of PDAC.
METHODS: Immunohistochemical detection of sFRP1 protein was performed in 21 foci of NP, 73 foci of PanIN-1, 29 foci of PanIN-2, 16 foci of PanIN-3, 20 cases of IPMN-adenoma (IPMA), 13 cases of IPMN-borderline (IPMB), 19 cases of IPMN-carcinoma (IPMC), and 50 cases of PDAC. The correlation between sFRP1 expression and clinicopathologic characteristics of PDAC was analyzed.
RESULTS: Immunohistochemical score (IHCS) of sFRP1 expression escalated with the severity of tissue atypia along the progressive multistage: NP→PanIN-1→PanIN-2, PanIN-3, PDAC or NP→IPMA, IPMB→IPMC, PDAC. sFRP1 expression was significantly associated with tumor differentiation and neural infiltration.
CONCLUSION: sFRP-1 expression enhancement is an early event in the carcinogenesis of PDAC, representing an important molecular characteristic of neural infiltration.
- Citation: Man XH, Wang W, Wang SF, Gao J, Gong YF, Li ZS. Clinical significance of sFRP1 protein expression in pancreatic ductal adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(17): 1520-1525
- URL: https://www.wjgnet.com/1009-3079/full/v20/i17/1520.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i17.1520
近年来, 研究发现Wnt信号通路在细胞转运、细胞凋亡及生物发育等生命过程中发挥重要作用[1-3], 其异常活化与多种人类疾病[4,5]及肿瘤[6-8]的发生密切相关, 已经成为肿瘤发病机制研究的热点. 并且已有研究证实Wnt信号通路在胰腺组织发育及肿瘤形成中起到重要作用, 经典的Wnt/β-Catenin信号不仅是胰腺前内胚层及外分泌腺形成的关键因素[9-11], 而且其异常活化促进了胰腺癌的进展[12-14], 这些研究为进一步揭示胰腺癌发病机制、探寻新的分子诊疗靶标提供了有力线索. 分泌型卷曲相关蛋白(secreted frizzled-related proteins, sFRPs)是重要的Wnt受体拮抗剂, 他可以在细胞外阻断异常的Wnt信号, 从而抑制肿瘤细胞的增殖, 诱导肿瘤细胞凋亡[15,16]. sFRP-1是sFRPs家族重要成员, 被证实参与了乳腺癌、宫颈癌、结直肠癌、前列腺癌、肺癌、膀胱癌等多种人类肿瘤的发生过程. 大多研究认为sFRP-1基因的表观遗传改变和表达下调是Wnt通路异常活化的重要原因[17-25], 因此sFRP-1被疑似为一种新的抑癌基因, 成为肿瘤治疗研究的新靶点. 目前, sFRP-1在胰腺癌中的作用机制仍不清楚.
本研究通过免疫组织化学方法检测sFRP-1蛋白在不同胰腺组织包括正常胰腺导管(normal pancreatic duct, NP)、胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)及癌前病变胰腺上皮内瘤变(pancreatic intraepithelial neoplasia-1, PanINs)和胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm, IPMN)中的表达, 分析其在胰腺癌逐级进展过程中的表达变化及其与PDAC临床病理指标的相关性, 初步揭示sFRP-1在PDAC发病中的作用, 为PDAC发病机制及临床诊疗研究提供新线索.
收集2001-2010年我院的胰腺组织标本, 其中NP 12例(尸检9例、胰腺外伤1例、脾亢1例、异位胰腺1例)、IPMN 52例; 另从我院病理科获赠胰腺癌组织芯片1片、PanIN芯片3片. 胰腺癌组织芯片共计198个组织点, 包含病例及随访资料完整的PDAC 50例; 3张PanIN芯片共计466个组织点, 包含PanIN共118灶, PanIN-1、PanIN-2、PanIN-3分别为73、29和16灶, PanIN与IPMN的分级诊断参照郑建明等[26]、Tanaka等[27]的分级方法.
收集50例PDAC患者临床病例资料, 主要包括患者年龄、性别、肿瘤大小、肿瘤部位、神经浸润、血管浸润、分化程度、增殖活性、T分期、淋巴转移、远处转移及TNM分期(国际胰腺癌TNM分期, UICC 2002年标准); 并随访了50例患者, 计算了术后生存期. 石蜡4 μm连续切片, 使用兔抗人多克隆sFRP-1抗体(Abcam, ab4193, 工作浓度1:1 000)行SP法染色. NP、PanIN仅统计导管上皮细胞及其阳性细胞数, IPMN统计导管内细胞及其阳性细胞数, 每例标本至少随机观察5-10个高倍视野(×400). sFRP-1染色结果以阳性细胞数及染色强度判定: 阳性细胞数<25%记1分, 25%-50%记2分, 50%-75%记3分, >75%记4分; 无染色记0分, 弱阳性记1分, 中等阳性记2分, 强阳性记3分. 两者的乘积作为每例标本的免疫组织化学评分(immunohistochemical score, IHCS).
统计学处理 采用SPSS13.0软件进行, 不同病变组之间sFRP-1的IHCS比较采用单变量方差分析; sFRP-1的表达与临床病理特征的相关性分析采用χ2检验; sFRP-1的表达与患者生存期的关系采用Kaplan-Meier法并行long-rank检验, 所有统计均以双尾P<0.05为显著性判断标准.
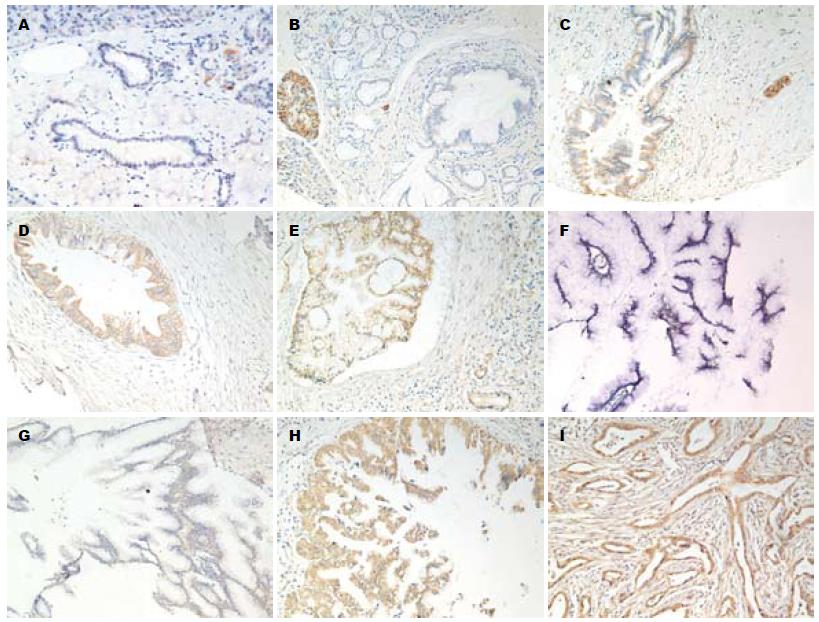
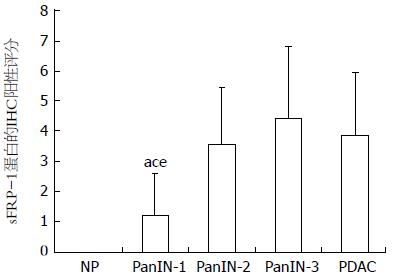
sFRP-1蛋白在正常胰腺导管上皮细胞中不表达(图1A), 而在个别正常胰腺腺泡及胰岛细胞中可呈现棕黄色均质的胞浆表达. sFRP-1蛋白在PanIN-1A中开始出现弱阳性表达, 并随组织异型程度增加表达逐渐增强(图1B-E). 比较各组sFRP-1 IHCS时发现, 高级别瘤变组PanIN-2、PanIN-3中sFRP-1表达明显高于低级别组PanIN-1(3.59±1.842, 4.44±2.366 vs 1.22±1.387, P<0.05), 而PanIN-2、PanIN-3、PDAC(3.86±2.065)之间无明显差异(P>0.05, 图2).
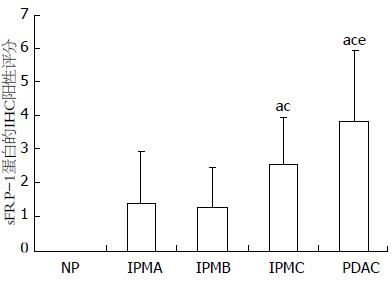
sFRP-1在IPMA中开始出现弱阳性表达, 随组织异型程度增高其表达逐渐增强(图1F-H). 比较各组sFRP-1的IHCS时发现: IPMC(2.59±1.387)组显著高于IPMB和IPMA组, PDAC(3.86±2.065)组高于IPMC组(P<0.05, 图3).
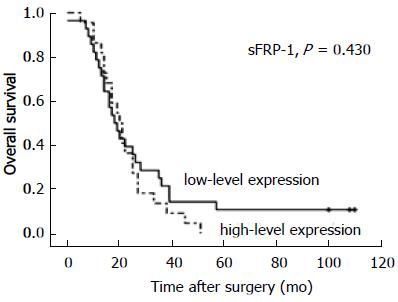
PDAC中sFRP-1的IHCS第75百分位数(P75)为4, 选取P75 = 4作为sFRP-1高低表达的临界值, 结果显示, sFRP-1的表达与肿瘤分化程度、神经浸润有关(P<0.05), 与患者年龄、性别、肿瘤大小、肿瘤部位、血管浸润、增殖活性、T分期、淋巴转移、远处转移及TNM分期无关(P>0.05); 高分化组与低分化组的高表达率明显高于中分化组, 神经浸润组的高表达率明显高于对照组(57% vs 27%, P<0.05, 表1). sFRP-1的表达与患者的生存期无明显相关, 低表达组的中位生存期为20 mo(95%CI: 15.403, 24.597), 而高表达组中位生存期为18 mo (95%CI: 12.814, 23.186, P = 0.430, 图4).
| 临床病理指标 | n | sFRP-1 | P值 | |
| 低表达 | 高表达 | |||
| 年龄 | 0.068 | |||
| <60 | 18 | 7 | 11 | |
| ≥60 | 32 | 11 | 11 | |
| 性别 | 0.144 | |||
| 男 | 26 | 12 | 14 | |
| 女 | 24 | 16 | 8 | |
| 肿瘤部位 | 0.251 | |||
| 头 | 38 | 23 | 15 | |
| 体尾 | 12 | 5 | 7 | |
| 肿瘤大小(cm) | 0.962 | |||
| <4 | 18 | 10 | 8 | |
| ≥4 | 32 | 18 | 14 | |
| 神经浸润 | 0.035 | |||
| 有 | 28 | 12 | 16 | |
| 无 | 22 | 16 | 6 | |
| 血管浸润 | 0.144 | |||
| 有 | 24 | 16 | 8 | |
| 无 | 26 | 12 | 14 | |
| 分化程度 | 0.02 | |||
| 高 | 11 | 4 | 7 | |
| 中 | 31 | 22 | 9 | |
| 低 | 8 | 2 | 6 | |
| 增殖活度 | 0.775 | |||
| 高 | 18 | 10 | 8 | |
| 中 | 16 | 8 | 8 | |
| 低 | 16 | 10 | 6 | |
| T分期 | 0.709 | |||
| T2 | 11 | 5 | 6 | |
| T3 | 30 | 18 | 12 | |
| T4 | 9 | 5 | 4 | |
| 淋巴转移 | 0.451 | |||
| 无 | 44 | 26 | 18 | |
| 有 | 6 | 2 | 4 | |
| 远处转移 | 0.437 | |||
| 无 | 46 | 27 | 19 | |
| 有 | 4 | 1 | 3 | |
| TNM 分期 | 1 | |||
| Ⅰ+Ⅱ | 39 | 22 | 17 | |
| Ⅲ+Ⅳ | 11 | 6 | 5 | |
| 总计 | 50 | 28 | 22 | |
肿瘤信号通路是一个非常复杂的网络系统, 大部分情况下并非独立发挥作用. 同样Wnt信号通路在肿瘤的形成过程中也受到其他调节因子的正向或负向调控, 通过与其他信号通路之间的相互作用, 共同调节基因的转录和表达. 越来越多的研究表明, 分泌型Wnt受体拮抗剂sFRPs家族成员在Wnt信号传导中发挥重要作用, 他可以在细胞外阻断异常的Wnt信号通路, 从而抑制肿瘤细胞的增殖、诱导肿瘤细胞凋亡[15,16].
sFRPs分子结构最重要的特征是位于N-末端的半胱氨酸富集区(cysteine rich domain, CRD), 他包含10个保守的半胱氨酸残基与一些其他的保守残基, 与Wnt受体(frizzled, Fz)蛋白的CRD区域有30%-50%的序列相似. sFRPs通过CRD区域与Wnt配体结合, 也可能与Fz受体相互作用形成无功能的复合物, 从而阻断Wnt信号通路[28-30].
sFRP-1已被发现参与了人类多种肿瘤的发病过程. sFRP-1基因定位于染色体8p11.2上, 该位点在多种肿瘤中存在缺失现象, 因此sFRP-1基因被疑似为一种抑癌基因. 其编码的Wnt信号通路抑制因子sFRP-1失活可导致Wnt信号转导途径的紊乱, 影响肿瘤的发生发展. 近年来, 关于sFRP-1基因在乳腺癌、结直肠癌、前列腺癌、肺癌、膀胱癌等多种人类肿瘤发病机制中的研究报道越来越多, 大多学者认为sFRP-1基因的表观遗传改变和表达下调是Wnt通路异常活化的重要原因.
目前, 关于sFRP-1基因在胰腺疾病中的研究较少, 但已有证据表明sFRP-1基因在胰腺的生理功能及胰腺肿瘤的发生中起到了作用. Heller等[31]研究认为, Wnt信号通路中Wnt、Frizzled、sFRP、DKK等多条基因在成人胰腺的生理功能方面发挥重要作用. Zou等[32]研究发现, sFRP基因甲基化发生于胰腺癌、肺癌、结肠癌、黑色素瘤等多种人类肿瘤. 然而, sFRP-1基因在胰腺肿瘤中的具体作用机制及其蛋白表达水平鲜有报道.
本研究采用免疫组织化学方法检测了sFRP-1蛋白在PDAC及其癌前病变PanINs和IPMNs的表达, 结果发现sFRP-1蛋白在正常胰腺导管上皮中不表达, 在PanIN-1A和IPMA中开始出现弱阳性表达, 并随组织异型程度增加表达逐渐增强, 高级别瘤变PanIN-2、PanIN-3中sFRP-1蛋白的IHCS接近于PDAC组, 并且明显高于PanIN-1; 同样, 在由NP→IPMA、IPMB→IPMC→PDAC的进展过程中sFRP-1蛋白表达逐级增高, 说明sFRP-1蛋白表达增强是PDAC发生中的早期事件, 并且表达越强提示病变级别越高. 然而, 大多研究认为sFRP-1在肿瘤发生中发挥抑癌作用, 并且在多种肿瘤中发生表观遗传学改变而表达降低或缺失. Caldwell等[33]研究认为sFRP-1甲基化失活是结肠肿瘤发生中的早期事件, IHC检测结果显示sFRP-1蛋白在结肠肿瘤中低表达. 因此, sFRP-1蛋白在PDAC进展过程中逐渐增强的表达方式说明: sFRP-1在PDAC的发生中的作用可能与其他肿瘤不同. sFRP-1蛋白在PDAC中有可能未发生甲基化改变, 其表达增强有可能是对抗肿瘤作用加强的表现, 也有可能是基因突变导致的无功能蛋白过度表达, 具体的分子机制有待于进一步研究.
我们进一步分析了sFRP-1蛋白表达与PDAC临床病理特征的相关性, 结果表明sFRP-1的表达与肿瘤的神经浸润和分化程度密切相关, 神经浸润组的高表达率明显高于对照组, 高分化组与低分化组的高表达率明显高于中分化组. 近年来, 研究认为神经浸润是PDAC常见的转移途径, 并且是引起胰腺癌复发和癌性疼痛的重要原因, 但胰腺癌神经组织浸润的确切分子机制至今尚不明朗. 以往研究认为, 胰腺癌神经浸润是在平面最小阻力处侵入神经, 并在神经周围间隙内连续浸润到达远处形成新的转移灶. 而新近研究发现, 某些特异性分子和神经组织周围微环境在肿瘤的嗜神经性生长上可能发挥重要作用. 本研究证实sFRP-1蛋白的高表达与PDAC神经浸润呈正相关, 提示sFRP-1异常表达可能参与了PDAC的神经浸润, 并预示PDAC的恶性生物学行为. 然而, sFRP-1蛋白与PDAC分化程度在统计学上的相关性, 并未体现出sFRP-1蛋白的表达与肿瘤分化程度之间的递变关系, 无实际临床意义. 此外, 生存分析结果显示sFRP-1低表达组的中位生存期长于高表达组(20 mo vs 18 mo), 但差异无统计学意义(P = 0.430).
总之, 本研究结果证实sFRP-1的异常表达是PDAC发生中的早期事件, sFRP-1高表达是PDAC神经浸润的重要分子特征, sFRP-1高表达提示PDAC患者预后不良.
胰腺癌是一种凶险的恶性肿瘤, 然而目前临床上尚缺乏有效的早期诊断与治疗方法, 被称为"21世纪医学的顽固堡垒". 因此, 深入研究胰腺癌侵袭转移的分子机制, 探索并建立新的分子靶标以提高胰腺癌的诊疗水平显得尤为迫切.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
近年来, 研究证实Wnt/β-catenin信号通路的异常活化促进了胰腺癌的进展, 而分泌型Wnt受体拮抗剂sFRP-1可以在细胞外阻断异常的Wnt信号通路, 从而抑制肿瘤细胞的增殖、诱导肿瘤细胞凋亡, 提示sFRP-1可能成为胰腺癌的潜在治疗靶点.
大多研究认为, sFRP-1在肿瘤中发挥抑癌基因功能, 其启动子区高甲基化导致的sFRP-1基因沉默是Wnt通路异常活化的重要原因.
本研究证明, sFRP-1异常表达是胰腺导管腺癌(PDAC)的早期事件, sFRP-1高表达与PDAC神经浸润密切相关, 提示其可能成为PDAC的早期分子诊断靶标, 并且有助于揭示胰腺癌神经浸润的分子病理机制.
癌前病变胰腺上皮内瘤变(PanINs): 指胰腺导管上皮非典型性增生发展至原位癌这一"癌前病变"过程, 而胰腺导管内乳头状粘液性肿瘤(IPMNs)是最近几年被认识的一种胰腺囊性肿瘤, PanINs和IPMNs在组织病理学上呈现出逐渐增加的细胞及组织结构异型表现.
本文初步研究结果表明sFRP-1异常表达可能与PDAC发生相关, 并且是其神经浸润的重要分子特征, 有一定的创
新性.
编辑: 张姗姗 电编:鲁亚静
| 1. | Muroyama Y, Fujihara M, Ikeya M, Kondoh H, Takada S. Wnt signaling plays an essential role in neuronal specification of the dorsal spinal cord. Genes Dev. 2002;16:548-553. [PubMed] [DOI] |
| 2. | Sato N, Meijer L, Skaltsounis L, Greengard P, Brivanlou AH. Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signaling by a pharmacological GSK-3-specific inhibitor. Nat Med. 2004;10:55-63. [PubMed] [DOI] |
| 3. | Petersen CP, Reddien PW. Wnt signaling and the polarity of the primary body axis. Cell. 2009;139:1056-1068. [PubMed] [DOI] |
| 4. | Toledo EM, Inestrosa NC. Activation of Wnt signaling by lithium and rosiglitazone reduced spatial memory impairment and neurodegeneration in brains of an APPswe/PSEN1DeltaE9 mouse model of Alzheimer's disease. Mol Psychiatry. 2010;15:272-285, 228. [PubMed] |
| 5. | Dolmans GH, Werker PM, Hennies HC, Furniss D, Festen EA, Franke L, Becker K, van der Vlies P, Wolffenbuttel BH, Tinschert S. Wnt signaling and Dupuytren's disease. N Engl J Med. 2011;365:307-317. [PubMed] [DOI] |
| 6. | Bienz M, Clevers H. Linking colorectal cancer to Wnt signaling. Cell. 2000;103:311-320. [PubMed] [DOI] |
| 7. | Gregory MA, Phang TL, Neviani P, Alvarez-Calderon F, Eide CA, O'Hare T, Zaberezhnyy V, Williams RT, Druker BJ, Perrotti D. Wnt/Ca2+/NFAT signaling maintains survival of Ph+ leukemia cells upon inhibition of Bcr-Abl. Cancer Cell. 2010;18:74-87. [PubMed] [DOI] |
| 8. | Vijayakumar S, Liu G, Rus IA, Yao S, Chen Y, Akiri G, Grumolato L, Aaronson SA. High-frequency canonical Wnt activation in multiple sarcoma subtypes drives proliferation through a TCF/β-catenin target gene, CDC25A. Cancer Cell. 2011;19:601-612. [PubMed] [DOI] |
| 9. | Wells JM, Esni F, Boivin GP, Aronow BJ, Stuart W, Combs C, Sklenka A, Leach SD, Lowy AM. Wnt/beta-catenin signaling is required for development of the exocrine pancreas. BMC Dev Biol. 2007;7:4. [PubMed] [DOI] |
| 10. | McLin VA, Rankin SA, Zorn AM. Repression of Wnt/beta-catenin signaling in the anterior endoderm is essential for liver and pancreas development. Development. 2007;134:2207-2217. [PubMed] [DOI] |
| 11. | Murtaugh LC. The what, where, when and how of Wnt/β-catenin signaling in pancreas development. Organogenesis. 2008;4:81-86. [PubMed] [DOI] |
| 12. | Wang L, Heidt DG, Lee CJ, Yang H, Logsdon CD, Zhang L, Fearon ER, Ljungman M, Simeone DM. Oncogenic function of ATDC in pancreatic cancer through Wnt pathway activation and beta-catenin stabilization. Cancer Cell. 2009;15:207-219. [PubMed] [DOI] |
| 13. | Froeling FE, Feig C, Chelala C, Dobson R, Mein CE, Tuveson DA, Clevers H, Hart IR, Kocher HM. Retinoic acid-induced pancreatic stellate cell quiescence reduces paracrine Wnt-β-catenin signaling to slow tumor progression. Gastroenterology. 2011;141:1486-1497, 1497. e1-e14. [PubMed] |
| 14. | Pilarsky C, Ammerpohl O, Sipos B, Dahl E, Hartmann A, Wellmann A, Braunschweig T, Löhr M, Jesenofsky R, Friess H. Activation of Wnt signalling in stroma from pancreatic cancer identified by gene expression profiling. J Cell Mol Med. 2008;12:2823-2835. [PubMed] [DOI] |
| 15. | Kawano Y, Kypta R. Secreted antagonists of the Wnt signalling pathway. J Cell Sci. 2003;116:2627-2634. [PubMed] [DOI] |
| 16. | Kongkham PN, Northcott PA, Croul SE, Smith CA, Taylor MD, Rutka JT. The SFRP family of WNT inhibitors function as novel tumor suppressor genes epigenetically silenced in medulloblastoma. Oncogene. 2010;29:3017-3024. [PubMed] [DOI] |
| 17. | Trevant B, Gaur T, Hussain S, Symons J, Komm BS, Bodine PV, Stein GS, Lian JB. Expression of secreted frizzled related protein 1, a Wnt antagonist, in brain, kidney, and skeleton is dispensable for normal embryonic development. J Cell Physiol. 2008;217:113-126. [PubMed] [DOI] |
| 18. | Kawano Y, Diez S, Uysal-Onganer P, Darrington RS, Waxman J, Kypta RM. Secreted Frizzled-related protein-1 is a negative regulator of androgen receptor activity in prostate cancer. Br J Cancer. 2009;100:1165-1174. [PubMed] [DOI] |
| 19. | Ko J, Ryu KS, Lee YH, Na DS, Kim YS, Oh YM, Kim IS, Kim JW. Human secreted frizzled-related protein is down-regulated and induces apoptosis in human cervical cancer. Exp Cell Res. 2002;280:280-287. [PubMed] [DOI] |
| 20. | Fukui T, Kondo M, Ito G, Maeda O, Sato N, Yoshioka H, Yokoi K, Ueda Y, Shimokata K, Sekido Y. Transcriptional silencing of secreted frizzled related protein 1 (SFRP 1) by promoter hypermethylation in non-small-cell lung cancer. Oncogene. 2005;24:6323-6327. [PubMed] [DOI] |
| 21. | Martin-Manso G, Calzada MJ, Chuman Y, Sipes JM, Xavier CP, Wolf V, Kuznetsova SA, Rubin JS, Roberts DD. sFRP-1 binds via its netrin-related motif to the N-module of thrombospondin-1 and blocks thrombospondin-1 stimulation of MDA-MB-231 breast carcinoma cell adhesion and migration. Arch Biochem Biophys. 2011;509:147-156. [PubMed] [DOI] |
| 22. | Lo PK, Mehrotra J, D'Costa A, Fackler MJ, Garrett-Mayer E, Argani P, Sukumar S. Epigenetic suppression of secreted frizzled related protein 1 (SFRP1) expression in human breast cancer. Cancer Biol Ther. 2006;5:281-286. [PubMed] [DOI] |
| 23. | Suzuki H, Watkins DN, Jair KW, Schuebel KE, Markowitz SD, Chen WD, Pretlow TP, Yang B, Akiyama Y, Van Engeland M. Epigenetic inactivation of SFRP genes allows constitutive WNT signaling in colorectal cancer. Nat Genet. 2004;36:417-422. [PubMed] [DOI] |
| 24. | Stoehr R, Wissmann C, Suzuki H, Knuechel R, Krieg RC, Klopocki E, Dahl E, Wild P, Blaszyk H, Sauter G. Deletions of chromosome 8p and loss of sFRP1 expression are progression markers of papillary bladder cancer. Lab Invest. 2004;84:465-478. [PubMed] [DOI] |
| 25. | Nojima M, Suzuki H, Toyota M, Watanabe Y, Maruyama R, Sasaki S, Sasaki Y, Mita H, Nishikawa N, Yamaguchi K. Frequent epigenetic inactivation of SFRP genes and constitutive activation of Wnt signaling in gastric cancer. Oncogene. 2007;26:4699-4713. [PubMed] [DOI] |
| 27. | Tanaka M, Chari S, Adsay V, Fernandez-del Castillo C, Falconi M, Shimizu M, Yamaguchi K, Yamao K, Matsuno S. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology. 2006;6:17-32. [PubMed] [DOI] |
| 28. | Scardigli R, Gargioli C, Tosoni D, Borello U, Sampaolesi M, Sciorati C, Cannata S, Clementi E, Brunelli S, Cossu G. Binding of sFRP-3 to EGF in the extra-cellular space affects proliferation, differentiation and morphogenetic events regulated by the two molecules. PLoS One. 2008;3:e2471. [PubMed] [DOI] |
| 29. | Hsieh M, Mulders SM, Friis RR, Dharmarajan A, Richards JS. Expression and localization of secreted frizzled-related protein-4 in the rodent ovary: evidence for selective up-regulation in luteinized granulosa cells. Endocrinology. 2003;144:4597-4606. [PubMed] [DOI] |
| 30. | Bhat RA, Stauffer B, Komm BS, Bodine PV. Structure-function analysis of secreted frizzled-related protein-1 for its Wnt antagonist function. J Cell Biochem. 2007;102:1519-1528. [PubMed] [DOI] |
| 31. | Heller RS, Klein T, Ling Z, Heimberg H, Katoh M, Madsen OD, Serup P. Expression of Wnt, Frizzled, sFRP, and DKK genes in adult human pancreas. Gene Expr. 2003;11:141-147. [PubMed] [DOI] |
| 32. | Zou H, Molina JR, Harrington JJ, Osborn NK, Klatt KK, Romero Y, Burgart LJ, Ahlquist DA. Aberrant methylation of secreted frizzled-related protein genes in esophageal adenocarcinoma and Barrett's esophagus. Int J Cancer. 2005;116:584-591. [PubMed] [DOI] |
| 33. | Caldwell GM, Jones CE, Taniere P, Warrack R, Soon Y, Matthews GM, Morton DG. The Wnt antagonist sFRP1 is downregulated in premalignant large bowel adenomas. Br J Cancer. 2006;94:922-927. [PubMed] [DOI] |