修回日期: 2012-03-15
接受日期: 2012-04-25
在线出版日期: 2012-06-18
目的: 检测S100A7 mRNA和蛋白在胃癌组织中的表达情况, 分析其与胃癌临床病理学参数的关系.
方法: 应用原位杂交技术和免疫组织化学SP法分别检测53例胃癌组织和53例正常胃黏膜组织中S100A7 mRNA和蛋白的表达, 并分析其表达与临床病理学参数之间的关系.
结果: 胃癌组织中S100A7 mRNA和蛋白表达的阳性率(分别为77.36%和71.70%)显著高于正常胃黏膜组织(阳性率分别为15.09%和13.21%), χ2分别为41.330、37.110(均P = 0.000). 此外, S100A7 mRNA和蛋白的表达与患者年龄、性别无关(均P>0.05), 但与胃癌患者的分化程度、浸润深度、TNM分期和淋巴结转移密切相关(均P<0.05).
结论: S100A7的高表达可能在胃癌的发生发展中发挥重要作用, 其高表达可能是判定胃癌恶性程度十分重要的分子指标.
引文著录: 赵洁, 米文, 孙红英, 陈会军, 孙晓黎, 曾燕, 盛之玲. S100A7 mRNA和蛋白在胃癌组织中的表达及其意义. 世界华人消化杂志 2012; 20(17): 1509-1514
Revised: March 15, 2012
Accepted: April 25, 2012
Published online: June 18, 2012
AIM: To investigate the expression of S100A7 mRNA and protein in gastric carcinoma, and to analyze the relationship between S100A7 expression and clinicopathological features of gastric carcinoma.
METHODS: In situ hybridization and immunohistochemistry were used to detect the expressions of S100A7 mRNA and protein in 53 cases of gastric carcinoma and 53 cases of normal gastric mucosa, respectively. SPSS13.0 software was utilized to analyze the relationship between S100A7 expression and clinicopathological features of gastric carcinoma.
RESULTS: The positive rates of S100A7 mRNA and protein expression in gastric carcinoma were significantly higher than those in normal gastric mucosa (77.36% vs 15.09%, 71.70% vs 13.21%; χ2 = 41.330, 37.110, both P = 0.000). Expression of S100A7 mRNA and protein was not associated with age or sex (both P > 0.05), but was closely related to differentiation degree, invasion depth, TNM stage and lymph node metastasis in gastric carcinoma (all P < 0.05).
CONCLUSION: S100A7 overexpression may play a pivotal role in the occurrence and development of gastric carcinoma, representing a novel marker for evaluating the malignant degree of gastric carcinoma.
- Citation: Zhao J, Mi W, Sun HY, Chen HJ, Sun XL, Zeng Y, Sheng ZL. Significance of expression of S100A7 mRNA and protein in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(17): 1509-1514
- URL: https://www.wjgnet.com/1009-3079/full/v20/i17/1509.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i17.1509
肝胃癌是世界上常见的恶性肿瘤之一, 在肿瘤致死原因中居第2位[1-4]. 由于早期诊断和手术切除, 胃癌的治疗有很大改善, 然而, 对于具有转移和不可切除的胃癌其效果仍不理想, 中位存活时间仅7-10 mo[5]. 因此寻找胃癌发生发展的关键基因, 对于胃癌的早期诊断和治疗具有十分重要的意义. S100A7作为S100家族成员之一, 主要定位于人染色体1q21中, 其表达蛋白的分子量为11.4 kDa[6,7], 最初在牛皮癣患者破损的皮肤上发现其表达上调[8], 因而被认为主要参与炎症反应. 目前, 越来越多的研究显示, S100A7在多种不同的肿瘤中呈现高表达, 包括肺癌[9]、膀胱癌[10]、皮肤癌[11]、食管鳞癌[12]、口腔鳞癌[13]和喉鳞癌[14]等, 但在唾液腺癌中呈低表达[15], 提示在不同的肿瘤中S100A7可能发挥不同的作用. 然而, 迄今为止, 尚未见S100A7在胃癌中的研究报道, 因此, 本研究利用原位杂交技术和免疫组织化学方法检测胃癌组织和正常胃黏膜组织S100A7 mRNA和蛋白的表达, 并分析其与临床病理学参数之间的关系, 为寻找新的诊断和治疗胃癌的分子标志提供理论依据.
53例胃癌标本及其远端正常胃黏膜组织均取自于2009-06/2010-03河南省开封市中国人民解放军第155中心医院的手术切除病例, 均经过病理确诊. >60岁有31例, ≤60岁有22例; 男35例, 女18例; 高分化胃癌16例, 中分化胃癌14例, 低分化胃癌23例; 关于浸润深度, 浸入浅层的27例, 浸入深层的26例; Ⅰ和Ⅱ期占25例, Ⅲ和Ⅳ期占28例; 有淋巴结转移为23例, 无淋巴结转移为30例. 所有病例术前均未接收任何放疗、化疗和免疫治疗史.
原位杂交试剂盒购自武汉博士德生物工程有限公司; BCIP/NBT底物显色试剂盒购自天根生化科技(北京)有限公司; SP免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司; 鼠单克隆抗体S100A7(sc-52948)购自美国Santa Cruz公司. S100A7基因探针序列为: 5'-GAGAAGCCAAGCCTGCTGACG-3', 探针由北京奥科生物技术有限公司经过5'端生物素标记并合成.
1.2.1 原位杂交和免疫组织化学分析S100A7 mRNA和蛋白表达: 所有的胃癌组织和正常胃黏膜组织标本均经过40 g/L多聚甲醛固定, 石蜡包埋和4-6 μm连续切片. 原位杂交染色步骤: 标本经脱蜡和脱水后, 采用新鲜配制的0.5%H2O2在室温下处理30 min(灭活内源性过氧化物酶); 3%柠檬酸新鲜配制蛋白酶(0.01 g/L)于37 ℃孵育10 min(消化标本DNA结合蛋白); 滴加20 μL不含探针的预杂交液于42 ℃预杂交4 h; 加入含探针(1 ng/L)的杂交液于42 ℃湿盒内杂交12 h; 0.1×标准柠檬酸盐(SSC)42 ℃漂洗, 加SA-Bio-AP于37 ℃孵育10 min; 后加NBT/BCIP, 避光显色2-4 h. 以不含探针的标本作阴性对照. 采用免疫组织化学SP法, S100A7抗体稀释, 稀释倍数均为1:100, DAB显色, 苏木素复染. 染色步骤严格按说明书进行, 以PBS液代替一抗作为阴性对照.
1.2.2 结果评估: S100A7 mRNA阳性信号呈蓝紫色, 位于细胞质内; 蛋白阳性信号呈浅黄色至棕黄色, 位于细胞质或细胞核内. 在高倍显微镜下, 随机选取5个视野(每个视野计不少于200个细胞数), 按阳性细胞所占比率和着色深浅进行结果判定. 判定标准如下: 阳性细胞比率<5%, 0分; 5%-25%, 1分; 25%-50%, 2分; 50%-75%, 3分; >75%, 4分. 染色强弱: 阴性为0分, 淡黄(蓝)色染色为1分, 中度黄(蓝)色染色为2分, 棕黄(紫蓝)色染色为3分. 然后按照"阳性细胞数分值×染色强弱分值"计总分, 总分<1为阴性, 其他分值定为阳性[16].
统计学处理 采用SPSS13.0软件进行统计学处理, 行χ2检验, 检验水准α = 0.05.
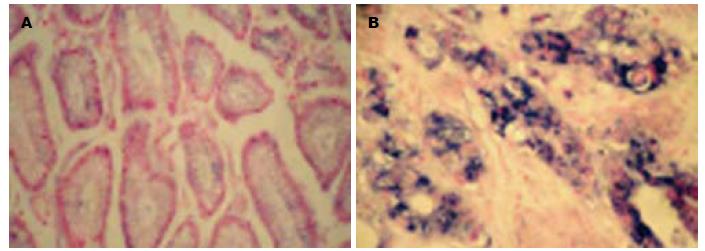
S100A7 mRNA主要定位于细胞质中, 呈蓝紫色(图1). S100A7 mRNA在胃癌组织中的表达阳性率为77.36%(41/53), 显著高于正常胃黏膜组织(15.09%), 二者之间S100A7 mRNA表达具有显著性差异(χ2 = 41.330, P = 0.000, 表1).
| 分组 | S100A7 mRNA | χ2值 | P值 | ||
| + | - | 阳性率(%) | |||
| 胃癌组织 | 41 | 12 | 77.36 | 41.330 | 0.000 |
| 正常胃黏膜组织 | 8 | 45 | 15.09 | ||
S100A7 mRNA表达与患者年龄、性别无关(均P>0.05), 但与分化程度、浸润深度、TNM分期和淋巴结转移均具有显著的相关性(均P<0.05, 表2).
| 病理特征 | n | S100A7 mRNA | χ2值 | P值 | ||
| + | - | 阳性表达率(%) | ||||
| 年龄 | 0.427 | 0.513 | ||||
| >60 | 31 | 23 | 8 | 74.19 | ||
| ≥60 | 22 | 18 | 4 | 81.82 | ||
| 性别 | 0.411 | 0.522 | ||||
| 男 | 35 | 28 | 7 | 80.00 | ||
| 女 | 18 | 13 | 5 | 72.22 | ||
| 分化程度 | 6.636 | 0.036 | ||||
| 高 | 16 | 9 | 7 | 56.25 | ||
| 中 | 14 | 11 | 3 | 78.57 | ||
| 低 | 23 | 21 | 2 | 91.30 | ||
| 浸润深度 | 6.512 | 0.011 | ||||
| 浅层 | 27 | 17 | 10 | 62.96 | ||
| 深层 | 26 | 24 | 2 | 92.31 | ||
| TNM分期 | 12.325 | 0.000 | ||||
| Ⅰ+Ⅱ | 25 | 14 | 11 | 56.00 | ||
| Ⅲ+Ⅳ | 28 | 27 | 1 | 96.43 | ||
| 淋巴结转移 | 7.764 | 0.005 | ||||
| 无 | 30 | 19 | 11 | 63.33 | ||
| 有 | 23 | 22 | 1 | 95.65 | ||
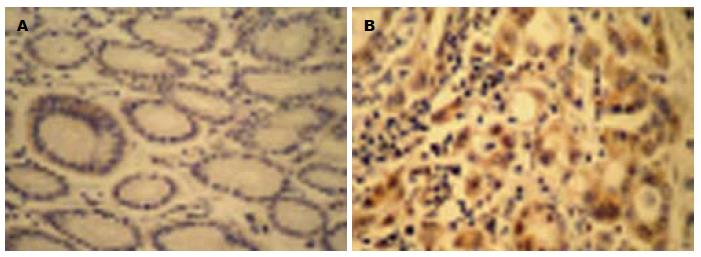
S100A7蛋白主要定位于细胞质或细胞核中, 呈棕黄色(图2). S100A7蛋白在胃癌组织中表达的阳性率(71.70%)明显高于正常胃黏膜组织(13.21%), 二者表达具有显著性差异(χ2 = 37.110, P = 0.000, 表3).
| 分组 | S100A7蛋白 | χ2值 | P值 | ||
| + | - | 阳性率(%) | |||
| 胃癌组织 | 38 | 15 | 71.70 | 37.110 | 0.000 |
| 正常胃黏膜组织 | 7 | 46 | 13.21 | ||
S100A7蛋白表达与患者年龄、性别无关(均P>0.05), 但与分化程度、浸润深度、TNM分期和淋巴结转移均具有明显的相关性(均P<0.05, 表4).
| 病理特征 | n | S100A7蛋白 | χ2值 | P值 | ||
| + | - | 阳性表达率(%) | ||||
| 年龄 | 0.020 | 0.889 | ||||
| >60 | 31 | 22 | 9 | 70.97 | ||
| ≥60 | 22 | 16 | 6 | 72.73 | ||
| 性别 | 0.496 | 0.481 | ||||
| 男 | 35 | 24 | 11 | 68.57 | ||
| 女 | 18 | 14 | 4 | 77.78 | ||
| 分化程度 | 10.516 | 0.005 | ||||
| 高 | 16 | 7 | 9 | 43.75 | ||
| 中 | 14 | 10 | 4 | 71.43 | ||
| 低 | 23 | 21 | 2 | 91.30 | ||
| 浸润深度 | 7.068 | 0.008 | ||||
| 浅层 | 27 | 15 | 12 | 55.56 | ||
| 深层 | 26 | 23 | 3 | 88.46 | ||
| TNM分期 | 13.097 | 0.000 | ||||
| Ⅰ+Ⅱ | 25 | 12 | 13 | 48.00 | ||
| Ⅲ+Ⅳ | 28 | 26 | 2 | 92.86 | ||
| 淋巴结转移 | 11.490 | 0.001 | ||||
| 无 | 30 | 16 | 14 | 53.33 | ||
| 有 | 23 | 22 | 1 | 95.65 | ||
S100基因家族包含至少20个成员, 具有共同的结构特征, 即Ca2+结合的EF手指基序. S100蛋白参与多种不同的生物学过程, 包括: 免疫反应、细胞分化、细胞骨架重塑、酶活性以及细胞的增殖[17-19]. 目前研究显示, S100A7作为S100蛋白信号家族的成员之一, 因其与多种不同肿瘤的发生、发展关系密切, 而备受广大科研工作者关注. 研究显示[20-25], S100A7在乳腺导管上皮癌的原位癌中高表达, 但在正常乳腺导管上皮及其侵袭性癌中则低表达或不表达. 此外, S100A7表达与升高的血管生成密切相关[26],并被证实其能激活多种不同的信号途径调控肿瘤细胞的增殖[27-29]. Banerjee等[30]研究发现S100A7在恶性进展中的重要功能, 他们通过基因芯片和免疫组织化学证实, S100A7是口腔癌形成初期表达上调最显著的基因之一. 这些研究提示S100A7可能与肿瘤的发生、发展关系十分密切, 进一步研究有望成为多种不同肿瘤的分子治疗靶点.
目前, S100A7在胃癌中的表达如何? 国内外尚未见报道, 因此, 为了了解胃癌组织中S100A7 mRNA和蛋白的表达情况, 在本研究中, 我们通过原位杂交、免疫组织化学检测53例胃癌组织和相应的53例正常胃黏膜组织中S100A7 mRNA和蛋白的表达. 结果表明, 53例胃癌组织中41例呈现S100A7的阳性表达, 阳性率为77.36%, 而相应的正常胃黏膜组织中, 其阳性表达率仅为15.09%, 二者表达具有显著性差异(χ2 = 41.330, P = 0.000), 提示胃癌组织中呈现S100A7 mRNA的高表达. 进一步的免疫细胞化学结果也显示胃癌组织中S100A7蛋白的表达显著高于正常胃黏膜组织的表达, 差异具有统计学意义(P<0.05), 提示高表达的S100A7蛋白可能参与胃癌的发生发展过程.
此外, 为了初步阐明S100A7 mRNA和蛋白在胃癌组织中高表达的可能意义, 我们利用SPSS13.0软件分析S100A7表达与胃癌临床病理学参数之间的关系, 结果发现, S100A7 mRNA和蛋白与胃癌患者的年龄、性别无关(均P>0.05), 但与分化程度、浸润深度、TNM分期和淋巴结转移显著相关(均P<0.05), 表明S100A7可能成为胃癌临床应用的关键指标, 但其详细的分子机制还有待进一步探讨.
总之, 我们初步的研究结果显示, S100A7 mRNA和蛋白在胃癌组织中呈现高表达, 其高表达可能与胃癌的发生、发展密切相关, 但相关的分子机制有待进一步研究, 未来深入研究S100A7的功能有望为胃癌的基因治疗提供新的分子靶点.
越来越多的研究显示, S100A7作为S100蛋白信号家族的成员之一, 在多种不同的肿瘤中呈现高表达, 包括肺癌、膀胱癌、皮肤癌和食管鳞癌等, 提示其与肿瘤的发生发展密切相关.
陈光, 教授, 吉林大学第一医院消化器官外科
因S100A7与多种不同的肿瘤发生发展关系密切, 而备受广大科研工作者关注. 然而, 迄今为止, 尚未见S100A7在胃癌中的研究报道. 关于S100A7与恶性肿瘤关系的研究已成为热点.
国内外研究发现, S100A7在多种恶性肿瘤的发生、发展中具有十分重要的作用,其异常表达可能与肿瘤的增殖分化及浸润转移关系密切.
本文采用原位杂交和免疫组织化学2种方法联合检测食管鳞癌组织S100A7 mRNA和蛋白的表达情况, 并分析其与临床病理学参数之间的关系.
S100A7 mRNA和蛋白有望成为食管鳞癌早期诊断和分子靶向治疗的指标之一.
S100A7: 作为S100家族成员之一, 主要定位于人染色体1q21中, 其表达蛋白的分子量为11.4 kDa, 最初在牛皮癣患者破损的皮肤上发现其表达上调, 因而被认为主要参与炎症反应.
本研究丰富了胃癌分子生物学的研究, 对研究胃癌的发生发展有一定帮助, 并对胃癌的生物治疗和预后判断有意义.
编辑: 张姗姗 电编:鲁亚静
| 1. | Danaei G, Vander Hoorn S, Lopez AD, Murray CJ, Ezzati M. Causes of cancer in the world: comparative risk assessment of nine behavioural and environmental risk factors. Lancet. 2005;366:1784-1793. [PubMed] [DOI] |
| 2. | Kelley JR, Duggan JM. Gastric cancer epidemiology and risk factors. J Clin Epidemiol. 2003;56:1-9. [PubMed] [DOI] |
| 4. | El-Omar EM, Carrington M, Chow WH, McColl KE, Bream JH, Young HA, Herrera J, Lissowska J, Yuan CC, Rothman N. Interleukin-1 polymorphisms associated with increased risk of gastric cancer. Nature. 2000;404:398-402. [PubMed] [DOI] |
| 5. | Ohtsu A, Yoshida S, Saijo N. Disparities in gastric cancer chemotherapy between the East and West. J Clin Oncol. 2006;24:2188-2196. [PubMed] [DOI] |
| 6. | Heizmann CW, Fritz G, Schäfer BW. S100 proteins: structure, functions and pathology. Front Biosci. 2002;7:d1356-d1368. [PubMed] [DOI] |
| 7. | Celis JE, Madsen P, Rasmussen HH, Leffers H, Honoré B, Gesser B, Dejgaard K, Olsen E, Magnusson N, Kiil J. A comprehensive two-dimensional gel protein database of noncultured unfractionated normal human epidermal keratinocytes: towards an integrated approach to the study of cell proliferation, differentiation and skin diseases. Electrophoresis. 1991;12:802-872. [PubMed] [DOI] |
| 8. | Madsen P, Rasmussen HH, Leffers H, Honoré B, Dejgaard K, Olsen E, Kiil J, Walbum E, Andersen AH, Basse B. Molecular cloning, occurrence, and expression of a novel partially secreted protein "psoriasin" that is highly up-regulated in psoriatic skin. J Invest Dermatol. 1991;97:701-712. [PubMed] [DOI] |
| 9. | Zhang H, Zhao Q, Chen Y, Wang Y, Gao S, Mao Y, Li M, Peng A, He D, Xiao X. Selective expression of S100A7 in lung squamous cell carcinomas and large cell carcinomas but not in adenocarcinomas and small cell carcinomas. Thorax. 2008;63:352-359. [PubMed] [DOI] |
| 10. | Celis JE, Rasmussen HH, Vorum H, Madsen P, Honoré B, Wolf H, Orntoft TF. Bladder squamous cell carcinomas express psoriasin and externalize it to the urine. J Urol. 1996;155:2105-2112. [PubMed] [DOI] |
| 11. | Moubayed N, Weichenthal M, Harder J, Wandel E, Sticherling M, Gläser R. Psoriasin (S100A7) is significantly up-regulated in human epithelial skin tumours. J Cancer Res Clin Oncol. 2007;133:253-261. [PubMed] [DOI] |
| 12. | Ji J, Zhao L, Wang X, Zhou C, Ding F, Su L, Zhang C, Mao X, Wu M, Liu Z. Differential expression of S100 gene family in human esophageal squamous cell carcinoma. J Cancer Res Clin Oncol. 2004;130:480-486. [PubMed] [DOI] |
| 14. | Barbieri MR, Andrade CD, Silva WA, Marques AA, Leopoldino AM, Montes MB, Dias-Baruffi M, Soares IC, Wakamatsu A, Alves VA. Expression of human protein S100A7 (psoriasin), preparation of antibody and application to human larynx squamous cell carcinoma. BMC Res Notes. 2011;4:494. [PubMed] [DOI] |
| 15. | Kesting MR, Stoeckelhuber M, Kuppek A, Hasler R, Rohleder N, Wolff KD, Nieberler M. Human β-defensins and psoriasin/S100A7 expression in salivary glands: anti-oncogenic molecules for potential therapeutic approaches. BioDrugs. 2012;26:33-42. [PubMed] [DOI] |
| 16. | Liu HT, Wang N, Wang X, Li SL. Overexpression of Pim-1 is associated with poor prognosis in patients with esophageal squamous cell carcinoma. J Surg Oncol. 2010;102:683-688. [PubMed] [DOI] |
| 17. | Emberley ED, Murphy LC, Watson PH. S100 proteins and their influence on pro-survival pathways in cancer. Biochem Cell Biol. 2004;82:508-515. [PubMed] [DOI] |
| 18. | Moog-Lutz C, Bouillet P, Régnier CH, Tomasetto C, Mattei MG, Chenard MP, Anglard P, Rio MC, Basset P. Comparative expression of the psoriasin (S100A7) and S100C genes in breast carcinoma and co-localization to human chromosome 1q21-q22. Int J Cancer. 1995;63:297-303. [PubMed] [DOI] |
| 19. | Masiakowski P, Shooter EM. Nerve growth factor induces the genes for two proteins related to a family of calcium-binding proteins in PC12 cells. Proc Natl Acad Sci U S A. 1988;85:1277-1281. [PubMed] [DOI] |
| 20. | Leygue E, Snell L, Hiller T, Dotzlaw H, Hole K, Murphy LC, Watson PH. Differential expression of psoriasin messenger RNA between in situ and invasive human breast carcinoma. Cancer Res. 1996;56:4606-4609. [PubMed] |
| 21. | Al-Haddad S, Zhang Z, Leygue E, Snell L, Huang A, Niu Y, Hiller-Hitchcock T, Hole K, Murphy LC, Watson PH. Psoriasin (S100A7) expression and invasive breast cancer. Am J Pathol. 1999;155:2057-2066. [PubMed] [DOI] |
| 22. | Enerbäck C, Porter DA, Seth P, Sgroi D, Gaudet J, Weremowicz S, Morton CC, Schnitt S, Pitts RL, Stampl J. Psoriasin expression in mammary epithelial cells in vitro and in vivo. Cancer Res. 2002;62:43-47. [PubMed] |
| 23. | Emberley ED, Murphy LC, Watson PH. S100A7 and the progression of breast cancer. Breast Cancer Res. 2004;6:153-159. [PubMed] [DOI] |
| 24. | Emberley ED, Niu Y, Leygue E, Tomes L, Gietz RD, Murphy LC, Watson PH. Psoriasin interacts with Jab1 and influences breast cancer progression. Cancer Res. 2003;63:1954-1961. [PubMed] |
| 25. | Emberley ED, Niu Y, Njue C, Kliewer EV, Murphy LC, Watson PH. Psoriasin (S100A7) expression is associated with poor outcome in estrogen receptor-negative invasive breast cancer. Clin Cancer Res. 2003;9:2627-2631. [PubMed] |
| 26. | Krop I, März A, Carlsson H, Li X, Bloushtain-Qimron N, Hu M, Gelman R, Sabel MS, Schnitt S, Ramaswamy S. A putative role for psoriasin in breast tumor progression. Cancer Res. 2005;65:11326-11334. [PubMed] [DOI] |
| 27. | Emberley ED, Niu Y, Curtis L, Troup S, Mandal SK, Myers JN, Gibson SB, Murphy LC, Watson PH. The S100A7-c-Jun activation domain binding protein 1 pathway enhances prosurvival pathways in breast cancer. Cancer Res. 2005;65:5696-5702. [PubMed] [DOI] |
| 28. | Paruchuri V, Prasad A, McHugh K, Bhat HK, Polyak K, Ganju RK. S100A7-downregulation inhibits epidermal growth factor-induced signaling in breast cancer cells and blocks osteoclast formation. PLoS One. 2008;3:e1741. [PubMed] |
| 29. | West NR, Watson PH. S100A7 (psoriasin) is induced by the proinflammatory cytokines oncostatin-M and interleukin-6 in human breast cancer. Oncogene. 2010;29:2083-2092. [PubMed] [DOI] |
| 30. | Banerjee AG, Bhattacharyya I, Vishwanatha JK. Identification of genes and molecular pathways involved in the progression of premalignant oral epithelia. Mol Cancer Ther. 2005;4:865-875. [PubMed] [DOI] |