修回日期: 2012-05-11
接受日期: 2012-05-16
在线出版日期: 2012-05-28
目的: 观察羊栖菜多糖(sargassum fusiforme polysaccharides, SFPS)对内毒素(lipopolysccharide, LPS)诱导的肝星状细胞HSC-T6的增殖活化、氧化损伤及凋亡的影响, 并探讨其抗纤维化的机制.
方法: 将大鼠HSC-T6细胞株置DMEM培养液中, 37 ℃ 50 mL/L CO2条件下培养传代后分为空白对照组、LPS模型组、LPS+不同剂量SFPS组. 加药处理48 h后, MTT比色法检测细胞增殖; Annexin V-FITC标记法检测细胞的凋亡; 比色法检测MDA/SOD的含量; 采用ELISA法检测Ⅰ型胶原蛋白的表达; Western blot法检测α-SMA的表达.
结果: LPS能明显诱导HSC-T6的增殖、提高MDA的分泌及Ⅰ型胶原和α-SMA的表达、降低SOD的分泌; 与模型组相比, SFPS(25、50、100 mg/L)组可以不同程度抑制HSC-T6增殖并能诱导其凋亡、减少MDA分泌及Ⅰ型胶原和α-SMA的表达、增加SOD的分泌(均P<0.05).
结论: SFPS可能具有一定的抗纤维化作用, 其与诱导HSC-T6凋亡及保护LPS诱导的HSC-T6细胞氧化应激损伤有关.
引文著录: 张雪琴, 吴金明, 黄智銘, 吴建胜, 方红龙. 羊栖菜多糖对内毒素诱导的大鼠肝星状细胞增殖活化、氧化损伤及凋亡的影响. 世界华人消化杂志 2012; 20(15): 1333-1337
Revised: May 11, 2012
Accepted: May 16, 2012
Published online: May 28, 2012
AIM: To investigate the effect of sargassum fusiforme polysaccharides (SFPS) on the proliferation, activation, oxidative damage and apoptosis of lipopolysccharide (LPS)-induced rat hepatic stellate cells (HSCs), and to evaluate the anti-fibrotic mechanism of SFPS.
METHODS: Cultured rat HSCs were divided into five groups: control group, LPS group, and three LPS plus SFPS groups (treated with LPS plus low-, medium- or high-dose SFPS). After 48 h, cell proliferation was assessed by MTT colorimetric assay. Apoptotic cells were detected by annexin V-FITC/PI double labeling and flow cytometry. MDA/SOD contents were measured by colorimetry. The levels of type I collagen were measured by ELISA. Western blot were used to detect the expression of α-smooth muscle actin.
RESULTS: LPS induced proliferation, increased the secretion of MDA and the expression of typeⅠcollagen and α-smooth muscle actin, and reduced the secretion of SOD in HSCs (all P < 0.05). Compared to the LPS group, treatment with different doses of SFPS inhibited proliferation, induced apoptosis, reduced secretion of MDA, decreased the expression of typeⅠcollagen and α-SMA, and increased secretion of SOD (all P < 0.05).
CONCLUSION: These results suggest that SFPS can alleviate liver fibrosis by inducing apoptosis of HSCs and protecting against LPS-induced oxidative stress.
- Citation: Zhang XQ, Wu JM, Huang ZM, Wu JS, Fang HL. Effect of sargassum fusiforme polysaccharides on lipopolysaccharide-induced proliferation, activation, oxidative damage and apoptosis of rat hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2012; 20(15): 1333-1337
- URL: https://www.wjgnet.com/1009-3079/full/v20/i15/1333.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i15.1333
肝星状细胞(hepatic stellate cells, HSCs)的活化和增殖是肝纤维化形成过程中的关键环节[1]. 近来有研究表明, 内毒素与肝纤维化的发生发展有着密切的关系[2]. 在各种治疗肝纤维化的方法中, 诱导HSCs凋亡、保护受损的肝细胞成为目前的研究热点. 羊栖菜多糖(sargassum fusiforme polysaccharides, SFPS)提取自羊栖菜, 经研究发现有抗氧化、促进肿瘤细胞凋亡的作用, 但其机制尚不明确. 本研究主要观察SFPS体外能否诱导活化的HSCs凋亡及其抗氧化作用, 为中药治疗肝纤维化提供新的途径.
大鼠HSC-T6细胞株由本实验室保存. 羊栖菜(SFPS, 温州医学院陈晓明老师馈赠)、 DMEM(高糖型)培养液和胎牛血清(美国GIBCO公司)、内毒素(LPS, 美国SIGMA公司)、0.25%胰蛋白酶(美国GIBCO公司)、四甲基偶氮唑盐(MTT, 北京索来宝生物公司)、Annexin V-FITC细胞凋亡检测试剂盒(Biovision公司)、丙二醛测定试剂盒(MDA, 南京建成生物工程研究所)、超氧化物歧化酶测定试剂盒(SOD, 南京建成生物工程研究所)、小鼠抗大鼠α-肌动蛋白单克隆抗体及β-actin抗体(美国Santa Cruz公司)、山羊抗小鼠二抗(武汉博士得生物工程有限公司).
1.2.1 HSC-T6细胞的培养与传代: 细胞复苏后以5×105/瓶接种于25 cm2细胞培养瓶(Corning), 以完全培养基(DMEM高糖培养基+100 mL/L胎牛血清)在37 ℃、50 mL/L CO2培养箱培养, 隔天换液, 待细胞长至70%-80%密度时, 用0.25%胰蛋白酶进行消化, 按1:3比例传代.
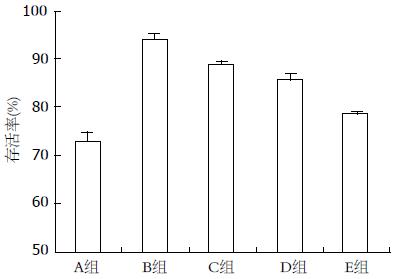
1.2.2 分组: 本研究分为 空白对照组(A组)、LPS 1.0 μmol/L组(B组)、 1.0 μmol/L LPS+SFPS 25 mg/L组(C组)、1.0 μmol/L LPS+SFPS 50 mg/L组(D组)和1.0 μmol/L LPS+SFPS 100 mg/L组(E组).
1.2.3 MTT法检测细胞增殖活力: 取对数生长期细胞, 按1×104个/孔接种于96孔板, 每组4个复孔, 培养24 h后, 用无血清培养基同步化处理24 h, 按分组处理, 终止培养前4 h每孔加入10 μL MTT (5 g/L), 培养结束时小心吸除上清, 加100 μL DMSO/孔, 振荡10 min溶解结晶物, 酶标仪570 nm波长测各组吸光度(A)值. 以正常对照组A值为对照, 计算各组细胞存活率. 细胞存活率(%) = (各组A值/正常对照组A值)
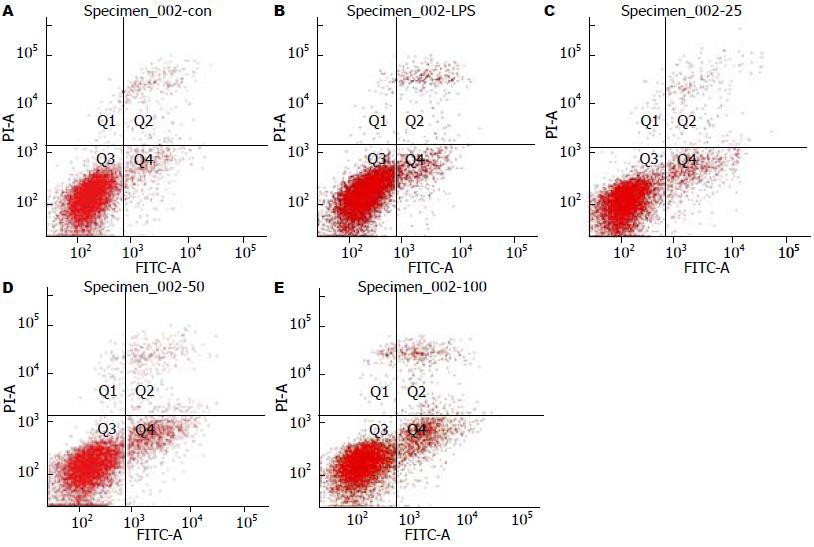
1.2.4 Annexin V-FITC/PI标记法检测细胞凋亡: 收集各组细胞, 用4 ℃预冷的PBS洗涤2次. 500 μL结合缓冲液重悬细胞, 调节其浓度为3×l05, 加入5 μL Annexin V-FITC和10 μL PI, 混匀后于室温避光孵育5 min, 流式细胞仪(Becton Dickinson, FACS Vantage SE)分析结果.
1.2.5 比色法检测MDA/SOD: 过氧化脂质降解产物中MDA可与硫代巴比妥酸(Thibabituric acid, TBA)缩合, 形成红色产物, 经过比色可测定MDA含量. 收集培养板上的细胞, 加入PBS液反复冻融后, 按试剂盒说明测定其中的MDA含量. 黄嘌呤氧化酶反应系统产生超氧阴离子自由基, 后者氧化羟胺形成亚硝酸盐, 在显色剂的作用下呈现紫红色, 当被测样品中含SOD时, 则抑制超氧阴离子自由基使亚硝酸盐形成减少. 收集培养板上的细胞培养液, 采用黄嘌呤氧化酶比色法测定SOD活性.
1.2.6 ELISA法检测Ⅰ型胶原的表达: 收集做MTT时药物处理后的上清液. 按Ⅰ型胶原ELISA试剂盒操作说明书操作. 酶标仪450 nm波长处测A值, 绘出标准曲线, 根据样品(A)值在曲线图上查出相应Ⅰ型胶原含量.
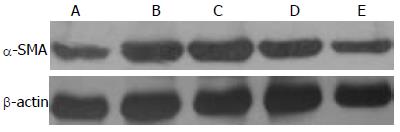
1.2.7 Western blot法检测α-SMA(43 kDa)的表达: 加入各组蛋白样品经聚丙烯酰胺凝胶电泳分离后转移至PVDF膜, 封闭1 h后, 加入α-肌动蛋白单克隆抗体抗体(1:400)和内参照GAPDH抗体(1:500), 一抗过夜后加入辣根过氧化物酶标记的二抗(1:3 000)作用1 h, 电化学发光法检测, 在暗室中X光胶片曝光并冲洗显影, 用BioSens SC810软件测定各条带的灰度值, 经内参照β-actin校正后得到蛋白的相对表达量.
统计学处理 数据用mean±SD表示, 采用SPSS17.0作One-way ANOVA分析, 两两比较用LSD检验, P<0.05为差异有统计学意义.
各组细胞的存活率A组为73.1%±3.4%、B组为94.7%±2.3%、C组为89.1%±1.5%、D组为86.1%±2.7%、E组为78.7%±1.3%, 差异有统计学意义(P<0.05). LSD法两两比较, B组>C组>D组>E组>A组, 均有统计学意义(P<0.05). 与空白组相比, LPS对HSCs的增殖有明显的促进作用(P<0.01), 与模型组相比, SFPS对LPS诱导的HSCs的增殖具有明显的抑制作用, 且随着SFPS浓度的增加细胞增殖下降, 呈剂量依赖性(P<0.05, 图1).
HSC-T6细胞凋亡率A组为7.4%±1.4%、B组为5.6%±2.1%、C组为9.8%±2.0%、D组为12.7%±1.7%、E组为15.3±3.6%, 差异有统计学意义(P<0.05). 与模型组相比, SFPS能明显促进肝星状细胞的凋亡, 并呈剂量依赖性(P<0.05, 图2).
与模型组相比, SFPS(25、50、100 mg/L)组可以不同程度增加SOD的分泌及减少MDA分泌(均P<0.05, 表1).
Ⅰ型胶原的表达各组表达量A组为90.51±2.23, B组为256.63±3.43, C组为206.32±5.49, D组为184.35±9.62, E组为139.28±4.81, 差异有统计学意义(F = 19.06, P<0.05). LSD法两两比较, B组>C组>D组>E组>A组, 均有统计学意义(P<0.05). 与空白组对比, 内毒素能明显促进HSCs表达Ⅰ型胶原(P<0.01), 不同剂量SFPS作用后, 与模型组相比,Ⅰ型胶原表达受到抑制并呈剂量依赖性(P<0.05).
各组灰度比值A组为0.38±1.12, B组为0.87±2.05, C组为0.80±1.23, D组为0.73±0.84, E组为0.54 ±2.33, 差异有统计学意义(F = 76.24, P<0.01). LSD法两两比较, B组>C组>D组>E组>A组, 均有统计学意义(P<0.05). LPS能明显促进HSCs表达α-SMA(P<0.01), 与模型组相比, 不同剂量SFPS作用后, LPS诱导的肝星状细胞分泌的α-SMA表达受到抑制并呈剂量依赖性(P<0.05, 图3).
肝纤维化是慢性肝病的共同病理学基础, 是形成肝硬化的必经病理阶段[3]. 虽然肝纤维化的确切病因还未明确, 但是各种致病因素能造成肝细胞坏死, 激活库普弗细胞(Kupffer cell, KC), 分泌炎性因子, 如TNF-α、TGF-β、血小板衍生生长因子(platelet derived growth factor, PDGF)、白介素-1(interleukin-1, IL-1), 最终共同使静息HSCs激活、转化为肌成纤维细胞(myofibroblast, MFB)[4,5]. HSCs是位于Disse间隙的一种间质细胞, 正常情况下处于静息状态, 活化后表达α-SMA水平升高, 合成包括胶原在内的细胞外基质. 大量资料表明: HSCs的增殖和活化是肝纤维化发生的细胞学基础, 是各种病因致肝纤维化发生的共同中心环节[6]. 表达α-SMA是HSCs特异性的活化标志[7]. 氧化应激在HSCs活化、增殖中亦起重要作用[8]. 损伤的肝细胞、活化的KC以及嗜中性粒细胞等炎症细胞均可以产生H2O2等活性氧(ROS), 这些ROS及其脂质过氧化物(LPO)降解产物, 可以通过旁分泌机制刺激HSCs活化, 进而分泌ECM增多促进肝纤维化的发生.
近年研究表明, 内毒素与肝纤维化的发生发展有着密切关系. 肝损伤状态下, 肝脏对内毒素排除作用减弱, 造成其在体内大量堆积, 而促进肝纤维化的发展. 以往多以TNF-α、PDGF和TGF-β1刺激HSCs建立体外肝纤维化模型, 因为PDGF是HSCs最强大的趋化因子和促分裂原, 引起HSCs增殖, 但是胶原增加不明显, TGF-β1具有强大的促HSCs分泌胶原作用, 但是细胞增殖受抑制. LPS是革兰氏阴性细菌细胞壁的主要成分, 也称脂多糖, 是众多促进HSCs活化刺激物之一. 本实验通过适当浓度的刺激, 发现HSCs在一定范围内增殖较明显, 较高浓度时损伤占主导地位. Gandhi等[9]研究发现, LPS可上调在HSCs活化中具有重要意义的ET-1受体, 是通过NO依赖和非NO依赖机制实现的. 另外一定浓度的内毒素直接作用与HSCs能使其TGF-β1表达增加, 这可能是内毒素促进肝纤维化的途径之一, PDTC是NF-KB抑制剂, 作用于HSCs可使TGF-β1表达降低[10]. 还有LPS价格较便宜, 比较经济, 这为以后构建体外肝纤维化模型提供了一个新的途径.
MDA是脂质过氧化产物, 他的水平间接反映了机体细胞受自由基攻击的严重程度, 而SOD的活力又间接反映机体清除自由基的能力, 他们是一对互相影响的指标.
临床研究发现肝纤维化在一定情况下可通过减少活化的HSCs来逆转, 可以通过以下方法实现: (1)活化HSCs转变为静止状态; (2)活化HSCs发生凋亡[6]. HSCs活化后其表型很难逆转, 而通过促进活化的HSCs凋亡可能是治疗肝纤维化的不错的选择. 本实验通过LPS刺激HSC-T6建立了体外肝纤维化模型, SFPS可以抑制活化的HSCs增殖并促进其凋亡, 使其活化标志物α-SMA表达减少, 降低Ⅰ型胶原的分泌, 降低HSCs培养液中异常升高MDA的含量, 同时提高SOD的活力而起到抗肝纤维化的作用[11].
羊栖菜在我国沿海广泛分布, 多年来的研究表明羊栖菜多糖具有抗肿瘤、降血脂血糖及修复细胞氧化损伤等活性. 如: SFPS诱导HL-60细胞凋亡, 其机制可能与fas/fasl表达增多有关[12]; SFPS对H2O2所致人脐静脉内皮细胞损伤有保护及修复作用[13]; SFPS可对抗H2O2诱导的胰岛β细胞凋亡[14,15]. 且该药具有取材方便, 价格低廉, 如果能用于预防或治疗肝纤维化将有重要的意义.
肝星状细胞 (HSCs)的活化和增殖是肝纤维化形成的关键环节. 近来有研究表明, 内毒素与肝纤维化的发生发展有着密切的关系.各种治疗肝纤维化的方法中, 以诱导HSCs凋亡、保护受损的肝细胞成为目前的研究热点, 羊栖菜多糖(SFPS)经研有抗氧化、促进肿瘤细胞凋亡作用, 但其机制尚不明确.
倪润洲, 教授, 江苏省南通市, 南通大学附属医院消化内科; 田字彬, 教授, 山东省青岛市, 青岛大学医学院附属医院
羊栖菜在我国沿海广泛分布, 多年来的研究表明羊栖菜多糖具有抗肿瘤、降血脂血糖及修复细胞氧化损伤等活性.
本文利用提取的海洋多糖体外刺激活化的肝星状细胞, 结果可以促进活化细胞凋亡, 胶原分泌减少等多方面说明可能用于肝纤维化的治疗.
SFPS可诱导活化的HSCs凋亡及抗氧化作用, 为中药治疗肝纤维化提供新的途径.
本研究设计尚合理, 有一定的科学意义和潜在的应用价值, 为中药治疗肝纤维化提供新的途径.
编辑: 张姗姗 电编:闫晋利
| 1. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] |
| 3. | Friedman SL. Seminars in medicine of the Beth Israel Hospital, Boston. The cellular basis of hepatic fibrosis. Mechanisms and treatment strategies. N Engl J Med. 1993;328:1828-1835. [PubMed] |
| 4. | Faouzi S, Le Bail B, Neaud V, Boussarie L, Saric J, Bioulac-Sage P, Balabaud C, Rosenbaum J. Myofibroblasts are responsible for collagen synthesis in the stroma of human hepatocellular carcinoma: an in vivo and in vitro study. J Hepatol. 1999;30:275-284. [PubMed] [DOI] |
| 5. | Zhang L, Keane MP, Zhu LX, Sharma S, Rozengurt E, Strieter RM, Dubinett SM, Huang M. Interleukin-7 and transforming growth factor-beta play counter-regulatory roles in protein kinase C-delta-dependent control of fibroblast collagen synthesis in pulmonary fibrosis. J Biol Chem. 2004;279:28315-28319. [PubMed] [DOI] |
| 6. | Robert K, Nehmé J, Bourdon E, Pivert G, Friguet B, Delcayre C, Delabar JM, Janel N. Cystathionine beta synthase deficiency promotes oxidative stress, fibrosis, and steatosis in mice liver. Gastroenterology. 2005;128:1405-1415. [PubMed] [DOI] |
| 7. | Sugimoto R, Enjoji M, Kohjima M, Tsuruta S, Fukushima M, Iwao M, Sonta T, Kotoh K, Inoguchi T, Nakamuta M. High glucose stimulates hepatic stellate cells to proliferate and to produce collagen through free radical production and activation of mitogen-activated protein kinase. Liver Int. 2005;25:1018-1026. [PubMed] [DOI] |
| 8. | Burt AD. C. L. Oakley Lecture (1993). Cellular and molecular aspects of hepatic fibrosis. J Pathol. 1993;170:105-114. [PubMed] [DOI] |
| 9. | Gandhi CR, Stephenson K, Olson MS. Endothelin, a potent peptide agonist in the liver. J Biol Chem. 1990;265:17432-17435. [PubMed] |
| 10. | Saile B, Knittel T, Matthes N, Schott P, Ramadori G. CD95/CD95L-mediated apoptosis of the hepatic stellate cell. A mechanism terminating uncontrolled hepatic stellate cell proliferation during hepatic tissue repair. Am J Pathol. 1997;151:1265-1272. [PubMed] |