修回日期: 2012-03-08
接受日期: 2012-04-25
在线出版日期: 2012-05-28
目的: 观察金荞麦(Fagopyrum cymosum, Fag)提取物对肠易激综合征(irritable bowel syndrome, IBS)样结肠刺激(colon irritation, CI)模型内脏高敏感性的改善作用以及对动物脊髓背角内5-HT及其受体的影响.
方法: 采用结肠刺激新生期乳大鼠来制作IBS样CI模型. CI大鼠成年后给予口服Fag 2 wk, 并用腹壁撤退反射(AWR)评分来评价给药后CI大鼠内脏高敏感性的变化, 取大鼠脊髓用免疫组织化学法观察5-HT免疫染色, 用蛋白印迹法检测5-HT1A受体(5-HT1AR)、5-HT3A受体(5-HT3AR)表达.
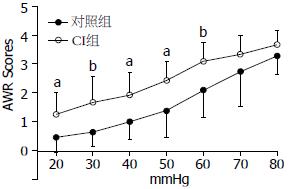
结果: 和对照组比, CI组大鼠AWR评分明显增高(20 mmHg: 0.625±0.518 vs 1.333±0.778; 30 mmHg: 0.750±0.463 vs 1.667±0.888; 40 mmHg: 1.125±0.641 vs 2.000±0.739; 50 mmHg: 1.500±0.926 vs 2.583±0.793; 60 mmHg: 2.125±0.991 vs 3.083±0.669; 均P<0.05); 且脊髓内5-HT染色度增加(11.250±4.833 vs 21.125±7.827, P<0.01), 5-HT3A受体表达升高(179.038±29.786, P<0.01), 5-HT1A受体则表达降低(64.523±16.873, P<0.01); 高剂量Fag可降低CI大鼠AWR评分(20 mmHg: 0.250±0.002; 30 mmHg: 0.875±0.044; 40 mmHg: 1.250±0.036; 50 mmHg: 1.875±0.050; 60 mmHg: 2.625±0.037; 均P<0.05), 并下调脊髓内5-HT(13.375±5.579, P<0.05)和5-HT3AR的表达(114.200±20.983, P<0.05), 上调5-HT1AR的表达(93.008±13.523, P<0.05); 低剂量Fag则对CI大鼠的影响不明显.
结论: Fag对IBS样CI大鼠有镇痛作用, 并通过调节其脊髓内5-HT及其受体来改善痛觉过敏.
引文著录: 刘丽娜, 孙志广, 张雪梅, 周梁, 田超, 陈利, 邵铭, 史会连, 郭海燕. 金荞麦提取物干预IBS大鼠脊髓镇痛的机制. 世界华人消化杂志 2012; 20(15): 1290-1295
Revised: March 8, 2012
Accepted: April 25, 2012
Published online: May 28, 2012
AIM: To observe the effect of Fagopyrum cymosum extracts (Fag) on visceral hypersensitivity in rats with irritable bowel syndrome (IBS)-like colon irritation (CI) and to explore the possible mechanisms involved.
METHODS: IBS-like models were created using neonatal CI method. CI adult rats were given Fag intragastrically for 2 wk, and visceral sensitivity was then evaluated using abdominal withdrawal reflex (AWR) score. The expression of 5-hydroxytryptamine (5-HT) in the spinal cord was detected by immunohistochemistry and that of 5-HT1A receptor (5-HT1AR) and 5-HT3A receptor (5-HT3AR) was detected by Western blot.
RESULTS: Compared to control rats, AWR scores in CI rats were significantly increased (20 mmHg: 0.625 ± 0.518 vs 1.333 ± 0.778; 30 mmHg: 0.750 ± 0.463 vs 1.667 ± 0.888; 40 mmHg: 1.125 ± 0.641 vs 2.000 ± 0.739; 50 mmHg: 1.500 ± 0.926 vs 2.583 ± 0.793; 60 mmHg: 2.125 ± 0.991 vs 3.083 ± 0.669; all P < 0.05). In the spinal cord, the expression of 5-HT and 5-HT3AR was enhanced and that of 5-HT1AR expression was reduced in CI rats compared to control rats (all P < 0.01). Fag at a high dose could markedly reduce AWR scores (20 mmHg: 0.250 ± 0.002; 30 mmHg: 0.875 ± 0.044; 40 mmHg: 1.250 ± 0.036; 50 mmHg: 1.875 ± 0.050; 60 mmHg: 2.625 ± 0.037; all P < 0.05), down-regulate the expression of 5-HT and 5-HT3AR, and up-regulate the expression of 5-HT1AR (all P < 0.05) in spinal cord (P < 0.05) in CI rats. Fag at a low dose had no significant effect on CI rats.
CONCLUSION: Fag can exert an analgesic role in IBS-like CI rats by regulating 5-HT and its receptors in the spinal cord.
- Citation: Liu LN, Sun ZG, Zhang XM, Zhou L, Tian C, Chen L, Shao M, Shi HL, Guo HY. Analgesic mechanisms of Fagopyrum cymosum extracts in rats with irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2012; 20(15): 1290-1295
- URL: https://www.wjgnet.com/1009-3079/full/v20/i15/1290.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i15.1290
肠易激综合征(irritable bowel syndrome, IBS)的多种发病机制中, 内脏高敏感性(visceral hypersensitivity)即结肠对机械刺激出现内脏痛阈水平下降, 结直肠及躯体出现的痛觉过敏(hyperalgesia)是其最重要的特性[1]. 5-羟色胺(5-hydroxytryptamine, 5-HT)作为单胺类神经递质, 广泛存在于中枢和肠道神经系统, 他可作用于7种5-HT受体发挥不同效应. 其中5-HT1A、5-HT2A、5-HT3、5-HT7受体均参与调节慢性痛[2], 并与IBS的内脏高敏感性密切相关. 目前针对IBS特异性5-HT3受体(5-HT3 receptor, 5-HT3R)拮抗剂如阿洛司琼(alosetron)、格拉司琼(granisetron)等, 虽可改善IBS患者痛阈, 减轻腹痛腹胀, 但其作用靶点单一, 并有严重的心血管不良反应, 因此限制了其在临床的推广应用. 所以, 寻找对IBS敏化中枢有保护作用的多靶向天然药物越来越成为研究的热点.
金荞麦(Fagopyrum cymosum, Fag)具有清热解毒、解痉止痛、健脾利湿的作用. 临床上主要用于治疗肺脓疡, 近年来也发现对痛经、腹痛有较好治疗作用[3]. 孙志广教授通过临床实践, 发现金荞麦对IBS患者的腹痛、腹泻及腹胀均有较好疗效, 并有金荞麦治疗IBS专利1项[4]. 金荞麦提取物的主要活性成分是原花色素类缩合鞣质及其前体混合物[5], 还有黄酮类、多糖类成分. 相关研究表明, 巴豆属树皮(croton celtidifolius bark)提取的原花青素二聚体和多聚体对化学、物理刺激产生的内脏痛和躯体痛都有镇痛作用[6]. 而黑茶多酚提取物茶红素[7]对IBS有止泻作用, 并可能调节5-HT3R. 而黄酮代表槲皮素(quercetin)[8]、芸香苷(rutin)[9]及金丝桃甙(hyperoside)[10]均有一定的炎性镇痛作用. 且槲皮素能浓度依赖性地抑制爪蟾卵母细胞上5-HT3AR电流[11]. 所以推测金荞麦可能通过5-HT相关受体对IBS有痛觉改善作用. 本实验以结肠刺激(colon irritation, CI)IBS样大鼠为研究对象, 观察模型中痛觉通路脊髓上的5-HT及5-HT1AR、5-HT3AR的功能状态, 并用一定浓度Fag干预模型观察其变化, 初步探讨可能的机制.
新生Sprague-Dawley大鼠, 体质量5-6 g. 由上海斯莱克动物中心提供(生产许可证号: SCXK(沪)2011-0005). 为避免雌激素对痛觉敏感性的影响, 我们只选取♂大鼠. 乳大鼠每8-10只与哺乳母鼠1笼. 动物自由进食与饮水, 保持昼夜节律各12 h. 金荞麦浸膏(50%乙醇提取, 主要有效成分为原矢车菊素B-2(procyanidin B2), 含量为598.02 μg/g, 南通精华制药股份有限公司提供), 匹维溴铵(pinaverium bromide, 苏威制药有限公司), DBA显色剂(北京博奥森公司), 兔抗鼠一抗5-HT(Proteintech Group公司, 美国)、兔抗鼠一抗5-HT1AR、兔抗鼠一抗5-HT3AR(Abcam公司, 美国), 羊抗兔二抗IgG(Santa Cruz公司, 美国), IRDye800荧光标记的羊抗兔二抗IgG(Rockland公司, 美国); GAPDH(Bioworld公司, 美国), BCATM试剂盒(Pierce, 上海玉博生物科技). 血管成形术导管(Cordis公司, 美国)、纤维素膜(Gelman Laboratory, 美国, 孔径0.22 μm)、显微镜(Nikon 80i, 日本)、LI-COR Odyssey Infrared凝胶成像系统.
1.2.1 CI模型的制备和实验流程: 新生期CI大鼠模型建立方法参照Al-chaer[12]: 在乳大鼠出生后8-21 d清醒状态下, 将血管成形术导管(直径3 mm, 长度20 mm)从肛门插入降结肠行结肠扩张(colorectal distension, CRD)术. 留置1 min, 间隔30 min再刺激1次. 对照组乳大鼠只捉拿而不行结肠刺激. 出生后第22天断奶, 之后4 wk内不进行任何操作. 直至第7-8周龄大鼠体质量达180 g后, 给予各组动物生理盐水或药物2 wk, 至10-11周龄先评价各组动物内脏敏感性的变化. 最后取各组大鼠组织标本检测指标.
1.2.2 腹壁回撤反射评定: 目前国际公认用腹壁撤退反射(abdominal withdrawal reflex, AWR)来鉴定IBS模型或衡量模型动物的内脏敏感性. 实验前禁食不禁水12-18 h. 乙醚麻醉大鼠, 将刺激球囊(乳胶手套制成, 直径2.5 cm, 长4.0 cm), 自肛门植入降结肠内(气囊末端距肛门1 cm, 另一端连接血压计), 露出部分在大鼠尾根部固定, 以防滑脱. 待大鼠清醒后放透明有机玻璃笼(18 cm×5 cm×7 cm)内. 待动物清醒30 min后开始球囊内注气并记录. 分别给予20、30、40、50、60、70、80 mmHg压力, 观察结肠扩张反应. 每次扩张持续20 s, 间歇2 min, 每个强度重复3次, 取平均值. AWR评分标准参照Al-chaer[12]: 无行为反应, 0分; 给予刺激后大鼠有动作停顿后并见头部有短暂的运动, 1分; 刺激期间见有腹部肌肉收缩, 2分; 如有腹部抬起行为, 3分; 身体拱起, 并抬起盆腔和阴囊者, 4分.
1.2.3 动物及分组: 造模结束后, 将模型组大鼠随机分成4组: 即模型对照组、阳性对照药匹维溴铵组0.02 g/kg、Fag低剂量组6 g/kg和高剂量组24 g/kg. 另取同窝大鼠作正常对照, 每组8-10只. 各组每天分别给予相应药物灌胃, 灌胃容积10 mL/kg, 每天1次, 连续2 wk. 正常组和模型CI组给予以等容量生理盐水.
1.2.4 免疫组织化学染色: 用戊巴比妥钠(40 mg/kg, 腹腔内注射)麻醉大鼠, 开胸经左心室插管至升主动脉, 先以4 ℃生理盐水冲净血液, 再以4 ℃的4%多聚甲醛灌注固定1 h. 取动物腰骶段脊髓(L5-S1)于灌注液中固定24 h. 30%蔗糖沉底保存, OCT包埋. 脊髓横行剖面切片, 片厚4 μm. 用SP法进行免疫组织化学染色. 一抗、二抗均1:200稀释. 各组随机取8张片子观察, 选择腰骶段脊髓(L5-S1)背角高倍视野(×400)下, 用Image J软件统计视野中阳性细胞数(选取3个不同视野计数后取平均值).
1.2.5 Western blot: 大鼠脱颈致死后, 快速取出腰骶段脊髓(L5-S1)于液氮中保存. 用匀浆器将组织匀浆, 每100 mg样本加500 μL裂解液, 离心(12 500 r/min, 15 min, 4 ℃)后取上清. 蛋白定量用BCA试剂盒检测. 煮样5 min, 4 ℃保存. 再取等分上清, 含匹配50 μg蛋白量, SDS-PAGE中分离电泳. 然后转膜、染色、剪膜、脱色、封闭、洗膜. 1:1 000稀释一抗后孵育, 4 ℃震荡过夜; 1:5 000稀释二抗后, 37 ℃下振摇90 min. GAPDH按1:1 000稀释作为内参对照.
统计学处理 所获取数据用SPSS18.0 for windows软件统计处理, 以mean±SD表示. 方差齐性检验用方差分析(ANOVA), 两两比较采用t检验. 用GraphPad-InStat version 5.01软件画图. P<0.05有统计学意义.
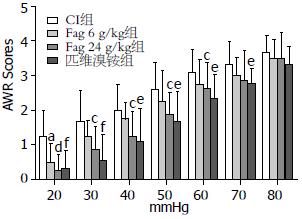
同一CRD水平(20-60 mmHg)下的AWR评分, 同周龄的对照组和模型组大鼠有显著性差异(20 mmHg: 0.625±0.518 vs 1.333±0.778; 30 mmHg: 0.750±0.463 vs 1.667±0.888; 40 mmHg: 1.125±0.641 vs 2.000±0.739; 50 mmHg: 1.500±0.926 vs 2.583±0.793; 60 mmHg: 2.125±0.991 vs 3.083±0.669; 均P<0.05, 图1). 证实CI大鼠存在内脏敏化, 且不受盐水等灌胃因素的影响. 与同周龄的模型大鼠比, Fag低剂量组的AWR评分仅在CRD 20 mmHg压力下显著下降(20 mmHg: 0.500±0.534; P<0.05); 而Fag高剂量治疗组的AWR评分在CRD 20-60 mmHg压力下均有显著下降(20 mmHg: 0.250±0.002; 30 mmHg: 0.875±0.044; 40 mmHg: 1.250±0.036; 50 mmHg: 1.875±0.050; 60 mmHg: 2.625±0.037; 均P<0.05); 而匹维溴铵组的AWR评分在CRD 20-70 mmHg压力下, 也均显著下降, 且差异更明显(20 mmHg: 0.333±0.003; 30 mmHg: 0.556±0.006; 40 mmHg: 1.111±0.024; 50 mmHg: 1.667±0.021; 60 mmHg: 2.333±0.023; 70 mmHg: 2.778±0.040; P<0.05, 图2).
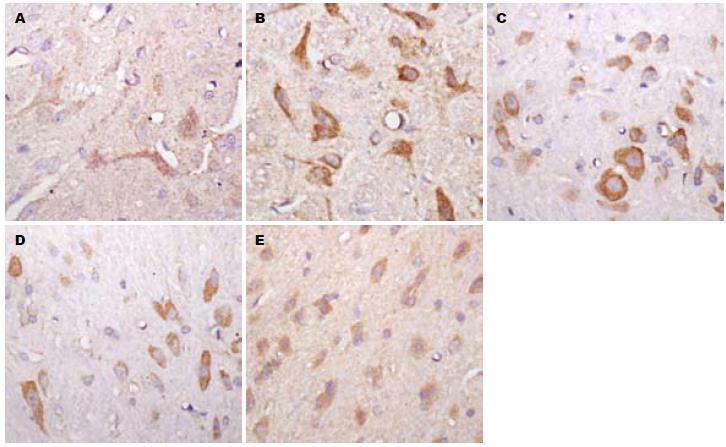
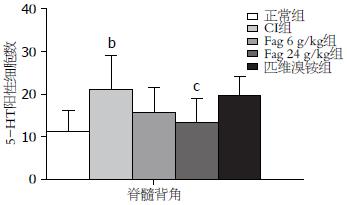
5-HT阳性神经元细胞主要为胞质棕黄色染色(图3). 在对照组, 5-HT阳性细胞主要分布于脊髓背角的Ⅰ、Ⅱ、Ⅴ、Ⅹ区, 表达量较少且胞体较小; 而CI模型组脊髓背角5-HT阳性细胞数量增多、胞体增大、染色加深, 且阳性细胞数量与对照组比明显增加(11.250±4.833 vs 21.125±7.827, P<0.01). 而与模型组比, Fag高剂量可明显下调5-HT阳性细胞数在脊髓背角的表达(13.375±5.579, P<0.05); Fag低剂量可在一定程度上降低5-HT阳性细胞的染色度, 但对其数量的改变无显著性差异(15.625±5.951, P>0.05); 匹维溴铵可在一定程度上降低5-HT阳性细胞胞体大小, 但是对其阳性细胞的数量改变亦无显著性差异(19.750±4.367, P>0.05, 图4).
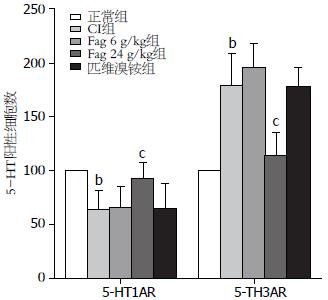
与对照组相比, CI模型组脊髓背角5-HT1AR蛋白表达下降(64.523±16.873 vs 100, P<0.01), 而5-HT3AR蛋白表达则明显升高(179.038±29.786 vs 100, P<0.01, 图5). Fag表现出一定的调节作用, 与模型组比, Fag低剂量对5-HT1AR、5-HT3AR表达趋势影响不明显(5-HT1AR: 65.678±19.268; 5-HT3AR: 196.683±21.020, P>0.05); 但Fag高剂量则可显著升高5-HT1AR表达(93.008±13.523, P<0.05), 显著降低5-HT3AR的表达(114.200±20.983, P<0.05), 使二者接近正常组(P>0.05, 图6).
脊髓背角(spinal dorsal horn)是感觉信息整合的初级中枢, 他由初级感觉传入神经、中间神经元、脊髓投射神经元和脊髓下行纤维构成了神经网络[13]. 而腰骶段脊髓的生化改变及受体功能异常是IBS产生的病理基础[14]. 既往研究表明, IBS患者体内5-HT水平增高[15], 而5-HT对痛觉信号的下行通路起双重调控作用: 电化学促进脊髓内5-HT释放并作用于脊髓内5-HT1A受体产生镇痛作用[16,17]. 而机械性刺激或神经损伤导致神经可塑性变化, 5-TH作用于5-HT3受体, 发挥加强痛觉过敏的作用[18]. 5-HT1A受体分自身受体(突触前膜受体)和突触后膜受体两种, 突触后的5-HT1A受体主要在脊髓丘脑束神经元浅层[19]、脊髓背角椎板深层Ⅹ区[20]和脊髓GABA能中间神经元[21]. 慢性痛觉过程主要由突触后膜5-HT1A受体激动产生镇痛效应, 而前膜受体已脱敏[22]. 人脑成像亦表明, 5-HT1A受体高表达的受试者, 在冷压痛试验(a cold pressor pain test)中对痛觉强度的感受性较低[23]. 所以众多研究表明激动5-HT1A受体有较强的镇痛效果[24,25]. 而5-HT3受体在脊髓内主要分布在后角浅层的兴奋性中间神经元[26]和NK1投射神经元所在的Ⅰ/Ⅲ区域内[27]. 他有1A、1B两种亚基, 在外周主要是加强伤害性刺激, 与Kawamata等[28]的研究结果不同, 更多实验阐明, 中枢性痛及慢性痛在传导机制中, 5-HT3受体激活起到敏化脊髓神经元和易化脊髓活性增强的作用[29], 且不参与急性痛觉过程[30]. 中枢性的5-HT3受体抑制剂昂丹司琼(Ondansetron)[31]、托烷司琼(tropisetron)[32]和多拉司琼(dolasetron)[33]均有抗神经性痛的作用.
本实验用Al-Chaer's法成功制造IBS样内脏高敏感CI模型, 且CI模型属于机械刺激的慢性痛觉模型, 在新生期使大鼠感觉神经发生可塑性变化, 导致痛觉过敏具有不随时间变化的稳定性[12]. 且发现IBS样CI模型大鼠的脊髓内5-HT免疫染色较对照组显著增高, 和以往报道一致. Western blot又表明CI大鼠脊髓内5-HT3受体亚型中的5-HT3A蛋白表达升高, 而5-HT1A蛋白表达降低, 这与5-HT在脊髓下行通路中增强痛觉过敏的作用相呼应. 说明机械刺激产生了高水平5-HT, 后者与高水平的5-HT3受体作用产生的易化痛觉效应较强, 而与低表达的5-HT1A受体作用产生的抗痛效应较弱, 最终模型表现为内脏痛觉过敏. 实验中用药物Fag干预后, 可缓解一定CRD压力下CI大鼠的痛觉过敏, 并呈现一定的剂量依赖性. 首先Fag降低脊髓内升高的5-HT表达, 其次上调了模型中降低的5-HT1A受体蛋白表达, 最后又下调了模型中增高的5-HT3A受体表达.
总之, Fag中以单宁类成分原矢车菊素B-2为主的多种物质可能通过抗炎、抗氧自由基保护神经细胞膜, 阻止神经递质5-HT产生和释放; 同时也可能通过上游信号通路, 一方面拮抗配体型受体5-HT3A表达, 另一方面促进G蛋白偶联体超家族的5-HT1A受体表达, 在脊髓内从多个靶点、多个途径改善IBS模型的痛觉过敏, 起到镇痛治疗作用. 但确切的机制还需进一步深入研究.
感谢孔悦与胡玉转同志在本 实验中给予的大力帮助.
临床已发现金荞麦对肠易激综合征(IBS)患者的腹痛、腹泻及腹胀均有较好疗效, 且其重要成分原花青素多聚体、黄酮类物质均有研究发现有镇痛的作用. 5-羟色胺(5-HT)及其受体广泛存在于中枢和肠道神经系统, 参与调解IBS的慢性痛觉过敏.
潘秀珍, 教授, 主任医师, 福建省立医院消化科
研究表明, IBS患者肥大细胞活化, 引起多种组织胺、5-HT、P物质等释放, 作用于初级传入纤维上的受体, 如5-HT3R, 增强神经介导的胃肠道运动与分泌增加, 引起内脏痛觉刺激, 导致腹痛.
本文初步研究发现IBS样CI模型大鼠的脊髓内5-HT的免疫表达, 以及5-HT1AR和5-HT3AR的表达变化, 并研究了Fag对模型动物脊髓内这些痛觉信号的影响.
从动物模型验证了Fag对IBS有一定的治疗意义, 并且是通过脑肠轴的脊髓内痛觉相关信号起作用. 为进一步研究金荞麦在脊髓内的镇痛机制打开思路, 为下一步金荞麦的临床应用奠定了理论基础.
金荞麦: 我国民间常用的一种中草药, 药用其根茎. 性平、微凉、味苦、酸涩, 归肺、胃、脾经. 具有清热解毒, 健脾止泻, 祛风活血祛痰除湿、收敛止血、润肺补肾、软坚散结等功效. 现代药理学研究证明, 金荞麦成分中的单宁类物质有较强的抗氧化、抗酶、免疫调节、抗炎、抗癌作用.
本研究立题有依据, 方法先进, 动物模型规范, 对照组设计合理, 结果可信, 论点明确, 对临床IBS的研究和治疗有一定的参考意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Mayer EA, Gebhart GF. Basic and clinical aspects of visceral hyperalgesia. Gastroenterology. 1994;107:271-293. [PubMed] |
| 2. | Bardin L. The complex role of serotonin and 5-HT receptors in chronic pain. Behav Pharmacol. 2011;22:390-404. [PubMed] [DOI] |
| 3. | 闫 继兰. 金荞麦的临床应用. 中国民族民间医药杂志. 2003;62:182-183. |
| 4. | 孙 志广, 周 云中, 王 兆龙. 金荞麦胶囊、片在制备治疗肠易激综合症的药物中的应用. 中国专利 200710022046.3 2007-04-26. |
| 6. | DalBó S, Jürgensen S, Horst H, Ruzza AA, Soethe DN, Santos AR, Pizzolatti MG, Ribeiro-do-Valle RM. Antinociceptive effect of proanthocyanidins from Croton celtidifolius bark. J Pharm Pharmacol. 2005;57:765-771. [PubMed] [DOI] |
| 7. | Jafari K, Faghihi M, Gharibzadeh S. Black tea extract and its major polyphenolic pigment may ameliorate the gastrointestinal disorder in irritable bowel syndrome. Med Hypotheses. 2006;67:419. [PubMed] [DOI] |
| 8. | Shaik YB, Castellani ML, Perrella A, Conti F, Salini V, Tete S, Madhappan B, Vecchiet J, De Lutiis MA, Caraffa A. Role of quercetin (a natural herbal compound) in allergy and inflammation. J Biol Regul Homeost Agents. 2006;20:47-52. [PubMed] |
| 10. | Zhang XN, Li JM, Yang Q, Feng B, Liu SB, Xu ZH, Guo YY, Zhao MG. Anti-apoptotic effects of hyperoside via inhibition of NR2B-containing NMDA receptors. Pharmacol Rep. 2010;62:949-955. [PubMed] |
| 11. | Lee BH, Pyo MK, Lee JH, Choi SH, Shin TJ, Lee SM, Lim Y, Han YS, Paik HD, Cho SG. Differential regulations of quercetin and its glycosides on ligand-gated ion channels. Biol Pharm Bull. 2008;31:611-617. [PubMed] [DOI] |
| 12. | Al-Chaer ED, Kawasaki M, Pasricha PJ. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development. Gastroenterology. 2000;119:1276-1285. [PubMed] [DOI] |
| 13. | Cervero F, Iggo A. The substantia gelatinosa of the spinal cord: a critical review. Brain. 1980;103:717-772. [PubMed] [DOI] |
| 14. | Jänig W, Morrison JF. Functional properties of spinal visceral afferents supplying abdominal and pelvic organs, with special emphasis on visceral nociception. Prog Brain Res. 1986;67:87-114. [PubMed] [DOI] |
| 15. | Bearcroft CP, Perrett D, Farthing MJ. Postprandial plasma 5-hydroxytryptamine in diarrhoea predominant irritable bowel syndrome: a pilot study. Gut. 1998;42:42-46. [PubMed] [DOI] |
| 16. | Millan MJ. Descending control of pain. Prog Neurobiol. 2002;66:355-474. [PubMed] [DOI] |
| 17. | Viisanen H, Pertovaara A. Roles of the rostroventromedial medulla and the spinal 5-HT(1A) receptor in descending antinociception induced by motor cortex stimulation in the neuropathic rat. Neurosci Lett. 2010;476:133-137. [PubMed] [DOI] |
| 18. | Ossipov MH, Dussor GO, Porreca F. Central modulation of pain. J Clin Invest. 2010;120:3779-3787. [PubMed] [DOI] |
| 19. | Marlier L, Teilhac JR, Cerruti C, Privat A. Autoradiographic mapping of 5-HT1, 5-HT1A, 5-HT1B and 5-HT2 receptors in the rat spinal cord. Brain Res. 1991;550:15-23. [PubMed] [DOI] |
| 20. | Laporte AM, Koscielniak T, Ponchant M, Vergé D, Hamon M, Gozlan H. Quantitative autoradiographic mapping of 5-HT3 receptors in the rat CNS using [125I]iodo-zacopride and [3H]zacopride as radioligands. Synapse. 1992;10:271-281. [PubMed] [DOI] |
| 21. | Wang YY, Wei YY, Huang J, Wang W, Tamamaki N, Li YQ, Wu SX. Expression patterns of 5-HT receptor subtypes 1A and 2A on GABAergic neurons within the spinal dorsal horn of GAD67-GFP knock-in mice. J Chem Neuroanat. 2009;38:75-81. [PubMed] [DOI] |
| 22. | Colpaert FC, Deseure K, Stinus L, Adriaensen H. High-efficacy 5-hydroxytryptamine 1A receptor activation counteracts opioid hyperallodynia and affective conditioning. J Pharmacol Exp Ther. 2006;316:892-899. [PubMed] [DOI] |
| 23. | Martikainen IK, Hirvonen J, Kajander J, Hagelberg N, Mansikka H, Någren K, Hietala J, Pertovaara A. Correlation of human cold pressor pain responses with 5-HT(1A) receptor binding in the brain. Brain Res. 2007;1172:21-31. [PubMed] [DOI] |
| 24. | Rojas-Corrales MO, Ortega-Alvaro A, Gibert-Rahola J, Roca-Vinardell A, Micó JA. Pindolol, a beta-adrenoceptor blocker/5-hydroxytryptamine(1A/1B) antagonist, enhances the analgesic effect of tramadol. Pain. 2000;88:119-124. [PubMed] [DOI] |
| 25. | Rojas-Corrales MO, Berrocoso E, Micó JA. Role of 5-HT1A and 5-HT1B receptors in the antinociceptive effect of tramadol. Eur J Pharmacol. 2005;511:21-26. [PubMed] [DOI] |
| 26. | Kia HK, Miquel MC, McKernan RM, Laporte AM, Lombard MC, Bourgoin S, Hamon M, Vergé D. Localization of 5-HT3 receptors in the rat spinal cord: immunohistochemistry and in situ hybridization. Neuroreport. 1995;6:257-261. [PubMed] [DOI] |
| 27. | Maxwell DJ, Kerr R, Rashid S, Anderson E. Characterisation of axon terminals in the rat dorsal horn that are immunoreactive for serotonin 5-HT3A receptor subunits. Exp Brain Res. 2003;149:114-124. [PubMed] |
| 28. | Kawamata T, Omote K, Toriyabe M, Yamamoto H, Namiki A. The activation of 5-HT(3) receptors evokes GABA release in the spinal cord. Brain Res. 2003;978:250-255. [PubMed] [DOI] |
| 29. | Kayser V, Elfassi IE, Aubel B, Melfort M, Julius D, Gingrich JA, Hamon M, Bourgoin S. Mechanical, thermal and formalin-induced nociception is differentially altered in 5-HT1A-/-, 5-HT1B-/-, 5-HT2A-/-, 5-HT3A-/- and 5-HTT-/- knock-out male mice. Pain. 2007;130:235-248. [PubMed] [DOI] |
| 30. | Zeitz KP, Guy N, Malmberg AB, Dirajlal S, Martin WJ, Sun L, Bonhaus DW, Stucky CL, Julius D, Basbaum AI. The 5-HT3 subtype of serotonin receptor contributes to nociceptive processing via a novel subset of myelinated and unmyelinated nociceptors. J Neurosci. 2002;22:1010-1019. [PubMed] |
| 31. | McCleane GJ, Suzuki R, Dickenson AH. Does a single intravenous injection of the 5HT3 receptor antagonist ondansetron have an analgesic effect in neuropathic pain? A double-blinded, placebo-controlled cross-over study. Anesth Analg. 2003;97:1474-1478. [PubMed] [DOI] |
| 32. | Färber L, Stratz T, Brückle W, Späth M, Pongratz D, Lautenschläger J, Kötter I, Zöller B, Peter HH, Neeck G. Efficacy and tolerability of tropisetron in primary fibromyalgia--a highly selective and competitive 5-HT3 receptor antagonist. German Fibromyalgia Study Group. Scand J Rheumatol Suppl. 2000;113:49-54. [PubMed] |
| 33. | Vergne-Salle P, Dufauret-Lombard C, Bonnet C, Simon A, Trèves R, Bonnabau H, Bertin P. A randomised, double-blind, placebo-controlled trial of dolasetron, a 5-hydroxytryptamine 3 receptor antagonist, in patients with fibromyalgia. Eur J Pain. 2011;15:509-514. [PubMed] [DOI] |