修回日期: 2012-04-30
接受日期: 2012-05-10
在线出版日期: 2012-05-28
目的: 探讨自由基清除剂依达拉奉对大鼠急性坏死性胰腺炎的保护作用及其机制.
方法: 90只♂SD大鼠随机分为假手术组(SHAM组)、坏死性胰腺炎组(ANP组)、依达拉奉治疗组(EDA组), 每组30只. SHAM组为开腹后只翻动十二指肠及胰腺后关腹; ANP组胰胆管内逆行输注1.5%脱氧胆酸钠制备急性坏死性胰腺炎模型; EDA组为ANP造模后立即尾静脉注射依达拉奉(6 mg/kg). 分别于术后6、12、24 h处死大鼠(每个时点10只), 观察胰腺病理形态改变并评分; 检测血清淀粉酶、TNF-α、ET-1、sICAM-1含量; 检测胰腺组织中丙二醛(MDA)含量及总超氧化物歧化酶(T-SOD)活力.
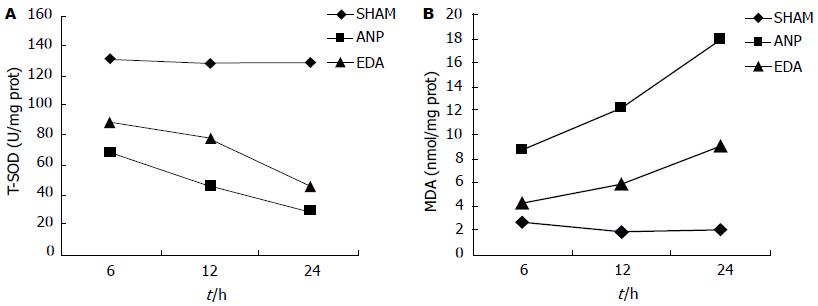
结果: 与ANP组比较, EDA治疗组在胰腺病理改变、血清TNF-α水平(6 h: 109.6 ng/L±49.0 ng/L vs 190.2 ng/L±46.6 ng/L, 12 h: 405.4 ng/L±116.3 ng/L vs 559.7 ng/L±203.9 ng/L, 24 h: 415.4 ng/L±164.6 ng/L vs 648.7 ng/L±222.1 ng/L, 均P<0.05)、血清ET-1水平(6 h: 45.6 ng/L±13.5 ng/L vs 66.0 ng/L±16.0 ng/L, 12 h: 83.5 ng/L±15.4 ng/L vs 96.8 ng/L±23.0 ng/L, 24 h: 85.1 ng/L±25.8 ng/L vs 103.9 ng/L±28.9 ng/L), 血清sICAM-1水平(6 h: 0.58 ng/L±0.13 ng/L vs 0.78 ng/L±0.14 ng/L, 12 h: 0.78 ng/L±0.10 ng/L vs 0.94 ng/L±0.12 ng/L, 24 h: 0.96 ng/L±0.16 ng/L vs 1.24 ng/L±0.30 ng/L, 均P<0.05)、胰腺组织MDA含量 (6 h: 4.22 nmol/mgprot±0.40 nmol/mgprot vs 8.79 nmol/mgprot±0.80 nmol/mgprot, 12 h: 5.90 nmol/mgprot±0.51 nmol/mgprot vs 12.30 nmol/mgprot±1.02 nmol/mgprot, 24 h: 9.10 nmol/mgprot±0.84 nmol/mgprot vs17.88 nmol/mgprot±1.43 nmol/mgprot)均有不同程度减轻(均P<0.05), T-SOD活力增强(6 h: 88.6 U/mgprot±7.1 U/mgprot vs 68.8 U/mgprot±10.5 U/mgprot, 12 h: 77.6 U/mgprot±6.8 U/mgprot vs 46.0 U/mgprot±8.9 U/mgprot, 24 h: 45.5 U/mgprot±5.3 U/mgprot vs 27.8 U/mgprot±4.3 U/mgprot, 均P<0.05); 血清淀粉酶变化无显著差异. 与SHAM组比较, ANP组胰腺组织病理评分、血清淀粉酶、TNF-α、ET-1、sICAM-1明显升高, 胰腺组织MDA含量升高, T-SOD活力下降, 差异均有统计学意义.
结论: 依达拉奉可以清除坏死性胰腺炎体内过量生成的氧自由基并减少炎性因子的表达, 减轻胰腺组织损伤.
引文著录: 张瑜红, 唐国都, 许志毅, 蔡莉. 依达拉奉对大鼠急性坏死性胰腺炎的保护作用. 世界华人消化杂志 2012; 20(15): 1284-1289
Revised: April 30, 2012
Accepted: May 10, 2012
Published online: May 28, 2012
AIM: To investigate whether edaravone has protective effects against acute necrotizing pancreatitis (ANP) in rats and to explore the possible mechanisms involved.
METHODS: Ninety male Spraque-Dawley rats were randomly and equally divided into sham operation group, ANP group and edaravone treatment group (EDA group). ANP was induced in rats of the ANP and EDA groups by retrograde injection of 1.5% deoxycholate. The EDA group was injected with edaravone (6 mg/kg) via the tail vein immediately after ANP induction. The rats were sacrificed 6, 12, and 24 h after the operation. Pathological changes in the pancreas were observed and graded. Serum levels of amylase, tumor necrosis factor-alpha (TNF-α), endothelin-1 (ET-1) and soluble intercellular adhesion molecule-1 (sICAM-1), as well as malonic dialdehyde (MDA) content and superoxide dismutase (T-SOD) activity in pancreatic tissue were measured.
RESULTS: Compared to the sham operation group, pancreatic pathological scores, serum levels of amylase, TNF-α, ET-1 and sICAM-1, and the contents of MDA in pancreatic tissue were significantly increased, and T-SOD activity in pancreatic tissue was significantly decreased in the ANP group. Compared to the ANP group, pancreatic pathological scores, serum levels of TNF-α (6 h: 109.6 ng/L ± 49.0 ng/L vs 190.2 ng/L ± 46.6 ng/L, 12 h: 405.4 ng/L ± 116.3 ng/L vs 559.7 ng/L ± 203.9 ng/L, 24 h: 415.4 ng/L ± 164.6 ng/L vs 648.7 ng/L ± 222.1 ng/L, all P < 0.05), ET-1 (6 h: 45.6 ng/L ± 13.5 ng/L vs 66.0 ng/L ± 16.0 ng/L, 12 h: 83.5 ng/L ± 15.4 ng/L vs 96.8 ng/L ± 23.0 ng/L, 24 h: 85.1 ng/L ± 25.8 ng/L vs 103.9 ng/L ± 28.9 ng/L, all P < 0.05), and sICAM-1 (6 h: 0.58 ng/L ± 0.13 ng/L vs 0.78 ng/L ± 0.14 ng/L, 12 h: 0.78 ng/L ± 0.10 ng/L vs 0.94 ng/L ± 0.12 ng/L, 24 h: 0.96 ng/L ± 0.16 ng/L vs 1.24 ng/L ± 0.30 ng/L, all P < 0.05), and the contents of MDA in pancreatic tissue (6 h: 4.22 nmol/mgprot ± 0.40 nmol/mgprot vs 8.79 nmol/mgprot ± 0.80 nmol/mgprot, 12 h: 5.90 nmol/mgprot ± 0.51 nmol/mgprot vs 12.30 nmol/mgprot ± 1.02 nmol/mgprot, 24 h: 9.10 nmol/mgprot ± 0.84 nmol/mgprot vs 17.88 nmol/mgprot ± 1.43 nmol/mgprot, all P < 0.05) were reduced, and T-SOD activity was increased (6 h: 88.6 U/mgprot ± 7.1 U/mgprot vs 68.8 U/mgprot ± 10.5 U/mgprot, 12 h: 77.6 U/mgprot ± 6.8 U/mgprot vs 46.0 U/mgprot ± 8.9 U/mgprot, 24 h: 45.5 U/mgprot± 5.3 U/mgprot vs 27.8 U/mgprot ± 4.3 U/mgprot, all P < 0.05) in the EDA group. No significant differences were observed in serum levels of amylase between the ANP and EDA groups.
CONCLUSION: Edaravone can eliminate the excessive generation of oxygen free radicals, down-regulate the expression of inflammatory cytokines, and reduce tissue injury in rats with ANP.
- Citation: Zhang YH, Tang GD, Xu ZY, Cai L. Protective effects of edaravone against acute necrotizing pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(15): 1284-1289
- URL: https://www.wjgnet.com/1009-3079/full/v20/i15/1284.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i15.1284
重型急性胰腺炎(severe acute pancreatitis, SAP)发病急, 病情变化快, 可导致全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS), 其死亡率高达16%-50%[1-3]. 大量的研究表明在SAP的发病过程中, 炎性因子及氧自由基(oxygen free radicals, OFRs)的过度释放起着重要的作用. 因此, 控制炎症介质、氧自由基的过度释放成为阻止轻症胰腺炎向重症胰腺炎发展的重要手段. 依达拉奉(edaravone, EDA)是一种合成的自由基清除和抗氧化剂, 临床研究证实他可减轻缺血再灌注过程中脑细胞的损伤, 已在急性脑梗死患者中广泛应用[4,5], 并在急性心肌梗死患者中取得较好的临床效果[6]. 本研究通过EDA干预急性坏死性胰腺炎大鼠模型, 观察其在SAP中的作用, 为其临床应用提供依据.
90只清洁级♂SD大鼠, 体质量300 g±20 g, 购自广西医科大学实验动物中心, 大鼠随机分为假手术组(SHAM组)、坏死性胰腺炎组(ANP组)、ANP+EDA治疗组, 每组30只.
1.2.1 造模及标本采集: 大鼠术前12 h禁食, 不禁水. 采用10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉. SHAM组剖腹后只翻动十二指肠及胰腺后关腹. ANP组取上腹正中切口开腹, 沿十二指肠内侧找到胰胆管开口, 在开口对侧肠壁剪开一小孔, 用24号静脉留置针斜行从小孔进入肠管, 沿乳头方向探入胆胰管, 同时用无损伤血管夹分别夹住肝门部胆管和注射针, 按1 mL/kg逆行注入1.5%脱氧胆酸钠溶液, 1 min注射完毕, 注射完后仍夹闭维持3 min, 拔出注射针, 松开血管夹, 确认腹腔无活动性出血后缝合肠壁及腹腔. EDA组为制备ANP后立即予EDA注射液(南京先声制药有限公司)6 mg/kg尾静脉注射. 动物模型建立后, 分别于术后6、12、24 h每组各取10只大鼠进行实验. 下腔静脉放血处死大鼠, 留取下腔静脉血4-5 mL保存. 取下腔静脉血, 4 ℃ 3 000 r/min离心10 min, 分离血清保存于-20 ℃备用; 剪取部分胰腺组织40 g/L多聚甲醛固定, 石蜡包埋, 切片及HE染色, 用于光镜观察组织病理改变; 取新鲜胰腺组织加入冰生理盐水制成组织匀浆用于检测 总超氧化物歧化酶(total-superoxide dismutase, T-SOD)活力和丙二醛(malondialdehyde, MDA)含量.
1.2.2 胰腺组织学检查及胰腺病理评分: 胰腺评分标准参照Kusske等[7]标准. 按胰腺水肿、出血、坏死及中性粒细胞浸润4项, 水肿: 无改变(0分)、小叶间灶性水肿(1分)、小叶间弥漫水肿(2分)、小叶广泛分隔(3分)、全小叶分隔(4分); 出血: 无改变(0分)、实质出血面积<25%(1分)、实质出血面积为25%-50%(2分)、实质出血面积为51%-70%(3分)、全小叶分隔(4分); 坏死: 无改变(0分)、导管周围坏死<5%(1分)、灶性坏死5%-20%(2分)、弥漫性实质坏死21%-50%(3分)、严重小叶丧失>50%(4分); 炎细胞浸润: 无改变(0分)、局限导管内(1分)、实质内<50%(2分)、实质内51%-75%(3分)、形成脓肿(4分).
1.2.3 血清淀粉酶(AMS)、TNF-α、ET-1及sICAM-1测定: 采用全自动生化分析仪检测血清淀粉酶; 采用酶联-免疫双抗体夹心法测定血清TNF-α、ET-1、sICAM-1含量.
1.2.4 胰腺组织T-SOD活力、MDA含量测定: 取新鲜胰腺组织制成组织匀浆, 用黄嘌呤氧化酶法检测T-SOD活力, 硫代巴比妥酸法测定MDA含量(测试盒购自南京建成生物工程研究所). 全部操作均严格按照说明书进行.
统计学处理 SPSS13.0统计学软件对实验的所有数据进行统计学分析, 各组数据用mean±SD表示, 组间采用单因素方差分析, 以P<0.05为差异有统计学意义.
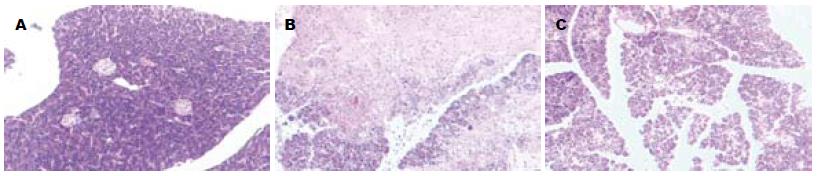
SHAM组大鼠腹腔无积液, 腹腔脏器肉眼观无异常, 光镜下腺泡结构完整, 偶见水肿或少量炎性细胞浸润. ANP、EDA组可见不同程度血性或黄色腹水, 胰腺外观肿胀, 呈暗红或蓝黑色, 表面可见出血点, 光镜下胰腺小灶性坏死, 胰腺实质、间质内有炎症细胞浸润或伴局灶性出血, 符合ANP的病理改变. ANP组及EDA组胰腺病理评分显著高于SHAM组, EDA组病变较ANP减轻(P<0.05, 表1, 图1).
ANP、EDA组各时点血清淀粉酶、TNF-α及sICAM-1均较SHAM组显著升高 (P<0.01); 血清AMS在ANP组与EDA组同一时点间差异无显著性; EDA组各时点与ANP组同一时点比较, TNF-α、ET-1及sICAM-1水平则显著降低(P<0.05或0.01, 表2).
| 分组 | 时点 | AMS(U/L) | TNF-α(ng/L) | ET-1(ng/L) | sICAM-1(ng/L) |
| SHAM组 | 6 | 1556±210 | 68.8±39.2 | 31.0±7.8 | 0.36±0.04 |
| 12 | 1554±224 | 57.6±37.8 | 29.9±7.0 | 0.38±0.06 | |
| 24 | 1609±363 | 66.5±39.7 | 32.1±10.2 | 0.40±0.07 | |
| ANP组 | 6 | 3899±1020b | 190.2±46.6b | 66.0±16.0a | 0.78±0.14b |
| 12 | 5841±1508b | 559.7±203.9b | 96.8±23.0b | 0.94±0.12b | |
| 24 | 5770±1706b | 648.7±222.1b | 103.9±28.9b | 1.24±0.30b | |
| EDA组 | 6 | 3822±1071b | 109.6±49.0bd | 45.6±13.5a | 0.58±0.13bc |
| 12 | 4660±1304b | 405.4±116.3bc | 83.5±15.4bd | 0.78±0.10bd | |
| 24 | 4415±1366b | 415.4±164.6bc | 85.1±25.8bd | 0.96±0.16bc |
近年来, 越来越多的研究表明炎性介质, 包括OFRs及细胞因子所介导的异常免疫反应及微循环障碍在SAP的发生及发展过程中起重要作用[8-11]. 在生理情况下体内存在大量的自由基清除剂, 自由基在体内很快被清除, 因此, 自由基的产生和清除是平衡的. 在病理情况下, 如缺血、缺氧及外伤, 炎症介质诱导的中性粒细胞活化会导致产生大量的OFRs, 造成广泛的破坏.
SAP时OFRs可能由以下途径产生: (1)糜蛋白酶原在游离脂肪酸及胰酶作用下, 激活为糜蛋白酶, 该酶使黄嘌呤脱氢酶(D型)转化为黄嘌呤氧化酶(O型)代谢, 其在催化次黄嘌呤反应中产生OFRs[12]; (2)SAP早期就存在胰腺组织灌注不足、不完全缺血[13], 使得线粒体氧化磷酸化过程受阻, 维持细胞膜两侧离子浓度梯度的泵功能衰竭, Ca2+进入细胞内, 激活黄嘌呤氧化酶, 进而产生OFRs; (3)SAP时腺泡细胞内Ca2+骤然升高可激活NADPH氧化酶亚单位(p47phox, p67phox)由胞浆向胞膜移位, 活化小G蛋白Rac产生OFRs[14]; (4)SAP时由于异常激活的胰酶、脂肪酶及胆汁酸使单核/巨噬细胞、中性粒细胞"呼吸爆发", 在补体、白三烯或内毒素等的刺激下释放OFRs. 氧自由基及其衍生物通过脂肪酸过氧化作用可直接造成类脂膜破坏及溶酶体膜破坏, 对胰腺损害起着重要作用. 研究表明, 在SAP的早期阶段, 因为抗氧化系统耗尽, 过度OFRs释放可损害毛细血管内皮细胞, 增加毛细血管的通透性, 并提高ICAM-1所介导的白细胞-内皮细胞相互作用, 从而诱发胰腺微循环障碍, 加重胰腺损伤[15,16]. 因此, OFRs的产生和清除进程的不平衡是导致胰腺损害加重的重要因素[17].
在一些疾病和组织损伤的动物模型中, 证实了EDA除了减少氧自由基的生成, 还参与调节炎症反应、基质金属蛋白酶水平, 一氧化氮的产生, 细胞凋亡、细胞坏死等过程[18-20]. 我们的研究表明, EDA可以有效的抑制体内脂质过氧化反应, 减少氧自由基的生成, 保护机体抗氧化能力, 同时显著降低SAP促炎性因子的生成, 减轻胰腺病理损伤, 具有一定的抗炎作用.
本实验中我们采用脱氧胆酸钠逆行注入胰胆管, 制备坏死性胰腺炎模型, 病理结果显示胰腺组织具备腺泡细胞颗粒样凝固性坏死等坏死性胰腺炎病理改变. 在我们的实验中, EDA治疗组胰腺病理评分较ANP组显著降低(P<0.05), 病理切片中观察到EDA组胰腺的中性粒细胞的浸润明显减少, 胰腺损伤程度较ANP组有所减轻.
TNF-α在SAP的发病机制中起始动作用, 可诱发IL-1、IL-6、IL-8等其他细胞因子的产生, 引起连锁和放大的"瀑布效应", 致使全身炎症反应及组织损伤[8,21,22]. SAP时组织缺血、缺氧、感染等因素可导致内皮细胞损伤, ET-1大量表达并释放入血, 导致胰腺微血管持续痉挛, 微小动静脉收缩、加重胰腺缺血, 降低胰腺血流灌注[23]. sICAM-1可介导白细胞与血管内皮细胞的黏附及白细胞穿出血管壁, 从而对周围组织的炎症反应及损伤起重要作用. 我们的研究表明ANP组血清TNF-α、ET-1、sICAM-1在造模6 h后3者即显著高于假手术对照组, 并且随时间延长呈增高趋势或持续高水平表达, 说明炎性因子的过度释放、内皮功能的活化导致的微循环障碍及白细胞-内皮细胞的相互作用参与了ANP的发病过程, 国内外的研究也表明TNF-α、ET-1、sICAM-1在胰腺炎的发病中起重要作用, 与胰腺炎的严重程度密切相关[24-26]. 我们的实验观察到EDA治疗组血清ET-1、sICAM显著降低, 说明EDA可以使血管内皮功能受到保护, 减轻胰腺的缺血、缺氧程度. 这与国外的研究结果一致[27,28]. 其可能机制为: (1)EDA可在mRNA水平下调前炎性因子TNF-α表达[29], 这在一定程度上遏制了炎症的级联反应, 减少了炎性因子的过度释放导致的胰腺损伤; (2)前列腺素I2(PGI2)是血管松弛剂, 可抑制血小板变形、黏附作用及白细胞激活, 保护溶酶体, 防止溶酶体向组织内释放造成胰腺损伤. 而EDA可以刺激前列腺素类物质生成, 从而抑制血小板的聚集, 拮抗ET-1收缩血管作用, 减轻了胰腺微循环障碍; (3)EDA可以降低黏附分子的表达, 减少白细胞的黏附聚集及游出, 从而减轻组织损伤.
SOD是具有清除OFRs功能的一种酶, 可对抗与阻断OFRs对细胞造成的损害, 并及时修复受损细胞, 修复OFRs造成的细胞伤害, SOD活力的高低反应了机体清除OFRs的能力. MDA是氧自由基攻击生物膜中的多不饱和脂肪酸, 引发脂质过氧化作用的代谢产物, 其含量反应了机体内脂质过氧化损伤的程度. 通过SOD与MDA的结果分析可反应机体受OFRs攻击的严重程度. 我们的实验结果显示ANP组MDA水平较SHAM组显著升高, SOD活力显著下降, 而EDA治疗组在发病早期就能使MDA含量显著降低, T-SOD活力明显提高(P<0.05), 说明EDA在急性坏死性胰腺炎中能明显减少氧自由基的产生, 提高机体清除氧自由基的能力.
EDA作为一种新型的氧自由基清除剂, 在大鼠坏死性胰腺炎模型中可有效减少机体氧自由基, 提高抗氧化能力, 同时降低促炎因子水平, 对胰腺的保护具有多效性.
氧化应激时产生大量的自由基可导致脂质、蛋白质和核酸过氧化, 细胞膜受损, 造成胰腺细胞的损伤, 是急性坏死性胰腺炎(SAP)发病的重要机制之一. 这些提示清除胰腺炎时过量产生的氧自由基以及提高机体抗氧自由基能力可以减轻胰腺组织损伤, 改善病情.
王炳元, 教授, 中国医科大学附属第一医院消化内科; 黄恒青, 主任医师, 福建省第二人民医院消化内科
依达拉奉(EDA)除了减少氧自由基的生成, 还参与调节炎症反应、基质金属蛋白酶水平, 一氧化氮的产生, 细胞凋亡、细胞坏死等过程.
本越来越多的研究表明炎性介质, 包括氧自由基(OFRs)及细胞因子所介导的异常免疫反应及微循环障碍在SAP的发生及发展过程中起重要作用.
EDA可以有效的抑制体内脂质过氧化反应, 减少氧自由基的生成, 保护机体抗氧化能力, 同时显著降低重型SAP促炎性因子的生成, 减轻胰腺病理损伤, 具有一定的抗炎作用.
本研究方法和实验对照设计合理, 科学结论明确, 能够为临床应用提供依据.
编辑: 张姗姗 电编:鲁亚静
| 2. | Gullo L, Migliori M, Oláh A, Farkas G, Levy P, Arvanitakis C, Lankisch P, Beger H. Acute pancreatitis in five European countries: etiology and mortality. Pancreas. 2002;24:223-227. [PubMed] [DOI] |
| 3. | Lankisch PG, Burchard-Reckert S, Petersen M, Lehnick D, Schirren CA, Köhler H, Stöckmann F, Peiper HJ, Creutzfeldt W. Morbidity and mortality in 602 patients with acute pancreatitis seen between the years 1980-1994. Z Gastroenterol. 1996;34:371-377. [PubMed] |
| 4. | Nakamura T, Kuroda Y, Yamashita S, Zhang X, Miyamoto O, Tamiya T, Nagao S, Xi G, Keep RF, Itano T. Edaravone attenuates brain edema and neurologic deficits in a rat model of acute intracerebral hemorrhage. Stroke. 2008;39:463-469. [PubMed] [DOI] |
| 6. | Tsujita K, Shimomura H, Kawano H, Hokamaki J, Fukuda M, Yamashita T, Hida S, Nakamura Y, Nagayoshi Y, Sakamoto T. Effects of edaravone on reperfusion injury in patients with acute myocardial infarction. Am J Cardiol. 2004;94:481-484. [PubMed] [DOI] |
| 7. | Kusske AM, Rongione AJ, Ashley SW, McFadden DW, Reber HA. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery. 1996;120:284-288; discussion 289. [PubMed] [DOI] |
| 8. | Makhija R, Kingsnorth AN. Cytokine storm in acute pancreatitis. J Hepatobiliary Pancreat Surg. 2002;9:401-410. [PubMed] [DOI] |
| 9. | Bhatia M, Brady M, Shokuhi S, Christmas S, Neoptolemos JP, Slavin J. Inflammatory mediators in acute pancreatitis. J Pathol. 2000;190:117-125. [PubMed] [DOI] |
| 10. | Cuthbertson CM, Christophi C. Disturbances of the microcirculation in acute pancreatitis. Br J Surg. 2006;93:518-530. [PubMed] [DOI] |
| 13. | Kusterer K, Enghofer M, Zendler S, Blöchle C, Usadel KH. Microcirculatory changes in sodium taurocholate-induced pancreatitis in rats. Am J Physiol. 1991;260:G346-G351. [PubMed] |
| 14. | Kim H. Inhibitory mechanism of lycopene on cytokine expression in experimental pancreatitis. Ann N Y Acad Sci. 2011;1229:99-102. [PubMed] [DOI] |
| 15. | Sunamura M, Yamauchi J, Shibuya K, Chen HM, Ding L, Takeda K, Kobari M, Matsuno S. Pancreatic microcirculation in acute pancreatitis. J Hepatobiliary Pancreat Surg. 1998;5:62-68. [PubMed] [DOI] |
| 16. | Keck T, Werner J, Banafsche R, Stalmann A, Schneider L, Gebhard MM, Herfarth C, Klar E. Oxygen radicals promote ICAM-1 expression and microcirculatory disturbances in experimental acute pancreatitis. Pancreatology. 2003;3:156-163. [PubMed] [DOI] |
| 17. | Tadao M, Yuji O. [Role of free radicals in the development of severe acute pancreatitis]. Nihon Rinsho. 2004;62:2015-2020. [PubMed] |
| 18. | Kikuchi K, Uchikado H, Miyagi N, Morimoto Y, Ito T, Tancharoen S, Miura N, Miyata K, Sakamoto R, Kikuchi C. Beyond neurological disease: new targets for edaravone (Review). Int J Mol Med. 2011;28:899-906. [PubMed] |
| 19. | Tamamura M, Saito M, Kinoshita Y, Shimizu S, Satoh I, Shomori K, Dimitriadis F, Satoh K. Protective effect of edaravone, a free-radical scavenger, on ischaemia-reperfusion injury in the rat testis. BJU Int. 2010;105:870-876. [PubMed] [DOI] |
| 21. | Malleo G, Mazzon E, Siriwardena AK, Cuzzocrea S. Role of tumor necrosis factor-alpha in acute pancreatitis: from biological basis to clinical evidence. Shock. 2007;28:130-140. [PubMed] [DOI] |
| 22. | Giakoustidis A, Mudan SS, Giakoustidis D. Dissecting the stress activating signaling pathways in acute pancreatitis. Hepatogastroenterology. 2010;57:653-656. [PubMed] |
| 23. | Foitzik T, Eibl G, Hotz HG, Faulhaber J, Kirchengast M, Buhr HJ. Endothelin receptor blockade in severe acute pancreatitis leads to systemic enhancement of microcirculation, stabilization of capillary permeability, and improved survival rates. Surgery. 2000;128:399-407. [PubMed] [DOI] |
| 24. | 李 春燕, 雍 桂珍, 冯 迎春, 贺 国斌, 向 军英, 明 文. 急性胰腺炎患者sICAM-1、TNF-α和D-二聚体水平与病情严重程度的关系. 世界华人消化杂志. 2010;18:3480-3484. [DOI] |
| 25. | Perejaslov A, Chooklin S, Bihalskyy I. Implication of interleukin 18 and intercellular adhesion molecule (ICAM)-1 in acute pancreatitis. Hepatogastroenterology. 2008;55:1806-1813. [PubMed] |
| 26. | Eibl G, Hotz HG, Faulhaber J, Kirchengast M, Buhr HJ, Foitzik T. Effect of endothelin and endothelin receptor blockade on capillary permeability in experimental pancreatitis. Gut. 2000;46:390-394. [PubMed] [DOI] |
| 27. | Araki Y, Andoh A, Yokono T, Asano N, Yoshikawa K, Bamba S, Ishizuka I, Fujiyama Y. The free radical scavenger edaravone suppresses experimental closed duodenal loop-induced acute pancreatitis in rats. Int J Mol Med. 2003;12:121-124. [PubMed] |
| 28. | Yang T, Mao YF, Liu SQ, Hou J, Cai ZY, Hu JY, Ni X, Deng XM, Zhu XY. Protective effects of the free radical scavenger edaravone on acute pancreatitis-associated lung injury. Eur J Pharmacol. 2010;630:152-157. [PubMed] [DOI] |