修回日期: 2012-03-14
接受日期: 2012-03-25
在线出版日期: 2012-05-08
目的: 探讨影响乙肝后肝硬化合并肝性脑病(hepatic encephalopathy, HE)发生、发展的相关因素, 为预防HE发生及改善预后提供依据.
方法: 回顾性分析2002-03/2011-05在大连医科大学附属第一医院收治的乙肝后肝硬化合并HE患者共87例. 同时选取同期住院的乙肝后肝硬化未合并HE患者52例作为对照. 分别统计入院时的临床表现, 根据West Haven标准和Child-Pugh分级进行HE分期和肝功能分级, 记录入院后各生化指标的第一次结果, 包括血氨、血钠、血清胆碱酯酶、血清总胆红素、血清白蛋白、血尿素氮、血清肌酐、凝血酶原时间. 对以上资料进行对比分析研究, 寻找影响乙肝后肝硬化HE发生、发展的相关因素.
结果: 因HE入院患者中, 感染位居HE诱因首位(35.6%); HEⅡ期所占比例最高(36.8%), Ⅳ期居第2位(25.3%). 合并HE组与未合并HE组比较肝功能分级、腹水、血氨、血钠、血清胆碱酯酶、血清总胆红素、血清白蛋白、血尿素氮、凝血酶原时间均有统计学差异(0:8:79 vs 0:21:31, 19:68 vs 36:16, 20.74±70.44 vs 46.53±10.67, 136.01±6.65 vs 141.48±3.34, 1927.34±70.52 vs 3342.01±38.03, 91.75±84.56 vs 58.98±14.46, 25.53±3.84 vs 29.48±2.58, 13.57±14.76 vs 6.41±1.57, 21.34±7.12 vs 18.59±1.66; both P<0.05). 肝功能程度与HE分期无关, 合并HE患者血氨水平在Ⅳ期较其他各期显著升高(156.91±62.94 vs 104.13±73.07, 112.69±60.87, 104.67±82.00; both P<0.05). 血钠水平在Ⅱ期、Ⅲ期、Ⅳ期较Ⅰ期显著降低(135.22±6.05, 134.91±7.79, 134.55±6.25 vs 139.73±5.15; both P<0.05), 血清胆碱酯酶水平在Ⅳ期较Ⅰ期显著降低(1605.19±76.01 vs 2325.46±71.31, P<0.05). 血尿素氮水平在Ⅳ期较Ⅰ期、Ⅱ期显著升高(21.65±23.69 vs 6.53±3.41, 10.62±7.37; both P<0.05).
结论: 在因HE入院患者中, 感染居乙肝后肝硬化发生HE诱因的首位. 肝功能C级、合并腹水、高血氨、高血清总胆红素、高血尿素氮、低血钠、低血清胆碱酯酶、低血清白蛋白和凝血酶原时间延长可增加HE的发生率. 高血氨、高血尿素氮、低血钠和低血清胆碱酯酶可加重HE的程度, 并影响预后.
引文著录: 张鸣, 段志军. 乙肝后肝硬化合并肝性脑病的影响因素. 世界华人消化杂志 2012; 20(13): 1148-1155
Revised: March 14, 2012
Accepted: March 25, 2012
Published online: May 8, 2012
AIM: To investigate the factors influencing the development and progression of hepatic encephalopathy (HE) in patients with hepatitis B virus (HBV)-related cirrhosis (HBCE).
METHODS: The clinical data for 78 patients with HBCE and 52 patients with HBV-related cirrhosis without HE (HBCNE) treated at the First Affiliated Hospital of Dalian Medical University from March 2002 to May 2011 were retrospectively analyzed. Factors analyzed include gender, age, precipitating factors, ascites, esophageal-gastric varices (EGV), splenomegaly, grade of HE, Child-Pugh grade, blood ammonia (NH4), serum sodium (Na), serum cholinesterase (CHE), serum total bilirubin (TBil), serum albumin (ALB), blood urea nitrogen (BUN), serum creatinine (Cr), and prothrombin time (PT).
RESULTS: Infection was the most common precipitating factor to induce HE in patients with HBV-related cirrhosis (35.6%). Grade Ⅱ HE was most common (36.8%), followed by grade Ⅳ HE (25.3%). Child-Pugh grade, ascites, NH4, Na, CHE, TBil, ALB, BUN, and PT were significantly different between the HBCE and HBCNE groups (0:8:79 vs 0:21:31, 19:68 vs 36:16, 20.74 ± 70.44 vs 46.53 ± 10.67, 136.01 ± 6.65 vs 141.48 ± 3.34, 1927.34 ± 70.52 vs 3342.01 ± 38.03, 91.75 ± 84.56 vs 58.98 ± 14.46, 25.53 ± 3.84 vs 29.48 ± 2.58, 13.57 ± 14.76 vs 6.41 ± 1.57, 21.34 ± 7.12 vs 18.59 ± 1.66; all P < 0.05). The level of NH4 in patients with grade Ⅳ HE was significantly higher than those in patients with gradeⅠ, Ⅱ or Ⅲ HE (156.91 ± 62.94 vs 104.13 ± 73.07, 112.69 ± 60.87, 104.67 ± 82.00; all P < 0.05). Compared to patients with gradeⅠHE, the levels of Na in patients with grade Ⅱ, Ⅲ or Ⅳ HE significantly decreased (135.22 ± 6.05, 134.91 ± 7.79, 134.55 ± 6.25 vs 139.73 ± 5.15; all P < 0.05), and CHE declined in patients with grade Ⅳ HE (1605.19 ± 76.01 vs 2325.46 ± 71.31, P < 0.05). The level of BUN in patients with grade Ⅳ HE was higher than those in patients with gradeⅠor Ⅱ HE (21.65 ± 23.69 vs 6.53 ± 3.41, 10.62 ± 7.37; both P < 0.05).
CONCLUSION: Preventing and controlling infection could decrease the incidence of HE in patients with HBV-related cirrhosis. High levels of NH4, TBil and BUN, low levels of Na, CHE and ALB, Child-Pugh grade C, ascites, and prolonged PT could increase the incidence of HBCE. High levels of NH4 and BUN, and low levels of Na and CHE are associated with more severe HE.
- Citation: Zhang M, Duan ZJ. Retrospective analysis of factors influencing the development and progression of hepatic encephalopathy in patients with hepatitis B virus-related cirrhosis. Shijie Huaren Xiaohua Zazhi 2012; 20(13): 1148-1155
- URL: https://www.wjgnet.com/1009-3079/full/v20/i13/1148.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i13.1148
肝性脑病(hepatic encephalopathy, HE)是以严重肝脏疾病和/或门体分流所致的代谢紊乱为基础, 并排除了其他已知脑病的中枢神经系统功能失调综合征. 目前世界消化病协会(World Congress of Gastroenterology, WCOG)制定了维也纳分类, 按肝脏功能失调或障碍的性质将HE分为3种主要类型[1]: A型, 急性肝功能衰竭相关HE; B型, 严重的门体分流相关HE; C型, 肝硬化和门脉高压和/或门体分流相关HE, 是最常见的类型, 按临床症状又分为轻微型HE和症状型HE.
在我国, 大多数HE为C型. C型HE大部分是由各种肝硬化引起, 其中以肝炎后肝硬化最多见. 乙型肝炎病毒(hepatitis B virus, HBV)的感染是全球范围内最常见的一种感染性疾病[2]. 而我国又是乙型肝炎的高流行区, 全国HBV携带率为9.7%, 其中25%以上的携带者将发展为慢性肝炎[3]. 而慢性乙型肝炎患者发展为肝硬化的年发生率估计为2.1%[4]. 由于HE发病机制尚未完全明确, 且缺乏特效治疗, 故HE预后差, 死亡率高. 目前国外主要针对A型、B型HE和酒精性肝硬化引起的HE进行动物实验和临床研究, 国内学者则对肝炎后肝硬化HE诊治研究较多, 而针对乙肝后肝硬化HE发生、发展影响因素的临床研究未见报道. 本文对上述影响因素进行分析及研究, 找出与HE发生、发展密切相关的因素, 以便今后可以及时对这些因素进行监测或干预, 减少HE的发生或给予早期防治, 以提高患者的生活质量、延长生存期及改善预后.
选择大连医科大学附属第一医院2002-03/2011-05住院的87例以乙肝后肝硬化合并HE患者为主要诊断病例, 同时选取同期住院的乙肝后肝硬化未合并HE患者52例作为对照. 根据下述诊断标准及排除标准入选. 肝炎后肝硬化诊断标准符合2000-09西安第10次全国病毒性肝炎学术会议修订的诊断标准[5]. HE诊断标准符合第11次世界消化病会议制定的诊断标准[1]. 根据Child-Pugh分级[6]进行肝功能分级. 根据West Haven标准[1]进行HE分期. 排除标准: 排除曾接受腹部手术(上消化道硬化术、脾切除、肝硬化门腔静脉断流术及分流术等)及人工肝支持系统治疗患者; 排除酒精性肝硬化以及其他原因引起的肝硬化患者; 排除肝癌患者; 排除心、肺、肾等重要脏器严重疾病患者; 排除尿毒症、低血糖、糖尿病昏迷等代谢性脑病患者及排除酒精中毒、镇静安眠药、铅、锰、汞等引起的中毒性脑病患者; 排除脑血管疾病、颅内肿瘤、颅内感染等颅脑疾病患者; 排除癫痫、精神病患者及其他原因所致的昏迷或精神行为异常者.
1.2.1 一般情况: 记录87例乙肝后肝硬化合并HE患者和52例乙肝后肝硬化未合并HE患者的性别、年龄、生化指标、病程资料进行对比分析. 分析乙肝后肝硬化合并HE诱因和分期的构成.
1.2.2 对比乙肝后肝硬化合并HE与未合并HE患者的临床特征、生化指标: 临床特征包括性别、年龄、肝功能分级、腹水、食管胃底静脉曲张、脾大情况, 生化指标包括血氨、血钠、血清胆碱酯酶、血清总胆红素、血清白蛋白、血尿素氮、血清肌酐、凝血酶原时间. 所有资料均来自于患者入院时全面系统的病史采集、规范的体格检查及实验检查数据和胃镜、彩超、CT及核磁共振结果.
1.2.3 对比乙肝后肝硬化合并HE患者不同分期的临床特征、生化指标: 临床特征包括HE诱因、肝功能分级、腹水、食管胃底静脉曲张、脾大情况, 生化指标包括血氨、血钠、血清胆碱酯酶、血清总胆红素、血清白蛋白、血尿素氮、血清肌酐、凝血酶原时间.
1.2.4 对比乙肝后肝硬化合并HE患者不同临床特征的血氨水平: 包括不同诱因、肝功能分级、有无腹水、食管胃底静脉曲张、脾大.
统计学处理 采用SPSS11.5软件进行数据统计分析, 定量数据统计用mean±SD, 两组间比较采用t检验, 3组以上组间比较方差齐时采用单因素方差分析, 方差不齐时用秩和检验, 统计构成比用百分数, 定性数据比较采用χ2检验. P<0.05有统计学差异.
因乙肝后肝硬化合并HE入院患者中, HE最常见的诱因是感染(35.6%), 其次是上消化道出血(16.1%)和高蛋白饮食(16.1%). 入院患者中HEⅡ期所占比例最高(36.8%), Ⅳ期居第2位(25.3%), 其次分别为Ⅲ期(20.7%)和Ⅰ期(17.2%).
两组肝功能分级、腹水体征有差异; 血氨、血清总胆红素、血尿素氮水平显著升高, 血钠、血清胆碱酯酶、血清白蛋白水平显著降低, 凝血酶原时间显著延长, 均有统计学差异(P<0.05); 而性别、年龄、食管胃底静脉曲张、脾大、血清肌酐水平在两组之间均无统计学差异(表1).
| 合并HE(n = 87) | 未合并HE(n = 52) | P值 | |
| 性别 | 0.688 | ||
| 男 | 63(72.4%) | 36(69.2%) | |
| 女 | 24(27.6%) | 16(30.8%) | |
| 年龄(岁) | 60.01±11.99 | 67.23±10.32 | 0.187 |
| <45 | 8(9.2%) | 8(15.4%) | |
| 45-54 | 18(20.7%) | 17(32.7%) | |
| 55-64 | 31(35.6%) | 15(28.8%) | |
| ≥65 | 30(34.5%) | 12(23.1%) | |
| 肝功能分级 | 0.000 | ||
| A | 0(0.0%) | 0(0.0%) | |
| B | 8(9.2%) | 21(40.4%) | |
| C | 79(90.8%) | 31(59.6%) | |
| 门脉高压表现 | |||
| 腹水 | 68(78.2%) | 16(30.8%) | 0.000 |
| 食管胃底静脉曲张 | 52(59.8%) | 32(61.5%) | 0.837 |
| 脾大 | 63(72.4%) | 40(76.9%) | 0.557 |
| 生化指标 | |||
| 血氨(μmol/L) | 120.74±70.44 | 46.53±10.67 | 0.000 |
| 血钠(mmol/L) | 136.01±6.65 | 141.48±3.34 | 0.000 |
| 血清胆碱酯酶(U/L) | 1927.34±70.52 | 3342.01±38.03 | 0.000 |
| 血清总胆红素(μmol/L) | 91.75±84.56 | 58.98±14.46 | 0.003 |
| 血清白蛋白(g/L) | 25.53±3.84 | 29.48±2.58 | 0.001 |
| 血尿素氮(mmol/L) | 13.57±14.76 | 6.41±1.57 | 0.000 |
| 血清肌酐(μmol/L) | 110.77±87.07 | 98.55±14.68 | 0.225 |
| 凝血酶原时间(s) | 21.34±7.12 | 18.59±1.66 | 0.029 |
Ⅳ期与其他各期比较, 血氨水平显著升高; 其他各期与Ⅰ期比较, 血钠水平显著降低; Ⅳ期与Ⅰ期比较, 血清胆碱酯酶水平显著降低; Ⅳ期与Ⅰ期、Ⅱ期比较, 血尿素氮水平显著升高, 均有统计学差异(P<0.05). 而不同分期之间诱因、肝功能分级、门脉高压表现(腹水、食管胃底静脉曲张和脾大)、血清总胆红素水平、血清白蛋白水平、血清肌酐水平、凝血酶原时间比较均无统计学差异(表2, 3).
| Ⅰ期(n = 15) | Ⅱ期(n = 32) | Ⅲ期(n = 18) | Ⅳ期(n = 22) | P值 | |
| 诱因 | 0.628 | ||||
| 感染 | 4(26.7) | 12(37.5) | 7(38.9) | 8(36.4) | |
| 上消化道出血 | 1(6.7) | 6(18.8) | 1(5.6) | 6(27.3) | |
| 高蛋白饮食 | 3(20.0) | 4(12.5) | 3(16.7) | 4(18.2) | |
| 电解质紊乱 | 1(6.7) | 2(6.3) | 1(5.6) | 2(9.1) | |
| 肾功不全 | 0(0.0) | 1(3.1) | 3(16.7) | 0(0.0) | |
| 便秘 | 1(6.7) | 2(6.3) | 1(5.6) | 0(0.0) | |
| 医源性因素 | 2(13.3) | 1(3.1) | 1(5.6) | 0(0.0) | |
| 不明原因 | 3(20.0) | 3(9.4) | 1(5.6) | 2(9.1) | |
| 劳累 | 0(0.0) | 1(3.1) | 0(0.0) | 0(0.0) | |
| 肝功能分级 | 0.060 | ||||
| A | 0(0.0) | 0(0.0) | 0(0.0) | 0(0.0) | |
| B | 4(26.7) | 3(9.4) | 1(5.6) | 0(0.0) | |
| C | 11(73.3) | 29(90.6) | 17(94.4) | 22(100.0) | |
| 门脉高压表现 | |||||
| 腹水 | 10(66.7) | 25(78.1) | 13(72.2) | 20(90.9) | 0.305 |
| 食管胃底静脉曲张 | 10(66.7) | 21(65.6) | 9(50.0) | 12(54.5) | 0.633 |
| 脾大 | 11(73.3) | 24(75.0) | 13(72.2) | 15(68.2) | 0.958 |
| 生化指标 | Ⅰ期(n = 15) | Ⅱ期(n = 32) | Ⅲ期(n = 18) | Ⅳ期(n = 22) |
| 血氨(μmol/L) | 104.13±73.07 | 112.69±60.87 | 104.67±82.00 | 156.91±62.94a |
| 血钠(mmol/L) | 139.73±5.15c | 135.22±6.05 | 134.91±7.79 | 134.55±6.25 |
| 胆碱酯酶(U/L) | 2325.46±71.31 | 1981.91±70.12 | 1799.70±52.54 | 1605.19±76.01e |
| 总胆红素(μmol/L) | 66.93±45.68 | 91.11±87.16 | 92.41±74.16 | 111.89±96.85 |
| 白蛋白(g/L) | 26.21±3.82 | 25.47±3.84 | 25.33±5.15 | 25.24±2.75 |
| 尿素氮(mmol/L) | 6.53±3.41 | 10.62±7.37 | 14.69±12.65 | 21.65±23.69g |
| 肌酐(μmol/L) | 70.43±18.04 | 94.68±49.88 | 129.90±75.08 | 147.56±94.48 |
| 凝血酶原时间(s) | 17.79±2.17 | 22.49±9.15 | 23.74±9.28 | 21.19±4.73 |
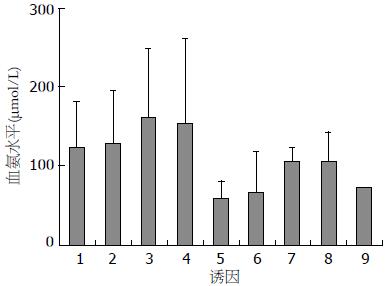
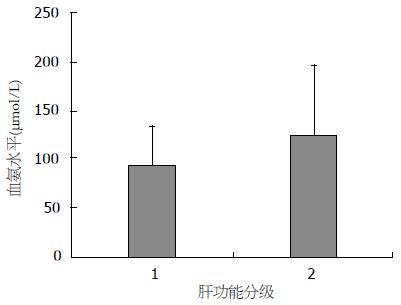
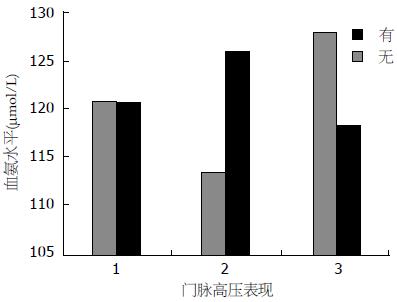
不同诱因、肝功能分级、有无腹水、食管胃底静脉曲张、脾大的血氨水平比较均无统计学差异(图1, 2, 3).
本研究结果显示感染、上消化道出血、高蛋白饮食、电解质紊乱、肾功能不全、便秘、医源性因素(大量利尿放腹水、使用镇静药物等)、劳累等诸多因素都可以诱发HE. 其中, 因HE入院的乙肝后肝硬化患者中, 感染位居诱因首位, 占所有诱因的35.6%, 远远高于上消化道出血和高蛋白饮食. 结果与某些报道[7-9]一致. 与此不同, 国内的有些文献报道上消化道出血是HE的最常见诱因[10]. 存在这种不同的原因可能在于肝硬化病因学选择的差异, 还可能与病例的选择(部分上消化道出血患者住院期间发生HE不列入我们的入选标准)、患者所在的地区及对于上消化道出血和感染的诊出率不同有关. 肝硬化患者由于脾功能亢进, 导致粒细胞减少, 机体免疫能力差, 加之肝脏对体内的细菌、毒素的清除能力降低, 容易并发感染. 古希腊学者认为感染是大脑功能的重要调节因素[11]. 炎症因子影响脑细胞和血脑屏障功能, 引起细胞内新陈代谢异常, 导致脑细胞死亡和脑损伤[12]. 最近的研究表明, 感染与氨毒性有协同作用. 氨不只是对星形细胞产生毒性作用, 而且还诱导中性粒细胞功能障碍释放活性氧, 促进了全身炎症反应, 可能进一步加剧氨毒性和减少中性粒细胞抗炎作用, 产生恶性循环[13]. 另外, 已证实炎症前细胞因子如肿瘤坏死因子-α和白介素在肝衰竭患者的肝脏、大脑中高度表达, 炎症前细胞因子能和氨在引起感染和肝细胞坏死方面起到协同作用, 改变细胞与细胞间的信号传导, 引起兴奋性过度的表现[14]. 近期有学者提出星形细胞能够介导炎性疾病发生, 最终诱导HE[15]. 因此, 乙肝后肝硬化患者应积极预防和控制感染, 可能降低HE的发生率.
根据West Haven标准, 本研究显示乙肝后肝硬化合并HE的入院患者中Ⅱ期居多. 考虑HE已引起乙肝后肝硬化患者及其家属的重视, 能够较早发现, 及时入院治疗, 大大降低了HE的死亡率, 明显改善预后. 近几年又提出轻微型HE, 即无明显HE的临床表现和生化异常, 用精细的智力测验和/或电生理检测可发现异常[1]. 但轻微型HE缺乏明显的临床症状, 极易被忽视, 甚至患者本身也不能察觉[16]. 国内学者已经证实轻微型HE降低了我国慢性肝病患者的生活质量[17]. 但目前我国对轻微型HE重视不够, 对肝硬化患者未能做到全面的检测, 降低了早期HE的诊出率. 临床上大部分HE患者都是出现神经精神症状后入院, 延误了最佳的治疗时机. 因此, 对肝硬化患者应完善智力测验及电生理检测, 并加强对患者及其家属HE相关知识的宣传, 以便更早的发现轻微型HE, 做到早治疗, 提高HE的好转率.
乙肝后肝硬化合并HE组与未合并HE组比较结果显示肝功能分级(Child-Pugh分级)、腹水、血氨、血钠、血清胆碱酯酶、血清总胆红素、血清白蛋白、血尿素氮和凝血酶原时间有统计学差异. Child-Pugh分级能很好的预测肝细胞损害程度[18], 是迄今为止较为科学并在临床上被普遍使用的肝功能评估方法. 他在各种肝病患者的病情评估、治疗效果评价、预后判断及慢性肝病患者的生活质量评估等方面均显示了重要的指导价值[19,20], 也是对肝硬化及其各种并发症病情转归的独立判断预后因素[21,22]. 本研究显示Child-Pugh分级与HE的发生密切相关, C级患者更易发生HE, 结果与国外报道[23]一致. 一项前瞻性研究也发现肝功能从A级发展至C级的肝硬化患者5年内并发HE的概率明显增高[24]. 而轻微型HE到症状型HE的发展过程中Child-Pugh分数也明显增加[25]. 本结果发现除了HE分期外Child-Pugh分级中的评分指标(腹水、血清总胆红素、血清白蛋白和凝血酶原时间)作为独立因素均与HE的发生有密切关系. 有学者建立了肝硬化HE发生的预测模型, 其中包括血清总胆红素和凝血酶原时间[26]. 这些指标对HE发生的影响与Child-Pugh分级一致, 同时也证明这些指标对肝细胞损害程度的评估具有一定的科学性.
肝硬化腹水发生率约为50%, 是肝硬化患者最常见的并发症[27,28]. 腹水是多种因素综合作用的结果. 门脉高压是主要原因, 钠潴留增加, 导致细胞外液增多, 可滞留在腹腔内形成腹水. 低钠血症也与腹水形成和持续存在有关. 虽然目前钠潴留的发病机制尚不明确, 但抗利尿激素分泌增加已证实是主要的低钠血症致病因子. 血钠过低能够导致星形细胞水肿, 引发多种蛋白质和RNA的修改, 影响大脑功能, 其中也影响到了下丘脑结构的改变, 从而出现了HE症状[29]. Shaikh等[30]回顾性分析表明肝硬化患者血钠水平低于130 mmol/L时与正常水平比较, 顽固性腹水和HE的发生率显著升高. 很多研究[31,32]也证实了这种观点. 另外, 有研究发现低血钠水平是乙肝后肝硬化患者发生腹水的独立危险因素[33]. 在乙肝后肝硬化合并HE患者不同分期的比较中显示随HE程度加重血钠水平逐渐降低, 具有统计学差异, 本结果与国外报道[34]一致. 目前已经证实肝硬化患者HE分期越高, 预后越差[35]. 因此, 血钠水平与HE发生、预后密切相关. 综上考虑, 乙肝后肝硬化腹水患者应严格限水, 但不宜盲目的限盐, 在应用强利尿剂的同时, 要注意监测血钠水平, 严重时不仅需饮食补钠, 还要静脉补钠. 积极处理低钠血症对预防HE的发生、改善预后是非常必要的.
血氨是HE发生的最重要因素, 氨中毒学说多年来仍占中心地位[36]. 血清胆碱酯酶是一种肝脏合成后释放到血液中的非特异性酯酶. 血清胆碱酯酶活性降低的程度与肝病严重程度密切相关. 因此, 其活性能较好地反映肝脏的合成功能[37]. 肝肾综合征时肾脏血管收缩, 肾小球滤过率减少[28]. 而血尿素氮水平能粗略反映肾小球滤过功能, 但其也受饮食、蛋白质分解、脱水等因素的影响. 因此临床上常与血清肌酐配合来评价肾功能. 但乙肝后肝硬化合并HE组与未合并HE组比较血清肌酐并无统计学差异, 考虑肝硬化未合并HE患者入院时肝硬化已发展至失代偿期, 部分患者已经伴有不同程度的肾功能不全. 乙肝后肝硬化合并HE组与未合并HE组比较以及合并HE患者不同分期的比较结果说明高血氨、低血清胆碱酯酶和高血尿素氮水平不仅与乙肝后肝硬化HE的发生有关, 而且与HE的预后密切相关. 进一步支持了氨中毒学说, 而Mathurin等[38]研究也表明肝硬化患者肾功能不全时血钠、血清胆碱酯酶水平降低, 血尿素氮水平升高, HE危险系数增加. 国内学者的临床研究证实肝硬化患者的血氨水平在发生肝肾综合征时明显升高, 并且与血尿素氮、血清肌酐水平呈正相关, 进一步说明肝肾综合征在HE的发展中起重要作用[39].虽然本研究中绝大部分的HE患者血氨水平高于正常范围, 但在不同诱因、肝功能分级、有无门脉高压表现之间血氨水平比较却无统计学差异. 说明血氨并不被某一单一因素影响而显著升高, 而是多种毒素诱发HE的联络点. 且高氨血症绝不是唯一的因素, 多种毒素都能与之相互协同, 相互依赖, 互为因果, 导致代谢毒性物质产生增多、比例失衡, 他们的协同毒性可能在HE的发病机制中有重要作用. 因此, 应深入研究HE的发病机制, 了解他们的相互作用, 发现阻断途径和靶点, 指导临床治疗.
总之, 在因HE入院患者中, 感染居乙肝后肝硬化发生HE诱因的首位. 肝功能C级、合并腹水、高血氨、高血清总胆红素、高血尿素氮、低血钠、低血清胆碱酯酶、低血清白蛋白和凝血酶原时间延长可增加HE的发生率. 高血氨、高血尿素氮、低血钠和低血清胆碱酯酶可加重HE的程度, 并影响预后. 本研究致力于寻找乙肝后肝硬化HE患者发生、发展的影响因素, 在临床工作中能够更好的进行监测和干预, 降低HE的发生率和改善预后. 但本研究作为回顾性分析, 对一些可疑因素如血脂指标、C反应蛋白等因素没有完整的数据资料未能进行监测与分析, 对患者病情发展无法做到随访观察. 因此, 今后可进一步对乙肝后肝硬化患者进行前瞻性研究, 以便更全面的研究乙肝后肝硬化患者HE的发生与发展, 指导预防和治疗.
我国是乙型肝炎的高流行区, 其中25%以上的携带者将发展为慢性肝炎, 而肝性脑病(HE)又是肝硬化最危险的并发症, 死亡率高. 目前HE发病机制仍未完全明了, 且缺乏特效治疗.
吴君, 主任医师, 贵阳医学院附属医院感染科
目前HE治愈后容易反复, 尚无确切彻底的治疗方法. 本研究旨在寻求与HE发生、发展密切相关的因素, 有针对性的进行监测或干预, 减少HE的发生或给予早期防治, 以提高患者的生活质量、延长生存期及改善预后.
把对影响乙肝后肝硬化HE发生、发展的相关因素应用于指导临床, 将对HE的防治起到非常重要的作用.
肝性脑病: 一种以严重肝脏疾病或门体分流所致的代谢紊乱为基础, 并排除了其他已知脑病的中枢神经系统功能失调综合征.
本研究旨在寻求与HE发生、发展密切相关的因素, 结果有一定的临床指导意义.
编辑: 张姗姗 电编:鲁亚静
| 1. | Ferenci P, Lockwood A, Mullen K, Tarter R, Weissenborn K, Blei AT. Hepatic encephalopathy--definition, nomenclature, diagnosis, and quantification: final report of the working party at the 11th World Congresses of Gastroenterology, Vienna, 1998. Hepatology. 2002;35:716-721. [PubMed] [DOI] |
| 2. | Maddrey WC. Hepatitis B: an important public health issue. J Med Virol. 2000;61:362-366. [PubMed] [DOI] |
| 3. | Mast EE, Alter MJ, Margolis HS. Strategies to prevent and control hepatitis B and C virus infections: a global perspective. Vaccine. 1999;17:1730-1733. [PubMed] [DOI] |
| 4. | Liaw YF, Tai DI, Chu CM, Chen TJ. The development of cirrhosis in patients with chronic type B hepatitis: a prospective study. Hepatology. 1988;8:493-496. [PubMed] [DOI] |
| 6. | Forman LM, Lucey MR. Predicting the prognosis of chronic liver disease: an evolution from child to MELD. Mayo End-stage Liver Disease. Hepatology. 2001;33:473-475. [PubMed] [DOI] |
| 7. | Rohra DK, Jaipal AA, Mahmood K, Ahuja KL. Precipitating factors of hepatic encephalopathy in patients with chronic liver disease at Civil Hospital Karachi. J Coll Physicians Surg Pak. 2008;18:130-131. [PubMed] |
| 8. | Devrajani BR, Shah SZ, Devrajani T, Kumar D. Precipitating factors of hepatic encephalopathy at a tertiary care hospital Jamshoro, Hyderabad. J Pak Med Assoc. 2009;59:683-686. [PubMed] |
| 9. | Benhaddouch Z, Abidi K, Naoufel M, Abouqal R, Zeggwagh AA. [Mortality and prognostic factors of the cirrhotic patients with hepatic encephalopathy admitted to medical intensive care unit]. Ann Fr Anesth Reanim. 2007;26:490-495. [PubMed] [DOI] |
| 11. | Shawcross DL, Olde Damink SW, Butterworth RF, Jalan R. Ammonia and hepatic encephalopathy: the more things change, the more they remain the same. Metab Brain Dis. 2005;20:169-179. [PubMed] [DOI] |
| 12. | Iacobone E, Bailly-Salin J, Polito A, Friedman D, Stevens RD, Sharshar T. Sepsis-associated encephalopathy and its differential diagnosis. Crit Care Med. 2009;37:S331-S336. [PubMed] [DOI] |
| 13. | Shawcross DL, Shabbir SS, Taylor NJ, Hughes RD. Ammonia and the neutrophil in the pathogenesis of hepatic encephalopathy in cirrhosis. Hepatology. 2010;51:1062-1069. [PubMed] [DOI] |
| 14. | Butterworth RF. Pathophysiology of hepatic encephalopathy: The concept of synergism. Hepatol Res. 2008;38:S116-S121. [PubMed] [DOI] |
| 15. | Arias JL, Aller MA, Sánchez-Patan F, Arias J. The inflammatory bases of hepatic encephalopathy. Eur J Gastroenterol Hepatol. 2006;18:1297-1310. [PubMed] [DOI] |
| 16. | Dhiman RK, Chawla YK. Minimal hepatic encephalopathy. Indian J Gastroenterol. 2009;28:5-16. [PubMed] [DOI] |
| 17. | Bo ZJ, Qiu DK, Ma X, Zhang GS, Fan ZP, Huang YQ, Yu XF, Zeng MD. [Assessment of the health-related quality of life of patients with minimal hepatic encephalopathy]. Zhonghua Ganzangbing Zazhi. 2007;15:412-416. [PubMed] |
| 18. | Omagari K, Ohba K, Kadokawa Y, Hazama H, Masuda J, Kinoshita H, Matsuo I, Ohnita K, Mizuta Y, Hayashida K. Comparison of the grade evaluated by "Liver damage" of Liver Cancer Study Group of Japan and Child-Pugh classification in patients with hepatocellular carcinoma. Hepatol Res. 2006;34:266-272. [PubMed] [DOI] |
| 19. | Häuser W, Holtmann G, Grandt D. Determinants of health-related quality of life in patients with chronic liver diseases. Clin Gastroenterol Hepatol. 2004;2:157-163. [PubMed] [DOI] |
| 20. | Hillaire S, Voitot H. [Cirrhosis]. Pathol Biol (Paris). 1999;47:895-902. [PubMed] |
| 21. | Fernández-Esparrach G, Sánchez-Fueyo A, Ginès P, Uriz J, Quintó L, Ventura PJ, Cárdenas A, Guevara M, Sort P, Jiménez W. A prognostic model for predicting survival in cirrhosis with ascites. J Hepatol. 2001;34:46-52. [PubMed] [DOI] |
| 22. | Magliocchetti N, Torchio P, Corrao G, Aricò S, Favilli S. Prognostic factors for long-term survival in cirrhotic patients after the first episode of liver decompensation. Ital J Gastroenterol Hepatol. 1997;29:38-46. [PubMed] |
| 23. | Romero-Gómez M, Boza F, García-Valdecasas MS, García E, Aguilar-Reina J. Subclinical hepatic encephalopathy predicts the development of overt hepatic encephalopathy. Am J Gastroenterol. 2001;96:2718-2723. [PubMed] |
| 24. | Kim DU, Park GT, Koh DH, Cho HS, Kim YH, Shim SG, Kim JB, Lee SH, Choi HS, Hahm JS. [Five-year follow-up of clinical and laboratory data of early liver cirrhosis patients confirmed by liver biopsy]. Taehan Kan Hakhoe Chi. 2002;8:256-263. [PubMed] |
| 25. | Hartmann IJ, Groeneweg M, Quero JC, Beijeman SJ, de Man RA, Hop WC, Schalm SW. The prognostic significance of subclinical hepatic encephalopathy. Am J Gastroenterol. 2000;95:2029-2034. [PubMed] [DOI] |
| 26. | Takikawa Y, Endo R, Suzuki K, Tsubouchi H. Early prediction of short-term development of hepatic encephalopathy in patients with acute liver disease unrelated to paracetamol. A prospective study in Japan. J Hepatol. 2009;51:1021-1029. [PubMed] [DOI] |
| 27. | Jang JW. Current status of liver diseases in Korea: liver cirrhosis. Korean J Hepatol. 2009;15 Suppl 6:S40-S49. [PubMed] [DOI] |
| 28. | Ackermann D. [Treatment of ascites, hyponatremia and hepatorenal syndrome in liver cirrhosis]. Ther Umsch. 2009;66:747-751. [PubMed] [DOI] |
| 29. | Häussinger D, Schliess F. Pathogenetic mechanisms of hepatic encephalopathy. Gut. 2008;57:1156-1165. [PubMed] [DOI] |
| 30. | Shaikh S, Mal G, Khalid S, Baloch GH, Akbar Y. Frequency of hyponatraemia and its influence on liver cirrhosis-related complications. J Pak Med Assoc. 2010;60:116-120. [PubMed] |
| 31. | Kim JH, Lee JS, Lee SH, Bae WK, Kim NH, Kim KA, Moon YS. The association between the serum sodium level and the severity of complications in liver cirrhosis. Korean J Intern Med. 2009;24:106-112. [PubMed] [DOI] |
| 32. | Angeli P, Wong F, Watson H, Ginès P. Hyponatremia in cirrhosis: Results of a patient population survey. Hepatology. 2006;44:1535-1542. [PubMed] [DOI] |
| 33. | Kim SU, Han KH, Nam CM, Park JY, Kim do Y, Chon CY, Ahn SH. Natural history of hepatitis B virus-related cirrhotic patients hospitalized to control ascites. J Gastroenterol Hepatol. 2008;23:1722-1727. [PubMed] [DOI] |
| 34. | Jenq CC, Tsai MH, Tian YC, Chang MY, Lin CY, Lien JM, Chen YC, Fang JT, Chen PC, Yang CW. Serum sodium predicts prognosis in critically ill cirrhotic patients. J Clin Gastroenterol. 2010;44:220-226. [PubMed] [DOI] |
| 35. | Bustamante J, Rimola A, Ventura PJ, Navasa M, Cirera I, Reggiardo V, Rodés J. Prognostic significance of hepatic encephalopathy in patients with cirrhosis. J Hepatol. 1999;30:890-895. [PubMed] [DOI] |
| 36. | Albrecht J, Jones EA. Hepatic encephalopathy: molecular mechanisms underlying the clinical syndrome. J Neurol Sci. 1999;170:138-146. [PubMed] [DOI] |
| 38. | Mathurin S, Jaimet C, Turletti C, Arosio A, González G, Kuzmicz G. [Renal failure in patients with cirrhosis and ascites: incidence, etiology and predictive factors]. Acta Gastroenterol Latinoam. 2008;38:116-125. [PubMed] |
| 39. | He Y, Li GX, Xia Y. [Analysis of the relationship between hepatorenal syndrome and plasma ammonia]. Zhonghua Ganzangbing Zazhi. 2010;18:45-48. [PubMed] |